Veden kemia 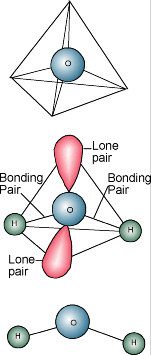 Tiedät varmaan, että veden kemiallinen kuvaus on H2O. Vesimolekyyli koostuu yhdestä happiatomista, joka on sitoutunut kahteen vetyatomiin. Vetyatomit ovat ”kiinnittyneet” happiatomin toiselle puolelle, jolloin vesimolekyylillä on positiivinen varaus sillä puolella, jossa vetyatomit ovat, ja negatiivinen varaus toisella puolella, jossa happiatomi on. Koska vastakkaiset sähkövaraukset vetävät toisiaan puoleensa, vesimolekyylit pyrkivät vetämään toisiaan puoleensa, mikä tekee vedestä tavallaan ”tahmeaa”. Vetyatomien puoli (positiivinen varaus) vetää puoleensa toisen vesimolekyylin happipuolta (negatiivinen varaus).
Tiedät varmaan, että veden kemiallinen kuvaus on H2O. Vesimolekyyli koostuu yhdestä happiatomista, joka on sitoutunut kahteen vetyatomiin. Vetyatomit ovat ”kiinnittyneet” happiatomin toiselle puolelle, jolloin vesimolekyylillä on positiivinen varaus sillä puolella, jossa vetyatomit ovat, ja negatiivinen varaus toisella puolella, jossa happiatomi on. Koska vastakkaiset sähkövaraukset vetävät toisiaan puoleensa, vesimolekyylit pyrkivät vetämään toisiaan puoleensa, mikä tekee vedestä tavallaan ”tahmeaa”. Vetyatomien puoli (positiivinen varaus) vetää puoleensa toisen vesimolekyylin happipuolta (negatiivinen varaus).
Kaikki nämä toisiaan puoleensa vetävät vesimolekyylit merkitsevät sitä, että niillä on taipumus kasautua yhteen. Siksi vesipisarat ovat itse asiassa pisaroita! Ilman joitakin maapallon voimia, kuten painovoimaa, vesipisara olisi pallon muotoinen – täydellinen pallo. Vaikka se ei muodostaisikaan täydellistä palloa maapallolla, meidän pitäisi olla iloisia siitä, että vesi on tahmeaa.
Vettä kutsutaan ”universaaliksi liuottimeksi”, koska se liuottaa enemmän aineita kuin mikään muu neste. Tämä tarkoittaa, että minne tahansa vesi kulkeekin, joko maaperän tai kehomme läpi, se vie mukanaan arvokkaita kemikaaleja, mineraaleja ja ravinteita.
Puhtaan veden pH on neutraali. Puhtaan veden pH on noin 7, eli se ei ole hapanta eikä emäksistä.
Veden fysikaaliset ominaisuudet:
Vesi on ainutlaatuinen siinä mielessä, että se on ainoa luonnollinen aine, joka esiintyy kaikissa kolmessa olomuodossaan – nestemäisenä, kiinteänä (jää) ja kaasuna (höyry) – maapallolla tavanomaisesti esiintyvissä lämpötiloissa. Maapallon vesi on jatkuvasti vuorovaikutuksessa, muuttumassa ja liikkeessä.
 Vesi jäätyy 32 celsiusasteessa ja kiehuu 212 celsiusasteessa.
Vesi jäätyy 32 celsiusasteessa ja kiehuu 212 celsiusasteessa.
Veden jäätymis- ja kiehumispisteet ovat itse asiassa perusviiva, jolla lämpötilaa mitataan: 0 celsiusastetta on veden jäätymispiste ja 100 celsiusastetta on veden kiehumispiste. Vesi on epätavallista siinä mielessä, että sen kiinteä olomuoto, jää, on vähemmän tiheä kuin nestemäinen olomuoto, minkä vuoksi jää kelluu.
Vedellä on korkea ominaislämpöindeksi. Tämä tarkoittaa, että vesi voi absorboida paljon lämpöä ennen kuin se alkaa kuumentua. Tämän vuoksi vesi on arvokasta teollisuudelle ja autosi jäähdyttimessä jäähdytysnesteenä. Veden korkea ominaislämpöindeksi auttaa myös säätelemään ilman lämpötilan vaihtumisnopeutta, minkä vuoksi lämpötilan vaihtelu vuodenaikojen välillä on asteittaista eikä äkillistä, erityisesti valtamerten läheisyydessä.
Vedellä on erittäin suuri pintajännitys. Toisin sanoen vesi on tahmeaa ja joustavaa, ja sillä on taipumus kasaantua pisaroiksi sen sijaan, että se leviäisi ohueksi kalvoksi. Pintajännitys on vastuussa kapillaaritoiminnasta, jonka ansiosta vesi (ja siihen liuenneet aineet) voivat liikkua kasvien juurien ja kehomme pienten verisuonten läpi.
Veden lämpötila:
Veden lämpötila ei ole tärkeä vain uimareille ja kalastajille, vaan myös teollisuudelle ja jopa kaloille ja leville. Sähköä tuottavissa voimalaitoksissa käytetään paljon vettä jäähdytykseen. Ne tarvitsevat aluksi viileää vettä, ja ne päästävät yleensä lämpimämpää vettä takaisin ympäristöön. Päästetyn veden lämpötila voi vaikuttaa alajuoksulla sijaitseviin elinympäristöihin. Lämpötila voi myös vaikuttaa veden kykyyn sitoa happea sekä eliöiden kykyyn vastustaa tiettyjä saasteita.
pH:
pH mittaa sitä, kuinka hapanta/emäksistä vesi on. Vaihteluväli on 0-14, ja 7 on neutraali. Alle 7:n pH viittaa happamuuteen, kun taas yli 7:n pH viittaa emäksisyyteen. pH on oikeastaan vapaiden vety- ja hydroksyyli-ionien suhteellisen määrän mitta vedessä. Vesi, jossa on enemmän vapaita vetyioneja, on hapanta, kun taas vesi, jossa on enemmän vapaita hydroksyyli-ioneja, on emäksistä. Koska vedessä olevat kemikaalit voivat vaikuttaa pH:han, pH on tärkeä kemiallisesti muuttuvan veden indikaattori. pH ilmoitetaan ”logaritmisina yksikköinä”, kuten maanjäristyksiä mittaava Richterin asteikko. Jokainen numero vastaa 10-kertaista muutosta veden happamuudessa/emäksisyydessä. Vesi, jonka pH on 5, on kymmenen kertaa happamampaa kuin vesi, jonka pH on kuusi.
Saasteet voivat muuttaa veden pH:ta, mikä puolestaan voi vahingoittaa vedessä eläviä eläimiä ja kasveja. Esimerkiksi hylätystä hiilikaivoksesta tulevan veden pH voi olla 2, mikä on hyvin hapanta ja vaikuttaisi varmasti kaikkiin kaloihin, jotka olisivat niin hulluja, että yrittäisivät elää siinä! Logaritmiasteikkoa käyttäen tämä kaivoksen valumavesi olisi 100 000 kertaa happamampaa kuin neutraali vesi – pysy siis poissa hylätyistä kaivoksista.
Ominaisjohtavuus:
Ominaisjohtavuus mittaa veden kykyä johtaa sähkövirtaa. Se on hyvin riippuvainen veteen liuenneiden kiintoaineiden (kuten suolan) määrästä. Puhtaan veden, kuten tislatun veden, ominaisjohtavuus on hyvin alhainen, ja meriveden ominaisjohtavuus on korkea. Sadevesi liuottaa usein ilmassa olevia kaasuja ja pölyä ilmassa ollessaan, joten sen ominaisjohtavuus on usein suurempi kuin tislatun veden. Ominaisjohtavuus on tärkeä vedenlaatumittaus, koska se antaa hyvän käsityksen veteen liuenneen aineksen määrästä.
Olet luultavasti koulussa tehnyt kokeen, jossa kytket pariston hehkulamppuun ja johdatat paristosta kaksi johtoa vesilasiin. Kun johdot laitetaan tislattua vettä sisältävään dekantterilasiin, lamppu ei syty. Mutta lamppu syttyy, kun dekantterilasi sisältää suolavettä (suolaliuosta). Suolaveteen on liuennut suolaa, jolloin vapaita elektroneja vapautuu, ja vesi johtaa sähkövirtaa.
Turbidity:
Turbidity on veden sameuden mitta. Sitä mitataan johtamalla valonsäde veden läpi ja katsomalla, kuinka paljon se heijastuu vedessä olevista hiukkasista. Veden sameus johtuu vedessä leijuvasta (kelluvasta) materiaalista, kuten liasta ja lehtien jäämistä. Kristallinkirkkaassa vedessä, kuten Tahoe-järvessä (jossa tehdään kovasti töitä sen eteen, että sedimenttiä ei huuhtoudu järveen), on hyvin vähän sameutta. Mutta katso jokea myrskyn jälkeen – se on todennäköisesti ruskea. Näet vedessä kaiken suspendoituneen maa-aineksen. Meidän onneksemme juomaveden sameutta aiheuttavat aineet joko laskeutuvat pois tai suodatetaan ennen kuin vesi päätyy juomalaseihimme kotona. Sameus mitataan nefelometrisinä sameusyksikköinä (NTU).
Liuennut happi:
Vaikka vesimolekyylit sisältävät happiatomin, luonnonvesissämme elävät vesieliöt eivät tarvitse tätä happea. Pieni määrä happea, jopa noin kymmenen happimolekyyliä miljoonaa vesimiljoonaa kohti, on itse asiassa liuennut veteen. Tätä liuennutta happea hengittävät kalat ja eläinplankton, ja ne tarvitsevat sitä selviytyäkseen.
Nopeasti liikkuvassa vedessä, kuten vuoristopurossa tai suuressa joessa, on yleensä paljon liuennutta happea, kun taas seisovassa vedessä sitä on vähän. Prosessi, jossa vedessä olevat bakteerit auttavat orgaanisen aineksen, kuten jätevedenpuhdistamosta peräisin olevan aineksen, hajoamisessa, kuluttaa happea. Näin ollen liiallinen orgaaninen aines järvissä ja joissa voi aiheuttaa hapenpuutetilanteen. Vesieliöillä voi olla vaikeuksia seisovassa vedessä, jossa on paljon mätänevää orgaanista ainesta, erityisesti kesällä, jolloin liuenneen hapen määrä on kausiluonteisesti alhainen.
Kovuus:
Veteen liuenneen kalsiumin ja magnesiumin määrä määrittää veden ”kovuuden”. Veden kovuus vaihtelee eri puolilla Yhdysvaltoja. Jos asut alueella, jossa vesi on ”pehmeää”, et ehkä ole koskaan edes kuullut veden kovuudesta. Mutta jos asut Floridassa, New Mexicossa, Arizonassa, Utahissa, Wyomingissa, Nebraskassa, Etelä-Dakotassa, Iowassa, Wisconsinissa tai Indianassa, jossa vesi on suhteellisen kovaa, saatat huomata, että käsiäsi tai vaatteitasi pestäessäsi on vaikea saada vaahtoa. Lisäksi alueesi teollisuus saattaa joutua käyttämään rahaa veden pehmentämiseen, sillä kova vesi voi vahingoittaa laitteita. Kova vesi voi jopa lyhentää kankaiden ja vaatteiden käyttöikää! Tarkoittaako tämä, että opiskelijat, jotka asuvat alueilla, joilla on kovaa vettä, pysyvät viimeisimmän muodin mukana, koska heidän vaatteensa kuluvat nopeammin?
Suspendoitunut sedimentti:
Suspendoitunut sedimentti on purossa liikkuvan maa-aineksen määrä. Se riippuu suuresti veden virtausnopeudesta, sillä nopeasti virtaava vesi voi poimia ja suspendoida enemmän maa-ainesta kuin rauhallinen vesi. Myrskyjen aikana maa-ainesta huuhtoutuu puron rannoilta puroon. Puroon huuhtoutuvan maa-aineksen määrä riippuu siitä, millaista maata joen valuma-alueella on ja millainen kasvillisuus ympäröi jokea.
Jos purojen varrella olevaa maata häiritään eikä suojelutoimia toteuteta, ylimääräinen sedimentti voi vahingoittaa puron vedenlaatua. Olet varmaan nähnyt niitä lyhyitä muovisia aitoja, joita rakentajat pystyttävät kehitettävän tontin reunoille. Näiden lieteaitojen on tarkoitus pidättää sedimenttiä sadekuurojen aikana ja estää sitä huuhtoutumasta puroon, sillä liiallinen sedimentti voi vahingoittaa puroja, jokia, järviä ja tekoaltaita.
Tekoaltaaseen tuleva sedimentti on aina huolenaihe; kun se on kerran päässyt sinne, se ei pääse sieltä enää pois – suurin osa siitä laskeutuu pohjalle. Altaat voivat ”liettyä”, jos niihin pääsee liikaa sedimenttiä. Säiliön tilavuus pienenee, jolloin veneilyyn, kalastukseen ja virkistyskäyttöön tarkoitettu alue pienenee ja padon voimalaitoksen sähköntuotantokyky heikkenee.
Vesiliuoksen geokemia:
Katso kaavio hydrogeokemiallisesta kierrosta.
- Happo = vetyä sisältävä aine, joka veteen liuetessaan antaa vapaata vetyä (H + )
- Emäs = OH-ryhmää sisältävä aine, joka veteen liuetessaan antaa vapaata (OH – )
-
Hapan liuos on liuos, jossa on ylimäärin vapaata H + -ryhmää, ja emäksellä liuos, jossa on ylimäärin vapaata OH – ryhmää. Hapon ja emäksen välistä reaktiota kutsutaan yleensä neutraloinniksi.
Esim:
-
HCl (happo) + NaOH (emäs) ==> H 2 O + NaCl
jotka dissosioituvat ioneiksi:
H + + Cl – + Na + + OH – ==> H 2 O + Na + Na + + Cl – - eli Na + ja Cl – eivät muutu.
- pH = vapaan H + -pitoisuuden (aktiivisuuden) käänteinen logaritmi eli pH = -log
-
Vesi dissosioituu H + :ksi ja OH – :ksi ;
-
dissosiaatiovakio on: K vesi = = =10 -14
- Kilogramman neutraalissa liuoksessa on siis oltava 10 -7 moolia kumpaakin H+:a ja OH -:a 25 °C:n vakiolämpötilassa. Yksi mooli on 6,023 x 10 23 atomia (tai molekyyliä) ja H 2 O:n molekyylipaino on 18 grammaa moolia kohti. Yhdessä kilogrammassa vettä on noin 1000/18 = 55,6 moolia vettä eli noin 3,35 x 10 25 happiatomia ja noin kaksinkertainen määrä (6,7 x 10 25 atomia) H+:a (vapaan H+:n tai vapaan OH -:n määrä on suhteellisen pieni verrattuna dissosioitumattoman H 2 O:n määrään).
- pH vaihtelee 25 °C:ssa välillä 0-14; pH < 7 = hapan liuos; pH > 7 = emäksinen liuos. Jos HCl:ää tai muuta happoa lisätään, pH laskee; jos NaOH:ta tai muuta emästä lisätään, pH nousee.
- pH kasvaa, kun hiilihappo (heikko happo) dissosioituu: Kun hiilidioksidi yhdistyy veteen, kuten ilmakehässä tapahtuu, kun fossiilisia polttoaineita poltetaan, syntyy hiilihappoa: H 2 O + CO 2 ==> H 2 CO 3 . Peräkkäisten dissosiaatioiden aikana vapautuu vapaita H + -molekyylejä:
-
H 2 CO 3 ==> H + + HCO 3- hiilihappo bikarbonaatiksi, tapahtuu pH:ssa ~6,4
-
HCO 3 ==> H + + CO 32- bikarbonaatti karbonaatiksi, tapahtuu pH:ssa ~10.3
Muista, että vapaata H + on käytettävissä vain happamassa tilassa eli kun pH < ~7. Bikarbonaatin dissosiaatio karbonaatiksi tapahtuu, kun systeemissä on liikaa OH – ja H + ”vapautuu” emäksen tasapainottamiseksi.
- Veteen liuenneet kationit ja anionit
Kationit = elektronin luovuttajia, positiivisesti varautuneita: Na + , K + , Mg ++ , Ca ++ , Fe ++ tai Fe +++ , Mn ++ , Al +++
Anionit = elektronien akseptorit, negatiivisesti varautuneet: Cl – , F – , I – , Br – , SO 4– , CO 3– , HCO 3- , NO 3– , NO 2-
Metallit = käyttäytyvät kuin kationit useimmiten: Cu, Zn, Pb, Co, Ni, Cr, As, Se, Mo jne.
- Vesianalyysit – Tarvitaan kationi-anionitasapaino
milliekvivalentti (MEQ) = mooliekvivalenttivaraus tai anionin tai kationin varaus, liuokseen liuenneen kyseisen ionin aiheuttaman kokonaisvarauksen mitta. Aloitetaan konsentraatiosta, jaetaan moolipainolla, kerrotaan varauksella: XX mg/L / MW x CHG = MEQ
Esim: NaCl liuoksessa, Na = 50 mg/L (50 ppm): 50/23 x 1 = 2,17 MEQ
Cl = 77 mg/L (77 ppm): 77/35,5 x -1 = -2,17 MEQ
Jos siis kationien ja anionien kokonais-MEQ:t eivät ole tasapainossa, analyysissä on virhe.