MITÄ ON SYNNYTYVÄ SEPELVALTIMOANOMALIA?
Keskustellaan jatkuvasti siitä, mitä on pidettävä normaalina ja mitä sepelvaltimoiden poikkeavuutena (CAA). Angelinin1 mukaan CAA diagnosoidaan poissulkemalla, mikä tarkoittaa, että niissä tapauksissa, joissa sepelvaltimoiden morfologia ei ole normaali, normaalius määritellään tilastollisten kriteerien mukaisesti (keskiarvon plus tai miinus kahden keskihajonnan väli). Näin ollen CAA:lla tarkoitettaisiin sitä sepelvaltimoiden morfologiaa, joka havaitaan alle yhdellä prosentilla väestöstä.1,2 CAA:t voivat syntyä normaalin tai patologisen kardiogeneesin aikana: ensimmäisessä tapauksessa tuloksena olisi eristetty CAA, johon keskitymme tässä artikkelissa, kun taas jälkimmäisessä tapauksessa ne liittyisivät muihin sydämen epämuodostumiin.
LUOKITTELU
Luokituksia on useita.1-3. Hiljattain on ehdotettu uutta luokittelua, jossa pyritään standardoimaan diagnostiset kriteerit ja ryhmitellään CAA seitsemään luokkaan4 (taulukko 1).


Kansainväliset ryhmät vaativat, että rekistereihin tulisi sisällyttää ainakin ne anomaliat, jotka aiheuttavat suurimman osan CAA:n syyksi katsotuista kliinisistä tapahtumista (äkkikuolema ja sydänlihasiskemia),5-7, jotka ovat peräisin kontralateraalisesta tai ”väärästä” Valsalvan sinuksesta. Tähän ryhmään kuuluvat yksisuuntaiset sepelvaltimot (”hyperdominanssi” Rigatellin ja muiden4 luokittelussa), koska niiden on syötettävä verta sydänlihakseen yhdestä ainoasta sepelvaltimotiehyestä (ostium), ja ne muodostavat reittejä, jotka ovat toisinaan samanlaisia kuin väärästä Valsalvan sinuksesta peräisin olevan CAA:n reitit (kuva 1).

Kuva 1. Sepelvaltimoiden arteriografia vasemmanpuoleisessa etuviistoprojektiossa, jossa näkyy yksisuuntainen oikea sepelvaltimo.
TAPAHTUMA
Erilaiset määritelmät tai luokittelut ja sekä angiografisten8,9 että ruumiinavaussarjojen10 ja viime vuosina myös kaikukardiografisten sarjojen11 analyysi johtavat siihen, että CAA:n raportoitu ilmaantuvuus vaihtelee 0,1 %:n ja 8,4 %:n väliltä1,8,11 , minkä vuoksi niiden edustaman ongelman tarkkaa laajuutta on vaikea määrittää. Kaiken kaikkiaan ilmaantuvuus saattaa olla melko samanlainen kuin muissa sairauksissa, jotka olemme pystyneet määrittelemään tarkemmin, kuten
hypertrofinen kardiomyopatia (0,2 %)12 tai Wolff-Parkinson-Whiten oireyhtymä (0,1-0,3 %).13
Väärän sinuksen alkuperää olevien anomaalisten sepelvaltimoiden ja yksisuuntaisten sepelvaltimoiden ilmaantuvuus sepelvaltimoiden varjoainetutkimuksissa vaihtelee välillä 0,1-0,3 %.28 %:n ja 1,74 %:n välillä.2,3,8,9,14-16 Ottaen huomioon niiden kliinisen merkityksen keskitymme katsauksessamme näihin anomalioihin.
KLIINISET ESIMERKIT
Alun perin nämä anomaliat diagnosoitiin sepelvaltimoiden varjoainekuvauksessa, joka suoritettiin potilailla, joilla oli läppätulehdus tai sepelvaltimotaudin iskeeminen sydänsairaus, eikä niillä katsottu olevan kliinistä merkitystä. Myöhemmin alettiin raportoida äkkikuolemista nuorilla urheilijoilla, joilla ainoa taudin merkki oli sepelvaltimoista peräisin oleva anomalia.8,17
Kliininen kirjo esittelyvaiheessa on vaihteleva: jotkut potilaat ovat oireettomia, kun taas toisilla esiintyy angina pectorista, hengenahdistusta, pyörtymistä, akuuttia sydäninfarktia, sydämen vajaatoimintaa ja äkkikuolemaa.1,2,5,8,17-20. Nykyisin CAA:ta pidetään toiseksi yleisimpänä äkkikuoleman syynä urheilijoilla Yhdysvalloissa.21
Tarkoittaako tämä, että kaikkia CAA:ta olisi pidettävä korkean riskin merkkinä? Ei missään nimessä, mutta strategisesta näkökulmasta niitä olisi pidettävä ”mahdollisesti pahanlaatuisina”, kunnes tehdään lisäkokeita poikkeavuuden aiheuttaman sydänlihasiskemian poissulkemiseksi.
Suuri huolenaihe on sen määrittäminen, mitkä CAA:t voivat aiheuttaa äkkikuoleman. Nykyään tiedämme, että äkkikuoleman ilmaantuvuus on suurin niissä, jotka kulkevat interarteriaalisesti (tai intramuraalisesti), joissa anomaalinen sepelvaltimo on hallitseva ja jotka aiheuttavat kliinisiä oireita alle 30- tai 35-vuotiailla potilailla.22-26
Sen vuoksi lähestymistapamme CAA:han pitäisi vaihdella potilaan iän mukaan. Nuorilla, alle 35-vuotiailla ”keskitymme” äkkikuoleman ehkäisyyn, kun taas yli 35-vuotiailla päätavoitteena on sydänlihasiskemian hoito (kuva 2).
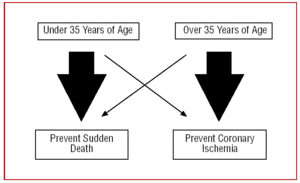
Kuva 2. Erilainen lähestymistapa potilaan iän mukaan.
Joskus CAA voi vaurioitua alkuperänsä ja anomaalisen kulkunsa vuoksi läpänvaihtoleikkauksen yhteydessä, mutta tämä voi tapahtua myös perkutaanisen foramen ovale -sulun yhteydessä. Tästä syystä CAA:n esiintyminen olisi suljettava pois ennen tämäntyyppisiä toimenpiteitä.27-30
KORONAARIOOMALIOIDEN ISKEMIAN PATHOPHYSIOLOGIA
CAA:n iskemian syntymekanismeja selittää useita teorioita31 , mutta mitään niistä ei ole pystytty selvästi osoittamaan. Yhden teorian mukaan syynä pidetään anomaalisen valtimon huomattavaa kulmikkuutta siinä kohdassa, jossa se erkanee aortasta. Toisin kuin normaali sepelvaltimo, joka on kohtisuorassa aorttaan nähden lähtökohdassaan, poikkeava sepelvaltimo joutuu taipumaan itsensä yli päästäkseen Valsalvan sinuksen vastakkaiselta puolelta normaalille syöttöalueelleen. Tämän vuoksi anomaalisen sepelvaltimon ostium on pienempi ja siinä on venttiilimäisiä harjanteita verrattuna normaaliin pyöreään ostiumiin, ja se voi puristua, jos aortta laajenee huomattavasti, kuten rasittavassa liikunnassa.32
Toinen teoria viittaa CAA:n alkukulkuun. Kun se on interarteriaalinen, aortan ja keuhkovaltimon välissä, rasituksen aikana tapahtuva paineen nousu näissä kahdessa verisuonessa aiheuttaisi anomaalisen sepelvaltimon puristumisen.33 Lisäksi, jos alkuperäinen kulku on intramuraalinen, tukos voi voimistua, koska sepelvaltimo voi deformoitua aortan seinämän sisällä hypertension aikana.34
Jotkut kirjoittajat katsovat, että iskemiaan johtavaan mekanismiin kuuluu spasmin syntyminen poikkeavan sepelvaltimon anomaaliseen sepelvaltimoon poikkeavan väylän aiheuttaman endoteelivaurion seurauksena35 , ja toiset taas katsovat, että syntyisi CAA:n proksimaalisen osan ahtauma aortan seinämässä.31
Loppujen lopuksi kaikki käsitellyt mekanismit voivat aiheuttaa akuuttia tai kroonista iskemiaa (vähäisiä iskeemisiä tapahtumia), jotka aiheuttavat sydänlihaksen fibroosia, joka puolestaan voi olla syynä kuolemaan johtavien rytmihäiriöiden syntyyn.36
MITEN KORONAARINEN ANOMALIA DIAGNOSOIDAAN?
Diagnoosi edellyttää korkeaa epäilyn indeksiä ja arviointia sen olemassaolosta tietyissä olosuhteissa. Kuten edellä mainittiin, useimmat CAA:t löydetään satunnaisesti sepelvaltimoiden varjoainekuvauksissa, jotka tehdään potilaille, joilla on iskeeminen sydänsairaus tai läppävika ja joille tehdään tämä tutkimus ennen läpänvaihtoleikkausta.
Nuoret, joilla ei ole sepelvaltimotautien riskitekijöitä tai niihin liittyvää läppävikaa, muodostavat suurimman diagnostisen haasteen. Meidän tulisi epäillä CAA:ta, jos esiintyy rasitussynkopeeta, hengenahdistusta tai angina pectorikseen viittaavaa rintakipua.24,26,35 Ilmeisesti ensimmäinen diagnostinen testi, jonka me kaikki suoritamme, on vakioergometria. Se ei kuitenkaan ole osoittautunut kovin hyödylliseksi tämäntyyppisillä potilailla, koska se on yleensä negatiivinen, mikä osoittaa, että CAA:sta johtuvaa iskemiaa esiintyy vain satunnaisesti.35,36
Koska ”toiminnallisista” testeistä ei siis ole paljon apua, on valittava kuvantamistutkimus, jonka avulla voidaan tutkia sepelvaltimoiden anatomiaa. Alun perin suositeltu ei-invasiivinen tutkimus on tranthorakaalinen kaikukardiografia (TTE).7,26,37-40 Suurimmalla osalla näistä potilaista yksinkertaisen TTE:n suorittaminen parasternaalisessa lyhyen akselin projektiossa aortan juuren tasossa mahdollistaa kahden sepelvaltimotiehyen erottamisen toisistaan ja jopa sepelvaltimotiehyen alkuperäisen kulun määrittämisen. Pellicia ja muut tutkivat 1360 huippu-urheilijaa kaikukardiografian avulla, jolloin vasemman pääsepelvaltimon ostium ja proksimaalinen osa saatiin näkyviin 97 prosentissa tapauksista ja oikea pääsepelvaltimo 80 prosentissa tapauksista.41
Juuri äskettäin Frommelt ja muut34 tekivät kaikukardiografian kaikille lapsille ja nuorille (ikähaarukka 3 kuukaudesta 20 vuoteen), jotka lähetettiin heidän sairaalaansa (1997-2002) sydänlihasiskemian oireiden, synnynnäistä sydänsairautta koskevan epäilyn tai tuki- ja liikuntaelimistön kivun vuoksi. Kaikille tehtiin tavanomainen TTE, jossa käytettiin Doppler-värivirtauskartoitusta verenkierron suunnan määrittämiseksi. He tunnistivat 10 potilasta, joilla sepelvaltimon poikkeava alkuperä oli väärässä sinuksessa (6 potilaalla vasen sepelvaltimo oli peräisin oikeasta Valsalvan sinuksesta ja 4 potilaalla oikea sepelvaltimo oli peräisin vasemmasta Valsalvan sinuksesta). Käyttämällä TTE:tä väridoppler-tekniikalla he havaitsivat aortan seinämän sisäisen kulun yhdeksällä potilaalla ja intramyokardiaalisen kulun lopulla potilaalla. Kun väärästä sinuksesta peräisin olevan CAA:n kulku on intramuraalinen, se voi näyttää tulevan ulos normaalista ostiumistaan. Näin ollen kirjoittajat suosittelevat väridopplerin hyödyntämistä virtaussuunnan määrittämiseksi silloin, kun on tarpeen sulkea pois anomalian olemassaolo.
Echokardiografisten kuvantamistekniikoiden kehittyminen mahdollistaa CAA:n alkuperän määrittämisen ja alkukulun seuraamisen tietyissä potilasryhmissä. Tutkimuksia on tehty lapsilla, nuorilla ja huippu-urheilijoilla, mutta normaalia aikuisväestöä koskevia laajoja sarjoja ei ole vielä tutkittu. Näin ollen sepelvaltimoiden ostioiden tunnistaminen nuorilla potilailla, joilla on tämä oirekuva, olisi tehtävä järjestelmällisesti TTE-tutkimuksessa.7,26
Potilaille, joilla on huono kaikukardiografinen ikkuna tai kun diagnostinen epäilys säilyy kliinisistä indikaatioista huolimatta, voidaan CAA:n alkuperän ja alkukulun visualisoimiseksi tehdä transesofageaalinen kaikukardiografia (TEE),7,26,42,43 tietokonetomografia (CT),26,44-46 – elektronisuihku- tai monisädekuvaus – (kuva 3) tai sydämen magneettikuvaus (CMRI)26,47,48 (kuva 4).

Kuva 3. Monidetektorinen tietokonetomografiakuva, jossa näkyy oikeasta sepelvaltimosta (CD) lähtevä circumflex-sepelvaltimo (Cx), joka kulkee retroaortan kautta saavuttaakseen normaalin jakautumisalueensa. Ao tarkoittaa aorttaa, AP keuhkovaltimoa. Courtesy of Dr. Gabriel C. Fernández, Servicio de Radiología, Hospital Povisa, Vigo, Espanja.
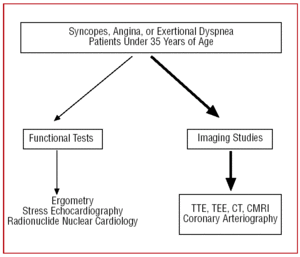
Avio 4. Ehdotettu diagnostinen protokolla alle 35-vuotiaille potilaille, joilla epäillään sepelvaltimoiden anomaliaa. CMRI tarkoittaa sydämen magneettikuvausta; CT, tietokonetomografia; TEE, transesofageaalinen kaikukardiografia; TTE, transthorakaalinen kaikukardiografia.
Mitä tekniikkaa pitäisi käyttää ja missä järjestyksessä? Kunkin lääkäriryhmän tulisi vastata tähän kysymykseen käytettävissä olevien tekniikoiden ja kokemuksensa mukaisesti. Meidän olisi tunnistettava CAA ja sen alkuvaiheen kulku käytettävissä olevalla vähiten invasiivisella tekniikalla. Vaikka TEE:tä on hyödynnetty joidenkin CAA:iden diagnosoinnissa ja alkuvaiheen tunnistamisessa, katsomme, että sen puoliinvasiivisen luonteen vuoksi sitä olisi käytettävä vasta sen jälkeen, kun muut tekniikat ovat epäonnistuneet. Nykyään, koska se on yhä paremmin saatavilla ja koska siitä voidaan saada erinomaisia kolmiulotteisia kuvia, näyttäisi olevan järkevää valita monidetektorinen tietokonetomografia (kuva 5) tai CMRI.49,50 Tavallinen sepelvaltimoiden sepelvaltimoiden arteriografia olisi aiheellista, jos muut testit eivät johda lopulliseen diagnoosiin. Tältä osin huhtikuussa 2005 julkaistussa 36. Bethesda-konferenssissa51 suositellaan sydän- ja verisuonipoikkeavuuksia sairastavien kilpaurheilijoiden valintaa: ”Sepelvaltimoiden poikkeavuuksia olisi harkittava urheilijoilla, joilla on rasitussynkopee tai oireinen kammioperäinen rytmihäiriö, ja ne olisi tutkittava asianmukaisilla tutkimuksilla, kuten kaikukardiografialla, CMR-kuvauksella tai ultranopealla tietokonetomografialla. Sepelvaltimoiden varjoainekuvaus on aiheellinen, jos muut tutkimukset eivät ole diagnostisia.” Lyhyesti sanottuna he eivät valitse 1 diagnostista tutkimusta tai toista.
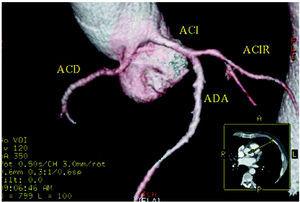
Kuva 5. Monilevyinen tietokonetomografia (16 viipaletta); kolmiulotteinen renderoitu rekonstruktio, jossa näkyy vasemmasta Valsalvan sinuksesta lähtevä oikea sepelvaltimo (ACD). ACI indiactes vasen sepelvaltimo; ACIR, circumflex coronary artery; ADA, anterior descending coronary artery. Courtesy of Dr. Joaquín Alonso, Servicio de Cardiología y Servicio de Diagnóstico por Imagen, Hospital de Fuenlabrada, Madrid, Espanja.
Potilaille, jotka ovat yli 35-vuotiaita ja joilla on angina pectoriksen kliinisiä oireita tai toistuvia pyörtymisiä, tehdään toiminnallisen testin (ergometriatutkimus, rasituskaikukardiografia ym.) jälkeen tavallisesti katetriablaatio, koska ateroskleroosin korkeampi ilmaantuvuus antaa aihetta aihetta aihetta epäilyyn, että kyseessä voi olla koronaaritauti. Tietyissä teknologialla varustetuissa keskuksissa potilaille, joilla on epätyypillinen kliininen kuva, voidaan tehdä alkuseulonta monidetektorisella CT:llä tai CRMI:llä. Kummassakin tilanteessa CAA olisi löydös (kuva 6).
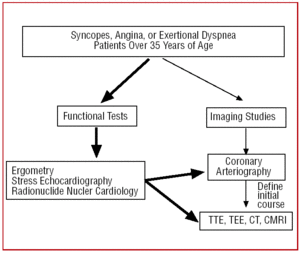
Kuva 6. Verenkiertohäiriö. Ehdotettu diagnostinen protokolla yli 35-vuotiaille potilaille, joilla epäillään sepelvaltimoiden anomaliaa. CRM tarkoittaa sydämen magneettikuvausta; CT, tietokonetomografia; TEE, transesofageaalinen kaikukardiografia; TTE, tranthorakaalinen kaikukardiografia.
Miten sepelvaltimoiden anomalian alkukehitys tunnistetaan?
Tämä on yksi sepelvaltimoiden tutkimuksen monimutkaisimmista kohdista, ja se muodostaa perustavanlaatuisen näkökohdan riskien tunnistamisessa.
Aluksi on otettava huomioon, että sepelvaltimon nimi ja luonne määräytyvät sen alueen mukaan, jota se syöttää, ei sen alkuperän mukaan. Näin ollen sepelvaltimo, joka lähtee oikeasta Valsalvan sinuksesta ja haarautuu syöttämään etummaisen laskevan valtimon ja circumflex (Cx) valtimoiden alueita, ei ole oikea sepelvaltimo vaan vasen pääsepelvaltimo, jonka alkuperä on väärässä sinuksessa. Kun sepelvaltimo lähtee väärästä sinuksesta, sen nimi, luonne ja jopa toiminta pysyvät samoina; ainoastaan sen alkuperä ja alkukulku ovat poikkeavia.2
Valsalvan väärästä sinuksesta lähdettyään poikkeava sepelvaltimo voi päästä normaalille syöttöalueelleen ainakin viittä eri reittiä pitkin2,52:
1. Retrocardia, mitraali- ja trikuspidaaliläpän takaa.
2. Retroaortta, jota yleensä seuraa Cx, jonka alkuperä on oikeassa Valsalvan sinuksessa tai oikeassa sepelvaltimossa, aortan takaseinämän vieressä, eteisen ja aortan välisessä urassa (poikittainen sinus) (kuva 3).
3. Preaorttinen tai interarteriaalinen (aortan ja keuhkovaltimon välissä), jossa anomaalinen oikea sepelvaltimo, vasen etummainen laskeva valtimo tai vasen pääsepelvaltimo ylittää väliseinän tai aortopulmonaalisen tilan. Tähän kulkuun on useimmiten liitetty iskemian merkkejä ja/tai äkkikuolema (kuvat 7 ja 8).
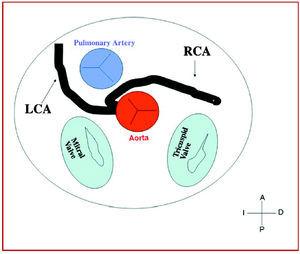
Kuva 7. Iskeeminen ja äkkikuolema. Kaavio, jossa näkyy oikean sepelvaltimon (RCA) interarteriaalinen kulku, joka saa alkunsa controlateral sinuksesta.
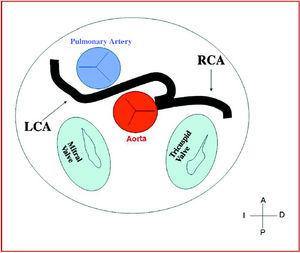
Kuva 8. Kaavio, jossa näkyy controlateral sinuksesta lähtevän vasemman sepelvaltimon (LCA) interarteriaalinen kulku.
4. Intraseptiaalinen, intraventrikulaarisen septumin yläosan läpi. Se on suurimmassa osassa tapauksista intramyokardiaalinen, ja se tunnistetaan angiografiassa sydänlihassillan kaltaisesta systolisesta ahtaumasta ja siitä, että tällä vyöhykkeellä on yleensä 1 tai 2 septaalista perforaattorihaaraa (kuva 9).

Kuva 9. Sydänlihaksen sisäinen ahtauma. Kaavio, jossa näkyy oikeasta Valsalvan sinuksesta lähtevän vasemman sepelvaltimon (CI) intraseptinen kulku.
5. Prekardiaalinen tai prepulmonaalinen, jolle on ominaista sen subepikardiaalinen sijainti oikean kammion ulosvirtauskanavan tai infundibulumin etuseinämässä. Tätä kulkua seuraa yleensä anomaalinen oikea sepelvaltimo, vasen päärunkovaltimo tai vasen etummainen laskeva sepelvaltimo.
On raportoitu muitakin mahdollisia kulkuja tai jopa useita kulkuja tietyllä potilaalla.2
Miten nämä alkukulkujen kulkutavat voidaan tunnistaa sepelvaltimoiden varjoainekuvauksessa? Aluksi katsottiin, että ohjauslangan tuominen keuhkovaltimoon ja sitä seuraava sepelvaltimoiden arteriografia sivuprojektiossa riittäisi anomalian ja suurten verisuonten välisen suhteen määrittämiseen. Tämän tekniikan arvo on kuitenkin rajallinen, koska esimerkiksi lateraalikuvassa sekä septaalinen että interarteriaalinen kulku näyttäisivät sijaitsevan keuhkovaltimon takapuolella ja aortan etupuolella, vaikka todellisuudessa septaalinen kulku sijaitsee kaudaalisesti molempiin verisuoniin nähden.53
Erolaisia sepelvaltimoiden angiografiaominaisuuksia, joiden avulla anomalia ja sen alkukulku voidaan tunnistaa, jopa ennen visualisointia, on myös raportoitu. Page ym.54 ehdottavat tältä osin kahta merkkiä, joiden avulla voidaan tunnistaa Cx:n anomaalinen alkuperä ja sen alkukurssi:
1. ”Perfuusiottoman sydänlihaksen” merkki. Vasemman sepelvaltimon selektiivisen samentumisen aikana voimme havaita vasemman kammion posterolateraalisella vyöhykkeellä avaskulaarisen alueen, joka osoittaa Cx:n anomaalisen alkuperän. Ensin on ruiskutettava kontrastiainetta vasempaan sepelvaltimon sivuonteloon, jotta voidaan sulkea pois etummaisesta laskevasta ja Cx:stä riippumattomien ostioiden osallisuus. Jos Cx:n tunnistaminen ei kuitenkaan ole selvää, on muistettava, että on yleisempää havaita oikeasta sepelvaltimon sivuontelosta tai oikeasta sepelvaltimosta peräisin oleva Cx kuin erillisten ostioiden esiintyminen vasemmassa sepelvaltimon sivuontelossa.55
2. ”Aortan juuren” merkki. Ventrikulografiassa oikeanpuoleisessa anteriorisessa viistoprojektiossa nähdään anomaalisen Cx:n ääriviivat ja seurataan sen kulkua, kun se kulkee oikean sepelvaltimon sinuksen takaa (kuva 10).
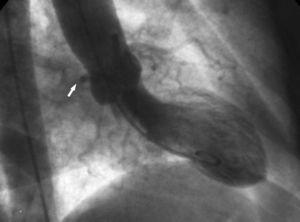
Kuva 10. Anomaalinen Cx. Ventrikulografia oikeassa anteriorisessa viistoprojektiossa, jossa näkyy oikean sepelvaltimon sivuontelon takana kulkevan anomaalisen circumflex-valtimon (nuoli) ääriviivat; tämä tunnetaan aortan juuren merkkinä tai Pagen merkkinä.
Vuonna 1985 Ishikawa ym.56 ja sen jälkeen Serota ym. vuonna 199057 ehdottivat sarjan sepelvaltimoiden arteriografisia kriteerejä, joiden tarkoituksena oli määritellä anomaalisen verisuonitiehyiden ja aortan ja keuhkovaltimon välinen suhde alkuperäistä kulkureittiä pitkin (kuva 11). Nämä kirjoittajat pyrkivät tunnistamaan erilaiset reitit poikkeavan sepelvaltimon ja muun sepelvaltimopuun muodostaman ”silmukan” suuntautumisen perusteella56 tai soveltamalla ”pisteen” käsitettä (CAA:n kontrastipylvään visualisointi, joka tekee käännöksensä vuoksi pisteen morfologian57).
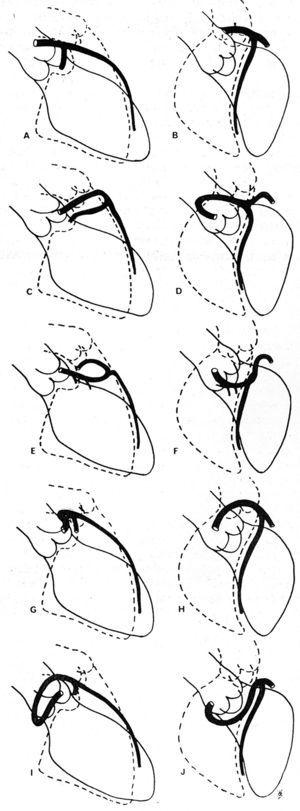
Kuva 11. Kuvitukset vasemman etummaisen laskevan ja proksimaalisen sepelvaltimon proksimaalisen circumflexin sepelvaltimoiden sepelvaltimoiden sepelvaltimoiden angiografiakuvista oikeassa anteriorisessa viistoprojektiossa (A, C, E, G, I) ja vasemmassa anteriorisessa viistoprojektiossa (B, D, F, H, J), joista näkyvät oikeasta Valsalvan sivuontelosta lähtevän vasemmanpuoleisen sepelvaltimon erilaiset mahdolliset alkukierrot. A ja B kuvaavat normaalia sepelvaltimoa; C ja D kuvaavat anterokraniaalista ”silmukkaa”, kuvattu anteriorinen kulku; E ja F: anterokaudaalinen ”silmukka”, septaalinen kulku; G ja H: posterokraniaalinen ”silmukka”, interarteriaalinen kulku; I ja J: posterokaudaalinen ”silmukka”, retroaortan kulku. Otettu lähteestä Ishikawa et al.56
Monissa tapauksissa CAA:n alkuperäisen kulun tunnistaminen sepelvaltimoiden varjoainekuvauksen avulla on vaikeaa, koska tämä tekniikka antaa kaksiulotteisen kuvan sepelvaltimopuusta, joka on monimutkainen kolmiulotteinen rakenne. Toimenpidekardiologi, jolla on kokemusta CAA:n diagnosoinnista, voi sepelvaltimoiden varjoainekuvaus riittää kurssin oikeaan tunnistamiseen. Ottaen huomioon niiden vähäisen esiintyvyyden useimmilla toimenpidekardiologeilla on kuitenkin vain vähän kokemusta CAA:n tutkimisesta. Näin ollen suurimmassa osassa tapauksista niitä ei ole kuvattu asianmukaisesti. Tuoreessa rekisterissä, johon osallistui 13 espanjalaista sairaalaa, ilmoitetun CAA:n alkuperäistä kulkua ei tunnistettu suurimmassa osassa tapauksista.16
Siten monissa tapauksissa väärään sivuonteloon syntyneen CAA:n alkuperäisen kulun tunnistaminen edellyttää ylimääräistä kuvantamistekniikkaa. Kuten edellä mainitsimme, sekä TTE:tä että TEE:tä voidaan käyttää tähän tarkoitukseen, mutta koska sairaaloissamme on yhä enemmän saatavilla ei-invasiivisia tekniikoita, joiden avulla sepelvaltimoiden anatomia ja sen suhde viereisiin rakenteisiin voidaan määritellä oikeammin ja tarkemmin potilailla, jotka voivat olla ehdokkaita leikkaukseen, valitsemme CMRI:n tai monidetektorisen CT:n.35,37,47,49
MIKÄ ON PARAS HOITOTAPA?
Tämä on yksi tämän tilan kiistanalaisimmista näkökohdista, koska asiasta ei ole laadittu mitään virallisia ohjeita.
Kun CAA on diagnosoitu ja luonnehdittu, näyttäisi loogiselta pyrkiä määrittämään, aiheuttaako se sydänlihasiskemiaa vai ei. Jos potilaalla on ollut sydäninfarkti (jolla ei ole osoitettavissa olevaa yhteyttä ateroskleroosiin) tai hänet on elvytetty anomaliasta johtuvan äkkikuoleman vuoksi ja hän on alle 35-vuotias, useimmat kirjoittajat suosittelevat revaskularisaatiota24,26,35.
Talliumstressitesti tai kaikukardiografia lääkkeellisessä tai rasitusperäisessä rasituksessa, jossa osoitetaan reversiibeli iskemia anomalian alueella, auttaa päätöksenteossa.36
Mitä pitäisi tehdä nuorille, oireettomille henkilöille, joilla CAA löydetään satunnaisesti, jos riskikriteerit täyttyvät, mutta rasituskokeet eivät tuota näyttöä iskemiasta? Ensinnäkin potilaan olisi omaksuttava istuva elämäntapa.26,35
Corrado ym. vertasivat nuorten urheilijoiden ja ei-urheilijoiden äkkikuolemia, ja vain ne äkkikuolemat, jotka johtuivat CAA:sta tai rytmihäiriöitä aiheuttavasta oikean kammion dysplasiasta, liittyivät rasitukseen.58 Hoidon osalta revaskularisaatio on kiistanalainen, mutta on kirjoittajia, jotka ovat valinneet tämän lähestymistavan, koska äkkikuolema on näillä potilailla arvaamaton ja voi olla ensimmäinen merkki CAA:sta.24,26,34,35 Jotkut kirjoittajat kannattavat näissä tapauksissa vuosittaisia seurantakäyntejä, joissa tehdään kaikukardiografia tai talliumstressitutkimus, ja perustavat päätöksensä tuloksiin.7,36 Kirurgisen hoidon jälkeen potilaat nauttivat normaalista elämäntyylistä, mukaan lukien osallistuminen urheiluun.25,34,49
Potilaiden, jotka ovat yli 35-vuotiaita, päätökset on tehtävä yksilöllisin perustein. Äkkikuoleman riski on pienempi, mutta koska CAA voi aiheuttaa oireisen sydänlihasiskemian, joissakin tapauksissa tehdään revaskularisaatio (kuva 12).24,26
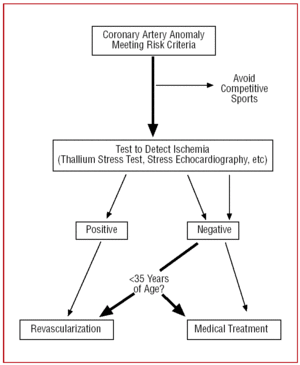
Kuva 12. Verisuonitulehdus. Hoitoprotokolla, jota ehdotetaan sepelvaltimoiden anomalioille, joiden alkuperä on kontralateraalisessa Valsalvan sinuksessa riskitekijöiden esiintyessä.
Jotkut ryhmät tutkivat tiettyjen diagnostisten protokollien hyödyntämistä (intrakoronaarinen kaikukardiografia anomaalisen sepelvaltimotiehyen arvioimiseksi levossa ja dobutamiini-infuusion tai nesteen ylikuormituksen jälkeen)59 tai koronaarisisäisten paineluotsalankojen hyödyntämistä iskemian havaitsemisessa.60
Kuten voidaan havaita, siihen asti, kunnes asiasta laaditaan viralliset ohjeet, järkevin lähestymistapa näyttäisi olevan ensinnäkin vahvistaa, liittyykö potilaan ikä ja CAA:n anatomia riskiin, ja toiseksi varmistaa, että sepelvaltimoiden iskemia (potilaan esittämä tai osoittama) johtuu selvästi poikkeavuudesta.
MITEN UUDELLEENKULJETUS ON TEHTÄVÄ?
Logisesti on tarpeen käsitellä jokaista tapausta yksilöllisesti sepelvaltimoiden anatomian mukaan; näin ollen revaskularisaatio voi olla joko kirurginen tai perkutaaninen.
Kirurginen revaskularisaatio käsittää aortokoronaarisen ohitusleikkauksen, ostiaalisen reimplantaation tai unroofing-tekniikan, jossa CAA:n intramuraalinen segmentti vapautetaan CAA:n ja aortan yhteiseen seinämään tehdyllä viillolla, jolloin luodaan uusi, suurempi aukko sopivaan sinukseen.61,62 Kirurgisesta revaskularisaatiosta näillä potilailla, erityisesti nuorilla, on paljon kiistaa. Aortokoronaarista ohitusleikkausta on kritisoitu voimakkaasti7,63 sen ”rajoitetun” läpäisevyyden ja väistämättömän kilpailevan virtauksen vuoksi ohituksen ja CAA:n välillä. Niinpä yhä useammin otetaan käyttöön katteenpoistotekniikka, joka näyttäisi olevan fysiologisempi62.
Perkutaaninen interventio, jossa istutetaan stenttejä suurten verisuonten välisen puristuksen alueelle ja anomaaliseen ostiumiin, on tehty useissa tapauksissa aikuisille lyhytaikaisella menestyksellä64. Tähän mennessä kirurgista revaskularisaatiota suositaan nuorilla potilailla ja perkutaanista toimenpidettä tehdään vain aikuisille.26,62-64 Ilmeisesti molemmissa tapauksissa tarvitaan pitkäaikaista seurantaa.
OnKO LÄÄKKEELLINEN HOITO Vaihtoehto?
Sarjojen ja kontrolloitujen tutkimusten puuttuessa tähän kysymykseen on vaikea vastata. On olemassa raportteja, jotka koskevat 2 ja 5 vuoden seurantaa potilailla, jotka tai potilaat kieltäytyivät leikkauksesta, joissa lähestymistapana oli joko odottava hoito tai hoito beetasalpaajilla, ja joiden joukossa ei ollut yhtään äkkikuolematapausta.65-68 Jotkin kirjoittajat kuitenkin vastustavat päätöstä aloittaa ”elinikäinen” hoito lapsilla ja nuorilla.7
KESKEISET RATKAISEMATTOMAT ONGELMAT
Kuhunkin poikkeavaan anomaliaan liittyvää todellista äkkikuoleman riskiä ei tunneta.5 Tämä johtuu siitä, että riski lasketaan ruumiinavaustutkimusten perusteella, jotka eivät kerro todellista riskiä siitä, että henkilö kuolee äkkikuoleman seurauksena, vaan viittaavat siihen, että äkkikuoleman kokeneella henkilöllä on äkkikuolema.7 Lisäksi lasketut riskit saattavat olla yliarvioituja väestöön nähden, koska ne on saatu kilpaurheilijoiden sarjoista, joilla, kuten on raportoitu, on kaksi kertaa suurempi äkkikuoleman riski kuin istumatyötä tekevillä henkilöillä.69 Tiedämme, että aivoverenkiertohäiriön aiheuttaman äkkikuoleman riski on suurempi nuorilla ihmisillä; itse asiassa suositellaan yhtä tai toista hoitomenetelmää sen mukaan, onko potilas alle 30- vai 35-vuotias. Nämä raja-arvot perustuvat harvoihin asiaa käsitelleisiin tutkimuksiin23,25 , joten niitä olisi pidettävä vain suuntaa-antavina. Tästä syystä terapeuttisesta lähestymistavasta olisi aina päätettävä yksilöllisesti.
Jos päädytään edellä kuvattuun kirurgiseen ratkaisuun, on otettava huomioon, että ei ole olemassa sarjoja, joissa potilaiden kulkua olisi tutkittu yli kahden vuoden ajan. Ohitusleikkauksen läpäisevyyteen liittyvään epävarmuuteen lisätään aorttaläpän mahdollinen vaurioituminen, jonka kattoläpän avaaminen voi aiheuttaa. Tältä osin on raportoitu aortan vajaatoiminnasta tai jopa läpän vaihdosta tämän toimenpiteen jälkeen.7,70 On muistettava, että sydänkirurgiaan liittyy aina neurologisten komplikaatioiden riski, jonka esiintyvyydeksi nuorilla on arvioitu noin 2,3 prosenttia.71
Loppujen lopuksi kardiovaskulaarisia poikkeavuuksia sairastavien kilpaurheilijoiden valintaa koskevissa ohjeissa suositellaan, että potilaat, joilla on CAA, suljetaan pois kaikenlaisesta kilpaurheilun harrastamisesta.51 Jälleen kerran urheilijapopulaatiosta saadut tiedot on ekstrapoloitu yleisväestön tietoihin. Murrosikäisen kohdalla termiä ”kilpaurheilu” voi olla vaikea määritellä. Lisäksi murrosikäisen tai nuoren aikuisen kieltäminen osallistumasta liikuntatunneille tai urheiluun, josta hän saattaa nauttia, voi aiheuttaa enemmän vahinkoa kuin hyötyä. Ehkä rasittavaa urheilua tulisi välttää, mutta ei vähemmän vaativaa urheilua.7
YHTEENVETO
Väärästä Valsalvan sinuksesta lähtevät sepelvaltimot muodostavat CAA:n ryhmän, joka liittyy yleisimmin sydänlihasiskemiaan ja erityisesti äkkikuolemaan.
Tämän poikkeavuuden epäilyindeksin tulisi olla korkea nuorilla potilailla, joilla on kliinisiä merkkejä angina pectoriksen oireista, hengenahdistuksesta tai rasitussynkopeesta. Näissä tapauksissa olisi tehtävä TTE, jolla pyritään tunnistamaan ostia ja molempien sepelvaltimoiden alkukulku.
Meidän olisi määriteltävä selkeästi jokaisen poikkeavan sepelvaltimon alkukulku käyttäen kuvantamistekniikoita, kuten TTE:tä, TEE:tä tai mieluiten monidetektori-CT:tä tai CMRI:tä, sairaalamme erityispiirteiden mukaisesti.
Meidän on asetettava etusijalle sellaisten kansallisten ja kansainvälisten rekistereiden perustaminen, joiden avulla voimme määrittää näiden anomalioiden esiintyvyyden sekä niihin liittyvän sairastuvuuden ja kuolleisuuden, ennusteen, hoidon, mahdolliset geneettiset tai ympäristöön liittyvät vaikutukset, lyhyesti sanottuna oppia asiasta niin paljon kuin mahdollista.
On välttämätöntä seurata pitkäaikaisesti potilaita, joille on tehty leikkaus koronaarisen pallolaajentuman poiston vuoksi, erityisesti nuoria. Joka tapauksessa revaskularisaatio (kirurginen tai perkutaaninen) voi olla pätevä potilaille, joilla on tämäntyyppinen sairaus.
KIITOKSET
Kiitämme tohtori Joaquín Alonsoa ja tohtori Gabriel C. Fernándezia heidän avustaan monitietokonetietokonetomografiakuvien hankinnassa.