Solunsisäiset vihjeet, kuten solun DNA:n vaurioituminen, ohjaavat apoptoosia ensisijaisesti solunsisäisen reitin kautta. Intrinsic-apoptoosireitti, johon osallistuvat konservoituneet signaaliproteiinit, liittyy fyysisesti mitokondrioihin, ja selkärankaisilla se on herkkä mitokondrioiden hapetusstressille. Reittiin vaikuttavat mitokondrioiden kalvoon sitoutuneet Bcl-perheen jäsenet, mukaan lukien Bax- ja Bcl-2 -geenit, jotka toimivat pro- tai anti-apoptoottisina säätelijäproteiineina.
Yleiskatsaus intrinsiseen apoptoosireittiin
Sisäinen apoptoosireitti käynnistyy esimerkiksi solunsalpaajahoidolla ja/tai sädehoidolla. Se aktivoituu useista eksogeenisistä ja endogeenisistä ärsykkeistä, kuten DNA-vauriosta, iskemiasta ja oksidatiivisesta stressistä. Lisäksi sillä on tärkeä tehtävä kehityksessä ja vaurioituneiden solujen eliminoinnissa.
Sisäisessä polussa pro-apoptoottisen signaloinnin toiminnallinen seuraus on mitokondriokalvon häiriintyminen ja sytokromi c:n vapautuminen sytoplasmaan, jossa se muodostaa kompleksin eli apoptosomin apoptoottisen proteaasin aktivoivan faktorin 1:n (APAF1) ja kaspaasi-9:n inaktiivisen muodon kanssa. Tämä kompleksi hydrolysoi adenosiinitrifosfaattia pilkkoaakseen ja aktivoidakseen kaspaasi-9:n. Aloittava kaspaasi-9 pilkkoo ja aktivoi sitten toimeenpanevat kaspaasit-3/6/7, mikä johtaa solun apoptoosiin. Se eroaa täysin solunulkoisista signaaleista, joita yleensä synnyttävät immuunijärjestelmän sytotoksiset solut ja jotka laukaisevat apoptoosin pääasiassa ekstrinsisen reitin kautta.
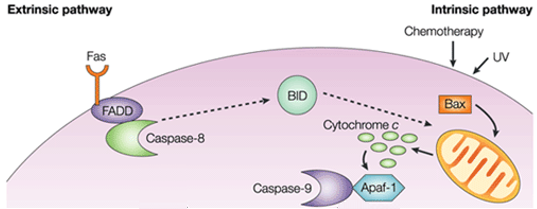
Kuvio 1. Solunulkoiset signaalit. Ekstrinsisen reitin ja intrinsisen reitin välinen ero.
Intrinsisen apoptoosireitin prosessi ja säätely
Intrinsinen apoptoosireitti indusoi apoptoosin aktivoimalla suoraan kaspaasi-3:n tai pilkkomalla bidin (BH3-interaktiivinen domeenin kuolema-agonisti), mikä johtaa mitokondrioiden toimintahäiriöön ja sitä seuraavaan sytokromi-c:n vapautumiseen ja kaspaasi-9:n ja kaspaasi-3:n aktivoitumiseen. Kaspaasi-3 edistää tyypillisiä apoptoosin piirteitä, kuten DNA:n pirstoutumista ja solukuolemaa useissa kudoksissa.
B-solulymfooma 2 (Bcl-2) -proteiiniperhe kontrolloi tiukasti intrinsic-reitin aktivoitumista. Sitä esiintyy follikulaarisessa lymfoomassa, ja se tunnistettiin ensimmäisen kerran yhdeksi solukuolemaan osallistuvista geeneistä joko aktivoimalla pro-apoptoottista tai estämällä anti-apoptoottista apoptoosia. Yhden alaryhmän proteiinit, mukaan lukien Bid, Bad, Bim, Bmf, Puma ja Noxa, sisältävät yhden Bcl-2-homologian 3-domeenin (vain BH3-proteiinit) ja niillä on pro-apoptoottista aktiivisuutta. Kahdella muulla proteiinialaryhmällä on useita BH-domeeneja. Ensimmäinen alaryhmä, johon kuuluvat Bcl-2:een liittyvä X-proteiini (Bax), Bcl-2:n homologinen antagonisti/tappaja (Bak) ja Bcl-2-perheen apoptoosin säätelijä (Bok), on pro-apoptoottinen; toinen alaryhmä, johon kuuluvat Bcl-2, Bcl-XL ja Mcl-1, on anti-apoptoottinen. Mitokondriaaliseen reittiin vaikuttavat osittain mitokondriokalvoon sitoutuneet Bcl-perheen jäsenet, mukaan lukien sekä pro-apoptoottiset säätelijäproteiinit Bax että anti-apoptoottiset säätelijäproteiinit Bcl-2.
Pro-apoptoottiset molekyylit aiheuttavat mitokondrioiden ulomman kalvon permeabiloitumisen, mikä johtaa sytokromi c:n effluxiin, joka sitoo adaptori Apaf-1:n ja initiaattorina toimivan kaspaasi-9:n sytosolissa muodostaen apoptosomikompleksin. Tämä stimuloi kaspaasi-9:ää, joka puolestaan aktivoi efektorikaspaaseja. Mitokondriosta vapautuu myös Smac/DIABLO-niminen proteiini sytosoliin. Smac/DIABLO edistää epäsuorasti apoptoosia estämällä apoptoosin estäjäproteiineiksi (inhibitor of apoptosis proteins, IAPs) kutsuttujen anti-apoptoottisten proteiinien ryhmän vaikutuksia.
Apoptoosin estäjät Bcl-2 ja Bcl-XL estävät sytokromi c:n vapautumista, kun taas Bax, Bak ja Bid, kaikki pro-apoptoottisia proteiineja, edesauttavat sytokromi c:n vapautumista mitokondrioista. Sytokromi c ja deoksiadenosiinitrifosfaatti (dATP) sitoutuvat APAF-1:een muodostaen multimeerisen kompleksin, joka rekrytoi ja aktivoi pro-kaspaasi-9:n, apoptoosia välittävän eksekutiiviproteaasin, joka vuorostaan aktivoi kaspaasikaskadin, mikä johtaa solun apoptoosiin. Tämän prosessin aikana kaspaasi-2, kaspaasi-8, kaspaasi-9 ja kaspaasi-10 osallistuvat apoptoosin käynnistämiseen. Kaspaasi-3, kaspaasi-6 ja kaspaasi-7 osallistuvat apoptoosiin. Kaspaasi-3 ja kaspaasi-7 säätelevät DNA:n korjauksen estämistä ja käynnistävät DNA:n hajoamisen. Lisäksi kaspaasi-6 säätelee laminaatin ja sytoskeletin hajoamista.
Intrinsic Apoptosis Pathway in Pathophysiology
Useimmat kemoterapeuttiset ja kohdennetut syöpähoidot tappavat kasvainsoluja synnyttämällä pro-kuolemaa aiheuttavaa signaalinvälitystä, joka käynnistää ohjelmoidun solukuoleman intrinsic apoptotic pathwayn. Apoptoottisen kaskadin piste, josta ei ole paluuta, on mitokondrioiden ulkokalvon permeabilisaatio (MOMP); kun se on tapahtunut, mitokondrioiden permeabilisaatio johtaa apoptosomin muodostumiseen, mikä helpottaa kaspaasiaktivaatiota ja käynnistää sen jälkeen muut apoptoottisen solukuoleman tunnusmerkit. Solun päätöstä MOMP:n käynnistämisestä ohjaa herkkä tasapaino BCL-2-tuoteperheen pro- ja anti-apoptoottisten molekyylien välillä.
Yksi kemoterapiaresistenssin syistä on se, että kasvainsolut eivät kykene siirtymään apoptoosiin intrinsisen apoptoosireitin vikojen vuoksi (esim. p53:n muutokset). Huolimatta merkittävistä parannuksista hoidossa monien syöpien parantumisprosentti on edelleen alle optimaalisen. Sytotoksisen solunsalpaajahoidon yleistyminen on johtanut siihen, että osa syövistä voidaan hoitaa parantavasti, mutta yksittäisten potilaiden sisäistä hoitoresistenssiä on vaikea ennustaa. Molekyylisesti kohdennettujen hoitojen aalto on keskittynyt lääkkeitä aktivoiviin mutaatioihin ja rajoittuu siten tiettyihin potilasryhmiin. Apoptoosin sisäinen mitokondriaalinen reitti on yksi lupaava kohde uusille hoitomuodoille, ja onnistunut kohdentaminen tähän reittiin voi muuttaa useiden syöpien hoidon terapeuttista maisemaa.