Käsikirjoitus hyväksytty :29 Aug 19
Published online on: 18-09-2019 Plagiointitarkastus: Kyllä
Reviewed by: Farooq Sher
Second Review by: Grigorios Kyriakopoulos
Loppuhyväksynnän on suorittanut: Ayush Dogra
How to Citeclose | Publication Historyclose
Vijitra Luang-In1* , Manatchanok Yotchaisarn1, Worachot Saengha1, Piyachat Udomwong2, Sirirat Deeseenthum1 ja Kedsukon Maneewan1
, Manatchanok Yotchaisarn1, Worachot Saengha1, Piyachat Udomwong2, Sirirat Deeseenthum1 ja Kedsukon Maneewan1
1Luonnollisten antioksidanttien innovaatioiden tutkimusyksikkö, Biotekniikan laitos, teknillinen tiedekunta, Mahasarakham University, Khamriang, Kantarawichai, Maha Sarakham, 44150, Thaimaa.
2International College of Digital Innovation, Chiang Mai University, Chiang Mai 50200, Thaimaa.
Corresponding Author E-mail: [email protected]
DOI : https://dx.doi.org/10.13005/bpj/1735
Abstract
Tässä tutkimuksessa pyrittiin eristämään ja tunnistamaan bakteereja, jotka pystyvät tuottamaan amylaasi-entsyymiä tutkimattomasta Nasinuanin metsästä, Kantarawichain piiristä Maahasarakhamin maakunnasta Thaimaasta. Kolmetoista bakteeri-isolaattia, joilla oli amylaasia tuottava kyky 1-prosenttisella tärkkelysagarilla, tunnistettiin 16S rRNA-sekvensoinnin avulla. Kaksitoista bakteeria oli grampositiivisia, sauvamaisia ja tunnistettiin Bacillus spp:ksi, ja yksi gramnegatiivinen ja sauvamainen bakteeri oli Enterobacter cloacae. Niiden lähimmät sukulaiset löytyivät Intiasta, Kiinasta, Koreasta, Indonesiasta, Argentiinasta, Italiasta, Israelista, Yhdysvalloista, Argentiinasta ja Etelä-Afrikasta. Näiden bakteerien spesifinen amylaasiaktiivisuus testattiin 1-3 päivän entsyymi-induktion jälkeen 1 prosentin tärkkelyksellä 37 °C:ssa. Tulokset osoittivat suurinta spesifistä aktiivisuutta inkubointipäivänä 2 järjestyksessä: Bacillus cereus 3.5AL2 > 3.4AL1 > 1.4AL3, joten jatkotutkimuksiin valittiin 2-päiväinen entsyymi-induktio. Bacillus sp. 3.5AL2:lla todettiin olevan korkein spesifinen amylaasientsyymiaktiivisuus 1,97 ± 0,41 U/mg proteiinia optimaalisissa olosuhteissa 60 °C:n lämpötilassa ja pH:ssa 7,0 sen jälkeen, kun sitä oli inkuboitu 30 minuutin ajan 1 %:n tärkkelyksen kanssa 0,05 M:n PBS-puskurissa. Tämä amylaasia tuottava bakteerikanta tarjoaa suuren potentiaalin sovelluksille elintarvike- ja maatalousteollisuudessa Thaimaassa.
Avainsanat
Amylaasi; bakteerit; Nasinuan metsä; maaperä
Download this article as:![]()
Copy the following to cite this article:
Luang-In V, Yotchaisarn M, Saengha W, Udomwong P, Deeseenthum S, Maneewan K. Isolation and Identification of Amylase-producing Bacteria from Soil in Nasinuan Community Forest, Maha Sarakham, Thailand. Biomed Pharmacol J 2019;12(3).
Copy the following to cite this URL:
Luang-In V, Yotchaisarn M, Saengha W, Udomwong P, Deeseenthum S, Maneewan K. Isolation and Identification of Amylase-producing Bacteria from Soil in Nasinuan Community Forest, Maha Sarakham, Thailand. Biomed Pharmacol J 2019;12(3). Saatavana osoitteesta: http://biomedpharmajournal.org/?p=28497
Esittely
Tärkkelyshydrolyyttiset amylaasit (α-amylaasi, β-amylaasi ja glukoamylaasi) ovat yksi yleisimmin käytetyistä entsyymeistä nykypäivän biotekniikassa. Glukoamylaasit (1,4-α-D-glukaaniglukanohydrolaasi; EC 3.2.1.3) tai amyloglukosidaasit ovat ekso-aktiivisia amylaaseja, jotka tuottavat glukoosia tärkkelyksen ja vastaavien oligosakkaridien pelkistämättömästä päästä. Glukoamylaaseja käytetään kaupallisesti malto-oligosakkaridien muuttamiseksi glukoosiksi1. Vaikka amylaaseja tuotetaan eri lähteistä (mikro-organismeista, kasveista ja eläimistä), mikrobeista peräisin olevat amylaasit soveltuvat parhaiten teolliseen tuotantoon mikrobien lyhyen kasvujakson, alhaisen kustannustehokkuuden, ympäristöystävällisyyden, työntekijöiden kannalta vähäisempien käsittelyongelmien, tuottavuuden2 ja bakteerigeenien helpon manipuloinnin vuoksi3. Bakteereilla ja sienillä on taipumus erittää amylaaseja solujen ulkopuolelle tärkkelyksen hajottamiseksi sokereiksi solun ulkopuolella. Mikrobiperäisten amylaasien teollisen kysynnän on havaittu kasvavan, koska ne reagoivat spesifisesti, reaktio edellyttää lieviä olosuhteita ja niiden energiankulutus on vähäisempää kuin perinteisten ei-entsymaattisten kemiallisten menetelmien.
Amylaasien laajamittainen käyttö elintarvike-, tärkkelyksen nesteytys-, sokerointi-, panimo-, pesuaine-, paperi-, tekstiili- ja tislattavaksi tarkoitettujen aineiden valmistuksessa on lisännyt huomionta yhä voimakkaammin α-amylaasien kotoperäisen tuotannon kasvattamiseen4. Bacillus on yleinen bakteerilähde teollisessa amylaasituotannossa. Eri kannoilla on kuitenkin erilaiset optimaaliset kasvuolosuhteet ja entsyymituotantoprofiili. Bacillus-kantoja, kuten B. amyloliquefaciens, B. subtilis5, B. licheniformis6, B. stearothermophilus7, B. megaterium8 ja B. circulans9 , on käytetty laajasti teollisesti α-amylaasin tuottamiseen.
Tähän mennessä on dokumentoitu useita amylaasia tuottavia bakteereja, mutta yhtään tutkimusta amylaasia tuottavista bakteereista maaperästä Nasinuanin yhteisömetsästä, Kantharawichain piirikunnasta, Mahasarakhamin maakunnasta, Thaimaasta, ei ole raportoitu. Tässä metsässä näyttää olevan runsaasti mikrobien biologista monimuotoisuutta, josta voi olla hyötyä teollisten entsyymien, kuten amylaasin, tuotannossa. Tämä on ensimmäinen raportti Nasinuanin metsästä eristettyjen amylaasia tuottavien bakteerien tunnistamisesta. Näitä bakteeriamylaaseja voidaan tulevaisuudessa soveltaa paikallisesti eri teollisuudenaloilla, kuten massa- ja paperiteollisuudessa, tekstiiliteollisuudessa, bioetanolissa, panimoissa, elintarvikkeiden jalostuksessa, eläinten rehuissa ja maataloudessa Thaimaassa.
Materiaalit ja menetelmät
Maaperänäytteet
Maaperänäytteet kerättiin satunnaisesti 15 cm:n syvyydeltä maaperän pinnan alapuolelta ja säilytettiin polystyreenipusseissa Nasinuanin yhteisömetsästä, Kantarawichain piirikunnasta, Mahasarakhamin maakunnasta, Thaimaasta (pinta-ala 9.6 hehtaaria; koordinaatti 16.340941, 103.210799).
Amylaasia tuottavien bakteerien eristäminen
Maaperänäyte (10 g) suspendoitiin 90 ml:aan steriiliä 0,85 % NaCl-liuosta. Sarjalaimennosten suspensiot (100 µl) levitettiin tärkkelysagarille (g/l); 3,0 naudanlihauute, 10,0 liukoinen tärkkelys, 15,0 agar pH 7,0 ja inkuboitiin 37 ºC:ssa 7 päivän ajan. Seuraavaksi levyt täytettiin Gramin jodilla. Kaikki pesäkkeet, joiden ympärille muodostui kirkas vyöhyke, subkulturoitiin nestemäisessä liemessä ja raidoitettiin vähintään viisi kertaa puhtaiden isolaattien saamiseksi, mikä vahvistettiin Gram-värjäyksellä ja 1000X-valomikroskooppisella tarkastelulla. Puhtaat isolaatit inokuloitiin tärkkelysagariin ja inkuboitiin 37 °C:ssa 7 päivän ajan. Kirkkaiden vyöhykkeiden halkaisijat mitattiin viivottimella pesäkkeiden halkaisijoihin nähden halo : pesäkkeen suhteena.
16S rRNA -geenin sekvensointi ja fylogeneettinen analyysi
Puhtaat bakteeri-isolaatit tunnistettiin käyttämällä edellä mainitulla menetelmällä saatuja genomisia DNA:ita ja universaaleja alukkeita: eteenpäin suuntautuva aluke 27F 5′-GAGAGAGTTTTGATYCTGGCTCAG-3′ ja käänteinen aluke 1492R 5’AAGGAGGTGATCCARCCCCGCA -3′. 25 µl:n PCR-seoksessa oli genomista DNA:ta 0,5 ng, 2X Master Mix (One PCR), joka sisälsi 100 mM Tris-HCl (pH 9,1), 0,1 % TritonTMX-100, 200 mM dNTP:tä, 1,5 mM MgCl2:ta, 0,005 U Taq-DNA-polymeraasia ja 0,2 µM eteen- ja taaksepäin suuntautuvaa aluketta. PCR-termokykleri (Thermo Scientific Hybaid Px2) ohjelmoitiin seuraavasti: (1) alku denaturointi 2 minuutin ajan 94 ºC:ssa yhden syklin ajan; (2) denaturointi 94 ºC:ssa 45 sekuntia; hehkutus 54 ºC:ssa 45 sekuntia ja pidennys 72 ºC:ssa 1 minuutti 32 syklin ajan; (3) lopullinen pidennys 72 ºC:ssa 7 minuuttia. Näytteitä säilytettiin 4 ºC:ssa jatkoanalyysiin asti. 16S rRNA:n PCR-tuotteet (~ 1 500 bp) havaittiin 0,8-prosenttisella agaroosigeelillä, puhdistettiin PCR-tuotteiden puhdistussarjalla (Vivantis, Malesia), lähetettiin First Base Co. Ltd. (Malesia) DNA-sekvensointia varten. Tämän jälkeen 16S rRNA -geenin sekvenssejä verrattiin muihin GenBankissa saatavilla oleviin sekvensseihin BLASTN-ohjelman (Basic Local Alignment Search Tools)10 avulla. Fylogeneettinen puu rakennettiin käyttäen Muscle-menetelmää sekvenssien kohdistamiseen ja maksimiluotettavuusmenetelmää käyttäen MEGA X -ohjelmaa, jossa bootstrap-arvot ovat 1 000 toistoa11. Kaikki amylaasia tuottavien isolaattiemme 16S rRNA:n osasekvenssit talletettiin NCBI:n tietokantaan.
Amylaasientsyymiaktiivisuuden määrittäminen
Menetelmässä noudatettiin Bhaskara et al. (2011)12. Amylaasientsyymiaktiivisuuden määrittämiseen valittiin kolme bakteeria, joilla oli korkein Halo:Colony-suhde. Kukin isolaatti subkulturoitiin tärkkelysliemessä (g/l): 10,0 liukoista tärkkelystä, 10,0 peptonia, 20,0 hiivauutetta, 0,05 KH2PO4, 0,015 MnCl2.4H2O, 0,25 MgSO4.7H2O, 0,05 CaCl2.2H2O, 0,01 FeSO4.7H2O, ja sitä inkuboitiin 37 ºC:n lämpötilassa 150 rpm:n kierrosluvun ollessa 1, 2 ja 3 päivää. Kirkas supernatantti (raaka solunulkoinen amylaasientsyymi) saatiin, kun sitä oli sentrifugoitu 10 000 g:llä 15 minuutin ajan 4 ºC:ssa. Raakauute konsentroitiin käyttäen MWCO 10 kDa:n ultracentrifugiproteiinikonsentraattoria (Vivaspin, Sartorius, UK).
Kunkin bakteeri-isolaatin amylaasiaktiivisuuden määrittämiseen kullakin entsyymi-induktiopäivällä käytettiin DNS-menetelmää13 . Yksi ml raakaa entsyymiä sekoitettiin 1 ml:aan 1 %:n tärkkelysliuosta 1 ml:ssa 0,05 M natriumfosfaattipuskuria pH 7,0. Näytteitä inkuboitiin 37 °C:ssa 30 minuutin ajan. Inkuboinnin jälkeen kuhunkin näytteeseen lisättiin 0,5 ml DNS-liuosta reaktion pysäyttämiseksi, minkä jälkeen näytettä keitettiin 100 °C:ssa 5 minuutin ajan vesihauteessa. Liuoksen värin voimakkuutta tarkkailtiin mittaamalla optinen tiheys (OD) spektrofotometrillä 575 nm:ssä. Lukemaa verrattiin valmistettuun nollaliuokseen (ilman raakaentsyymiä). T30min näytteiden OD-arvot vähennettiin T0min näytteiden OD-arvoista, koska glukoosia oli vielä jäljellä T0min näytteissä entsyymi-induktioprosessin jälkeen 1, 2 ja 3 päivän ajan. Prosessi suoritettiin kolmena kappaleena. Kunkin liuoksen tuottama glukoosipitoisuus saatiin glukoosistandardikäyrästä. Amylaasiaktiivisuus laskettiin. Yksi yksikkö amylaasiaktiivisuutta määritellään amylaasin määräksi, joka tarvitaan katalysoimaan pelkistävän sokerin muodostumista, joka vastaa 1 µmol glukoosia minuutissa määritysolosuhteissa14.
Jatkotyöhön valittiin sen bakteeri-isolaatin raakaentsyymi, jolla oli korkein aktiivisuus.
Valittujen isolaattien spesifisen entsyymiaktiivisuuden määrittämiseksi käytettiin kokonaisproteiinien arvioinnissa käytettävää Folin-Lowry-menetelmää15. Spesifinen entsyymiaktiivisuus mitattiin seuraavan kaavan avulla.
Spesifinen aktiivisuus (U/mg) = Entsyymiaktiivisuus (U/ml)/Eksstrasellulaarisen proteiinin konsentraatio (mg/ml)
Amylaasientsyymiaktiivisuuden optimaalinen pH ja lämpötila
Testattiin liukenevia tärkkelysliuoksia (1-prosenttisia) eri pH:ssa välillä 3-10. Yksi ml erilaista 1-prosenttista substraattiliuosta lisättiin yhdessä 1 ml:n kanssa vastaavista puskureista; 0,05 M sitraattipuskuri (pH 3-5), 0,05 M natriumfosfaattipuskuri (pH 6 ja 7), 0,05 M Tris-HCl (pH 8 ja 9) ja 0,05 M glysiini NaOH (pH 10). Näihin puskureihin lisättiin myös yksi ml raakaa entsyymiä. Näytteitä inkuboitiin 37 °C:ssa 30 minuutin ajan. Spesifinen amylaasiaktiivisuus laskettiin. Merkittiin pH, jossa havaittiin suurin aktiivisuus. Samoin valmistettiin erilaisia substraattiliuoksia liuottamalla 1 % liukoista tärkkelystä pH 7,0 -liuoksiin Yksi ml 1 % liukoista tärkkelystä lisättiin yhdessä 1 ml:n 0,05 M natriumfosfaattipuskurin (pH 7) kanssa. Puskureihin lisättiin myös yksi ml raakaa entsyymiä. Näytteitä inkuboitiin 20, 30, 40, 50, 60, 70 ja 80 °C:ssa 30 minuutin ajan. Spesifinen amylaasiaktiivisuus laskettiin. Lämpötila, jossa havaittiin suurin aktiivisuus, merkittiin muistiin. Sekä optimaalista pH:ta että lämpötilaa käytettiin lopullisen spesifisen amylaasientsyymiaktiivisuuden määrittämiseen.
Statistinen analyysi
Yksisuuntaista varianssianalyysiä (One-Way Analysis Of Variance, One-way ANOVA) käytettiin Duncanin moninkertaisen vaihteluvälin testillä SPSS Statistics Ver. 17.0 -ohjelmassa. Tulokset ilmaistiin keskiarvoina ± SD ja tilastollinen ero, kun p < 0.05.
Tulokset
Amylaasia tuottavien bakteerien eristäminen
Tässä tutkimuksessa 13 amylaasipositiivista isolaattia osoitti selviä vyöhykkeitä 1 %:n tärkkelysagarilla erilaisilla Halo : Kolonia-suhteilla. Positiivisiksi tärkkelystä hajottaviksi bakteeripesäkkeiksi katsottiin ne pesäkkeet, jotka osoittivat selviä vyöhykkeitä jodiliuoksessa. Kaikilla bakteeri-isolaateilla oli samanlainen pesäkemorfologia, ja ne olivat grampositiivisia ja sauvamaisia bakteereja (taulukko 1). Tulokset osoittivat, että Halo : pesäkkeen suhde vaihteli 1,18:sta 1,71:een (taulukko 1). Bakteeri-isolaatteja käytettiin sitten optimaalisen amylaasientsyymin induktioajan määrittämiseen, ja vain ne kolme isolaattia, joilla oli korkeimmat spesifiset aktiivisuudet, esiteltiin kohdassa 3.4.
Amylaasia tuottavien bakteerien kantatunnistus
Kaikki 13 amylaasipositiivista bakteerikantaa sekvensoitiin 16S rRNA-geenin avulla kantojen tunnistamiseksi. BLAST-tulokset osoittivat, että kaikki amylaasipositiiviset isolaatit kuuluvat Bacillus-sukuun lukuun ottamatta yhtä Enterobacter-sukuun kuuluvaa isolaattia (taulukko 2). Niiden lähimmät sukulaiset löytyivät Intiasta, Kiinasta, Koreasta, Indonesiasta, Argentiinasta, Italiasta, Israelista, Yhdysvalloista, Argentiinasta ja Etelä-Afrikasta, ja niiden identtisyys vaihteli 96-100 prosentin välillä.
Fylogeneettinen analyysi
13 amylaasipositiivisen bakteerikannan ja kahden referenssikannan, joilla on oletettuja amylaasientsyymejä, muodostaman fylogeneettisen puun muodostaminen MEGA 7.0:aa käyttäen osoitti, että E. cloacae 2.1AL2 erosi evoluutioltaan muista bacilluskannoista (kuva 1). B. thuringiensis serovar konkukian (NCBI accession no. AB617494.1) -vertailukanta kehittyi eri tavalla kuin Bacillus-bakteerimme. Kuitenkin toinen vertailukanta B. cereus ATCC 14579 (NCBI accession no. MG708176.1), joka eristettiin saflorin lehdestä, Eqypt, osoitti samanlaista evoluutiota kuin meidän bakteerimme (kuva 1).
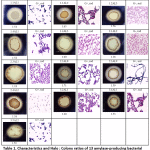 |
Taulukko 1: Ominaisuudet ja Halo : Colony ratios of 13 amylase-producing bacterial strains
Click here to View table |
Optimaalinen amylaasientsyymin induktiokesto
On käynyt ilmi, että inkubaation kesto, joka indusoi amylaasituotannon korkeimmalla spesifisellä aktiivisuudella, oli 2-3 vuorokautta kaikissa kolmessa eri isolaatissa, ilman että niissä olisi ollut tilastollisia eroja. Bacillus sp. 3.5AL2 näytti tuottavan korkeimman spesifisen aktiivisuuden, 0,91 ± 0,12 U/mg, toisena päivänä 37 °C:ssa (taulukko 3). Näin ollen tätä kantaa ja tätä olosuhdetta käytettiin amylaasituotannon indusointiin jatkoanalyysejä varten.
Amylaasientsyymiaktiivisuuden optimaalinen pH ja lämpötila
Bacillus sp. 3.5AL2 osoitti korkeinta spesifistä aktiivisuutta pH:ssa 7,0, kun se kiinnitettiin 37 °C:n lämpötilaan, ja 60 °C:n lämpötilassa, kun se kiinnitettiin pH:n 7,0:n lämpötilaan (kuva 2). Näin ollen molempia optimaalisia olosuhteita käytettiin spesifisen amylaasiaktiivisuuden määrittämiseen, ja tulokseksi saatiin 1,97 ± 0,41 U/mg (taulukko 4).
Taulukko 2: Kolmetoista amylaasipositiivista bakteerikantaa, jotka tunnistettiin 16S rRNA-analyysin avulla
| Isolaatti | Saantitieto
no. a |
Lähin sukulainenb | Accession no.c | % Identityd | Origine |
| 1.1AL1 | MK578206 | Bacillus pseudomycoides FJAT-hcl-17 | KY653098.1 | 99% | Host Paris polyphylla var. chinensis, Kiina |
| 1.1AL2 | MK578207 | Bacillus sp. 188Cu-As | KM349197.1 | 99% | Biofilmit, Argentiina |
| 1.2AL3 | MK578208 | Bacillus anthracis SAK4 | MG706137.1 | 100% | Multa, Korean tasavalta |
| 1.4AL1 | MK578209 | Bacillus sp. CNJ732 PL04 | DQ448749.1 | 99% | Merisedimentti, Yhdysvallat |
| 1.4AL3 | MK578210 | Bacillus cereus B19 | MK229038.1 | 99% | Vehnänjyvä, Isarael |
| 2.1AL2 | MK578211 | Enterobacter cloacae HNXY160623 | KX431213.1 | 98% | Lintujen alkio, Kiina |
| 2.3AL1 | MK578212 | Bacillus thuringiensis BD17-E12 | HF584771.1 | 99% | Viiniköynnöksen juuristo, Italia |
| 2.3AL8 | MK578213 | Bacillus cereus DFT-1 | KY750685.1 | 98% | Teollisuusalueen merivesi, Indonesia |
| 2.3AL9 | MK578214 | Bacillus sp. PTP1 | KY910137.1 | 96% | Papaijajauhokärpäsen suolisto, Intia |
| 2.4AL2 | MK578215 | Bacillus pseudomycoides 74 | MH910178.1 | 99% | Intia |
| 3.2AL1 | MK578216 | Bacillus thuringiensis
IARI-IIWP-38 |
KF054891.1 | 99% | Wheat rhizospere, Intia |
| 3.4AL1 | MK578217 | Bacillus cereus F4a | MK088302.1 | 99% | Tean rhizosfäärin maaperä, Intia |
| 3.5AL2 | MK578218 | Bacillus cereus SP1-AB4 | MH013307.1 | 99% | Marine sponge, Etelä-Afrikka |
aGenBank accession no. NCBI:n verkkosivuille talletettujen kantojemme (http://www.ncbi.nlm.nih.gov/pubmed)
bLäheisimmät lajit, joilla on korkein %:n identiteetti ja korkein Max-pistemäärä BLAST-haun perusteella
cGenBankin liittymisnumero NCBI:n verkkosivuille talletettujen lähisukulaiskantojemme osalta
dB BLAST-haun tulosten perusteella kantojen identiteetti (%) verrattuna
lähisukulaiskantoihin.
eLähimpien sukulaisten alkuperä BLAST-hakutulosten perusteella.
 |
Kuva 1. Amylaasipositiivisten bakteerikantojen ja 2 Bacillus-vertailukannan fylogeneettinen puu: 13 amylaasipositiivisen bakteerikannan ja 2 Bacillus-vertailukannan fylogeneettinen puu
Click here to View figure |
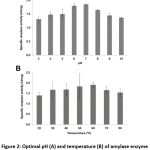 |
Kuva 2: Bacillus sp. 3:n amylaasientsyymiaktiivisuuden optimaalinen pH (A) ja lämpötila (B).5AL2
Click here to View figure |
Taulukko 3: Optimaalinen amylaasientsyymin induktion kesto
|
Isolaatti |
Spesifinen amylaasi aktiivisuus
(U/mg proteiinia) |
||
| 24 h | 48 h | 72 h | |
| Bacillus sp. 1.1AL2 | 0.21 ± 0.04Ab | 0.40 ± 0.04Ca | 0.41 ± 0.04Ba |
| B. cereus 2.3AL8 | 0.45 ± 0.06Ab | 0.62 ± 0.04Ba | 0.65 ± 0.06Aa |
| Bacillus sp. 3.5AL2 | 0.32 ± 0.11Ab | 0.91 ± 0.12Aa | 0.86 ± 0.11Aa |
Arvot ovat keskiarvoja ± SD kolmessa kappaleessa.
Isot ja pienet kirjaimet merkitsevät tilastollisia eroja (p < 0,05) sarakkeessa ja rivillä.
Taulukko 4: Spesifisen amylaasientsyymin aktiivisuus optimaalisessa pH:ssa ja lämpötilassa
| Kanta | Aktiivisuus (U/mg) | Optimaalinen Lämp. (°C) | Optimaalinen pH |
| Bacillus sp. 3.5AL2 | 1.97 ± 0.41 | 60 | 7.0 |
Keskustelu
Thaimaan tullin (2017) tiedot osoittivat, että Thaimaa on tuonut teollisia entsyymejä muista maista 2,625 miljoonan bahtin arvosta vuonna 2016, ja tuonti kasvoi 9,40 % vuodessa. Yksi Thaimaassa yleisimmin käytetyistä entsyymeistä, amylaasi, on ollut käytössä vaate-, tekstiili- ja elintarviketeollisuudessa. Kaupallisen amylaasin paikallinen tuotanto on kuitenkin puutteellista, ja siksi tässä työssä pyrittiin eristämään paikallisesta metsästä maaperän bakteereja, joilla on kyky tuottaa amylaasia teolliseen käyttöön.
Tärkkelyspitoiset jäämät voivat olla parempi potentiaalinen lähde, josta amylaasipositiivisia bakteereja voidaan eristää16. Lisäksi niitä voitaisiin eristää esimerkiksi maniokinviljelytiloilta, maaperästä ja jauhoja jalostavista tehtaista17. Tässä työssä eristettiin 13 amylaasia tuottavaa bakteeria, jotka tunnistettiin Bacillus spp. ja Enterobacter sp. -bakteereiksi, mikä vastaa aiempia raportteja18, 19, 20, joissa amylaasintuottajiksi löydettiin enimmäkseen Bacillus spp.
Tuloksistamme kävi ilmi, että Bacillus sp. 3.5AL2, joka oli 13:sta isolaatista korkeimman spesifisen aktiivisuuden omaava isolaatti, tuotti korkeimman spesifisen aktiivisuuden 0,91 ± 0,12 U/mg, kun sitä oli inkuboitu kaksi vuorokautta 37 °C:ssa. Amylaasiaktiivisuuden kannalta optimaalinen pH oli 7,0 ja lämpötila 60 °C. Molemmissa optimaalisissa olosuhteissa Bacillus sp. 3.5AL2:n spesifinen amylaasiaktiivisuus oli 1,97 ± 0,41 U/mg. Tiedetään, että entsyymeillä, jotka voivat toimia korkeassa lämpötilassa, katsotaan olevan etua teollisissa prosesseissa, kuten tärkkelyksen nesteyttämisessä21. Näin ollen Bacillus sp. 3.5AL2:sta saatavalla amylaasilla on potentiaalista käyttöä tällaisessa teollisuudessa.
Bacillus sp. GM890 osoitti amylaasin optimaalisen lämpötilan olevan 60 °C20, Bacillus licheniformis AI20:n aktiivisuus oli korkeimmillaan 60-80 °C:n välillä22 ja Bacillus sp. WA21:n amylaasioptimilämpötila oli alhaisempi, 55 °C19.
Useimpien tärkkelystä hajottavien bakteerikantojen pH-arvo oli 6,0-7,0 normaalin kasvun ja entsyymiaktiivisuuden kannalta4. Samoin tässä työssä Bacillus sp. 3.5AL2:n optimaalinen pH oli 7,0, mikä ei vaadi hapon tai emäksen lisäämistä. Tuloksemme oli yhdenmukainen dhal-teollisuuden jätteestä eristetyn Bacillus sp:n kanssa, jonka optimaalinen lämpötila oli 60 °C23 ja B. amyloliquefaciensin, jonka optimaalinen pH oli 7,024. Bacillus sp. WA21:n amylaasin optimaalinen pH oli kuitenkin 6,0, mikä on pienempi kuin tässä tutkimuksessa todettu pH19.
Tällainen tutkimus on erittäin tärkeä kaupallisen amylaasituotannon aloittamisen kannalta Thaimaassa. Lisätutkimukset ovat kuitenkin välttämättömiä, jotta amylaasituotanto olisi kustannustehokasta. Tarvitaan perusteellista entsyymin karakterisointia, termostabiilisuuden, pH-stabiilisuuden, eri metalli-ionien ja eri substraattien, erityisesti Thaimaassa esiintyvien maatalousjätteiden, vaikutuksen ja niiden pitoisuuksien tarkempaa määrittämistä.
Kun kaikki edellä mainitut tarvittavat tiedot on saatu, uskotaan, että kaupallisen amylaasin tuotanto Thaimaan entsyymiteollisuudessa lisääntyy ja leviää laajalti jokaisella alueella, ja se puolestaan hyödyttää maan taloutta, koska se on omavaraisesti riippuvainen omista resursseistaan amylaasientsyymin tuottamiseksi.
Johtopäätökset
Tämä on ensimmäinen raportti, jossa on yksilöity 13 amylaasia tuottavaa bakteerilajin isolaatteja maaperästä, joka on peräisin Nasinuanin yhteisömetsästä, Maha Sarakhamista. Kaikki bakteerit tunnistettiin Bacillus spp:ksi lukuun ottamatta yhtä Enterobacter-sukuun kuuluvaa bakteeria. Näitä bakteereja voidaan käyttää amylaasituotantoon ja soveltaa paikallisesti ja kansallisesti maataloudessa, elintarvikkeiden jalostuksessa ja tekstiiliteollisuudessa tulevaisuudessa. Näin voidaan vähentää muista maista tuotavien teollisten entsyymien tuontikustannuksia, varmistaa paikallisen entsyymituotannon kestävyys ja parantaa kansakunnan taloutta.
Kiitokset
Tekijät haluavat kiittää Mahasarakham-yliopistoa (apurahavuosi 2018) SD:lle myönnetystä taloudellisesta tuesta ja Mahasarakham-yliopiston teknillistä tiedekuntaa (apurahavuosi 2017) VL:lle myönnetystä taloudellisesta tuesta.
Interintäristiriita
Tekijät ilmoittavat, että heillä ei ole eturistiriitoja.
- Pandey A. Glukoamylaasien tutkimus: An overview. 47:439-445 (1995).
- Burhan A.I., Nisa U., Gokhan C., Omer C., Ashabil A. ja Osman G. Enzymatic properties of a novel thermostable, thermophilic, alkaline and chelator resistant amylase from an alkaliphilic Bacillus isolate ANT-6. Process Biochem. 38: 1397-1403 (2003).
- Gurung N., Ray S., Bose S. ja Rai, V.A. Broader view: Microbial enzymes and their relevance in industries, medicine and beyond. Biomed Res Internat. 1-18. doi:10.1155/2013/ 329121 (2013).
- Gupta R., Gigras P., Mohapatra H., Goswami V.K. ja Chauhan B. Microbial α-amylases: a biotechnological perspective. Process Biochem. 38:1599-1616 (2003).
- Takasaki Y. Maltotetroosia ja maltopentoosia tuottava amylaasi circulansista. Agric Biol Chem. 47:2193-2199 (1983).
- Fogarty W.M., and Kelly C.T. Amylase, amyloglucosidase and related glucanases. Rose A.H. Economic Microbiology, Microbial Enzymes and Bioconversion, New York Academic Press Inc, vol. 5. Pp. 115-170 (1980).
- Wind R.D., Buitelaar R.M.G., Huizing H.J., and Dijkhuizen L. Characterization of a new Bacillus stearothermophilus isolate: a highly thermostable α-amylase producing strain. Appl Microbiol Biotechnol. 41:155-162 (1994).
- Brumm P.J., Hebeda R.E. ja Teague W.M. Purification & characterization of commercialized, cloned megaterium α-amylase. Osa I: Puhdistus & hydrolyyttiset ominaisuudet. Tärkkelys. 43:319-323 (1991).
- Takasaki Y. Subtilis subtiliksen maltotrioosia tuottava amylaasi. Agric Bio. Chem. 49:1091-1097 (1985).
- Lowry O.H., Rosebrough N.J. ja Randall R.J. Protein measurement with the folin phenol reagents. J Biol Chem. 193: 265-275 (1951).
- Altschul S.F., Gish W., Miller W., Myers E.W. ja Lipman D.J. Basic local alignment search tool. J Mol 215:403-410 (1990).
- Bhaskara R.K.V., Ashwini K., Gaurav K. ja Karthik L. Optimization, production and partial purification of extracellular α-amylase from Bacillus marini. Arc Appl Sci Res. 3:33-42 (2011).
- GhoseK. Sellulaasiaktiivisuuden mittaaminen. Pure Appl Chem. 59: 257-268 (1987).
- Haq U.I., Ashraf H., Iqbal J., and Qadeer M.A. Production of α-amylase by Bacillus licheniformis using an economical medium. Biores Technol. 87:57-61 (2003).
- Mishra S., and Behera N. Amylase activity of starch degrading bacteria is isolated from soil receiving kitchen wastes. Afr J Biotechnol. 7: 3326-3331 (2008).
- Fossi B.T., Taveaand F., ja Ndjonenkeu T. Production and Partial Characterization of a Themostable amylase from Ascomycetes yeast strain isolated from starchy soils. Afr J Biotechnol. 4:14-18 (2005).
- Cordeiro C.A.M. Production and propertiesof α-amylase from thermophilic Bacillus sp. Brazil J Microbiol. 33:57-61 (2002).
- Asad W. Extracellular enzyme production by indigenous thermophilic bacteria: Bacillus sp. WA21:n tuottaman α-amylaasin osittainen puhdistus ja karakterisointi. Pakistan J Botany. 43:1045-1052 (2011).
- Kim T.U. Purification and characterization of a maltotetraose-forming alkaline α-amylase from an alkalophilic Bacillus strain, GM8901. Appl Envin Microbiol. 61: 83105-3112 (1995).
- Sivaramakrishnan S., Gangadharan D., Madhavan K.N. ja Pandey A. Solid culturing of Bacillus amyloliquefaciens for alpha amylase production. Food Technol 44:269-274 (2006).
- Abdel-Fattah Y.R., Soliman N.A., El-Toukhy N.M., El-Gendi H. ja Ahmed R.S. Purification, and characterization of thermostable α-amylase produced by Bacillus licheniformis isolate AI20. J Chem. 2013:1-11 (2013).
- Thippeswamy S., Girigowda K. ja Mulimani V.H. Isolation and identification of α-amylase producing Bacillus from Dhal
industry waste. Indian J Biochem Biophysics. 43: 295-298 (2006). - Abd-ElhalemT., El-Sawy M., Rawia F.G., and Khadiga A.A.T. Production of amylase from Bacillus amyloliquefaciens under submerged fermentation using some agro-industrialby-products. Ann Agri Sci. 60:193-202 (2015).
- Tamura K. ja Nei M. Estimation of the number of nucleotide substitutions in the control region of mitochondrial DNA in humans and chimpanzees. Mol Biol Evol. 10:512-526 (1993).

(Vierailtu 12,737 kertaa, 21 vierailua tänään).