Oppimistavoitteet
- Suhteuta alkuaineiden elektronikonfiguraatiot jaksollisen järjestelmän muotoon.
- Määritä alkuaineen odotettu elektronikonfiguraatio sen paikan perusteella jaksollisessa järjestelmässä.
Luvussa 3 ”Atomit, molekyylit ja ionit” esittelimme jaksollisen järjestelmän tunnettujen kemiallisten alkuaineiden järjestämisen välineenä. Jaksollinen järjestelmä on esitetty kuvassa 8.11 ”Jaksollinen järjestelmä”. Alkuaineet on lueteltu atomiluvun (protonien lukumäärä ytimessä) mukaan, ja alkuaineet, joilla on samankaltaisia kemiallisia ominaisuuksia, on ryhmitelty sarakkeisiin.
Kuva 8.11 Jaksollinen järjestelmä
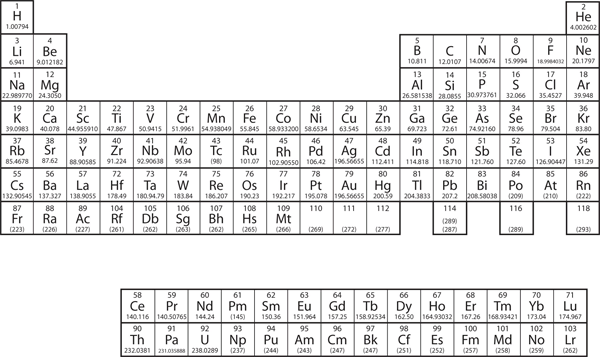
Miksi jaksollinen järjestelmä on rakenteeltaan sellainen kuin se on? Vastaus on melko yksinkertainen, jos ymmärtää elektronikonfiguraatioita: jaksollisen järjestelmän muoto jäljittelee alakuorien täyttymistä elektroneilla.
Aloitetaan H:sta ja He:stä. Niiden elektronikonfiguraatiot ovat vastaavasti 1s1 ja 1s2; He:llä n = 1 -kuori on täynnä. Nämä kaksi alkuainetta muodostavat jaksollisen järjestelmän ensimmäisen rivin (ks. kuva 8.12 ”1”).
Kuva 8.12 1s-alikuori
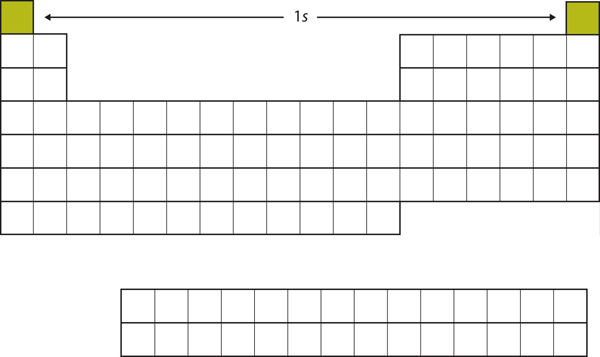
H ja He edustavat 1s-alikuoren täyttymistä.
Li:llä ja Be:llä seuraavat kaksi elektronia menisivät 2s-alikuoreen. Kuva 8.13 ”2” osoittaa, että nämä kaksi alkua ovat jaksollisessa järjestelmässä vierekkäin.
Kuva 8.13 2s-alikuori
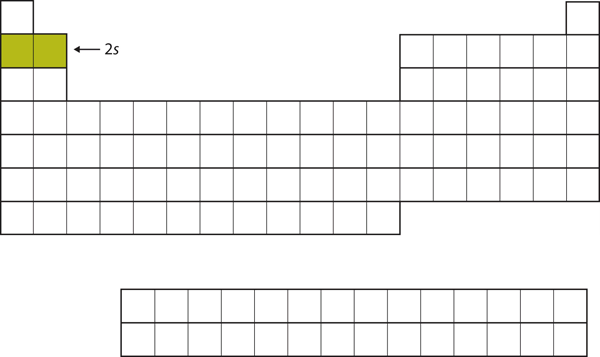
Li:llä ja Be:llä 2s-alikuori täyttyy.
Seuraaville kuudelle alkuainemuodostumalle 2p-alikuori täyttyy elektroneilla. Jaksollisen järjestelmän oikealla puolella nämä kuusi alkuainetta (B:stä Ne:hen) on ryhmitelty yhteen (kuva 8.14 ”The 2”).
Kuva 8.14 2p-alakuori
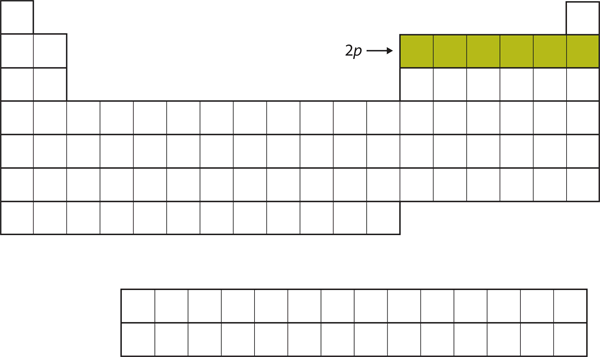
B:stä Ne:hen 2p-alakuori on varattu.
Seuraavaksi täytetään 3s-alakuori. Alkuaineet, joiden kohdalla tämä alikuori on täytetty, Na ja Mg, ovat taas jaksollisen järjestelmän vasemmalla puolella (kuva 8.15 ”The 3”).
Kuva 8. Alkuaineet, joiden kohdalla tämä alikuori on täytetty, Na ja Mg.15 3s-alikuori
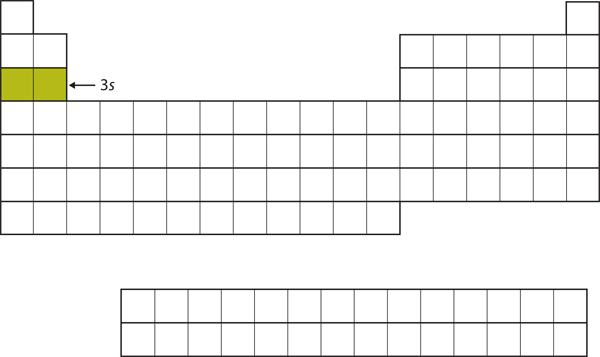
Nyt 3s-alikuori on miehitetty.
Seuraavaksi 3p-alikuori täyttyy seuraavilla kuudella alkuaineella (kuva 8.16 ”The 3”).
Kuva 8.16 3p-alakuori
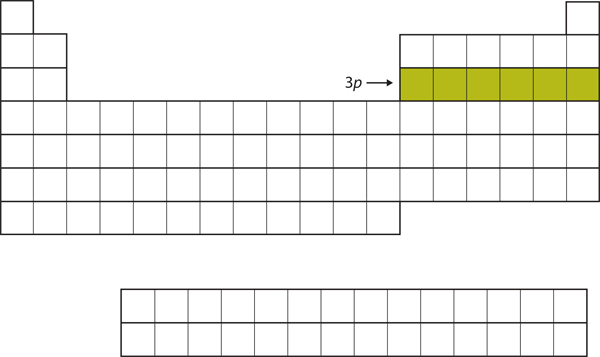
Seuraavaksi 3p-alakuori täytetään elektroneilla.
Seuraavaksi 3d-alakuoren täyttämisen sijaan elektronit menevät 4s-alakuoreen (kuva 8.17 ”The 4”).
Kuva 8.17 4s-alikuori
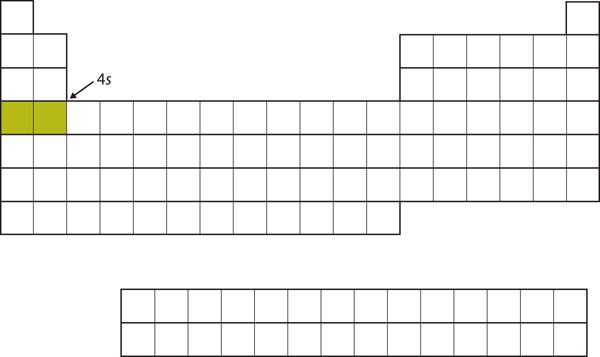
4s-alikuori täytetään ennen 3d-alikuorta. Tämä näkyy jaksollisen järjestelmän rakenteessa.
Kun 4s-alikuori on täyttynyt, 3d-alikuori täyttyy enintään 10 elektronilla. Tämä selittää 10 alkuaineen osion jaksollisen järjestelmän keskellä (kuva 8.18 ”3”).
Kuva 8.18 3d-alakuori
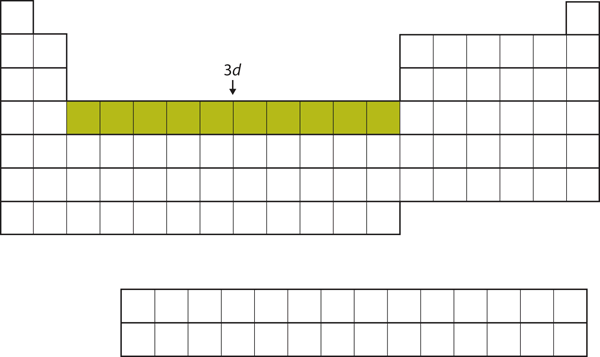
3d-alakuori täyttyy jaksollisen järjestelmän keskimmäisessä osassa.
Ja niin edelleen. Kun menemme jaksollisen järjestelmän rivejä pitkin, taulukon yleinen muoto hahmottaa, miten elektronit miehittävät kuoret ja alikuoret.
Jaksollisen järjestelmän vasemman puolen kahdessa ensimmäisessä sarakkeessa on s-alakuoret. Tämän vuoksi jaksollisen järjestelmän kaksi ensimmäistä riviä on nimetty s-lohkoksi. Vastaavasti p-lohko on jaksollisen järjestelmän oikeanpuoleisimmat kuusi saraketta, d-lohko on jaksollisen järjestelmän keskimmäiset 10 saraketta, kun taas f-lohko on 14-sarakkeinen osa, joka tavallisesti kuvataan irrotettuna jaksollisen järjestelmän päärungosta. Se voisi olla osa pääkappaletta, mutta silloin jaksollisuustaulukosta tulisi melko pitkä ja kömpelö. Kuvassa 8.19 ”Lohkot jaksollisessa järjestelmässä” on esitetty jaksollisen järjestelmän lohkot.
Kuva 8.19 Lohkot jaksollisessa järjestelmässä
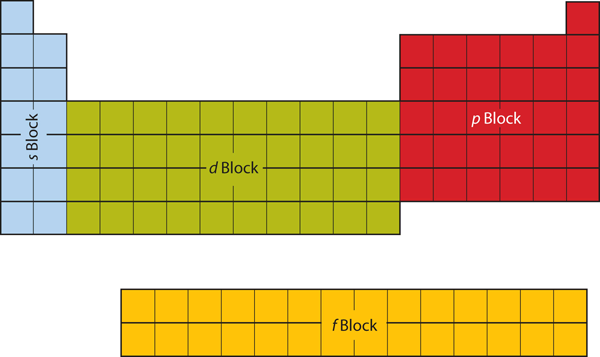
Jaksollinen järjestelmä on jaettu lohkoihin sen mukaan, millä alkuosalla täytetään kyseiseen lohkoon kuuluvat atomit.
Ylimmän kuoren elektroneja sekä viimeisen täyttämättömän alikuoren mahdollisia elektroneja kutsutaan valenssielektroneiksi; korkeimman numeron kuorta kutsutaan valenssikuoreksi. (Sisempiä elektroneja kutsutaan ydinelektroneiksi.) Valenssielektronit ohjaavat pitkälti atomin kemiaa. Jos tarkastelemme vain valenssikuoren elektronikonfiguraatiota, huomaamme, että jokaisessa sarakkeessa valenssikuoren elektronikonfiguraatio on sama. Otetaan esimerkiksi jaksollisen järjestelmän ensimmäisen sarakkeen alkuaineet: H, Li, Na, K, Rb ja Cs. Niiden elektronikonfiguraatiot (lyhennetty suurempien atomien osalta) ovat seuraavat, valenssikuoren elektronikonfiguraatio korostettuna:
| H: | 1s1 |
| Li: | 1s22s1 |
| Na: | 3s1 |
| K: | 4s1 |
| Rb: | 5s1 |
| Cs: | 6s1 |
Neillä kaikilla on valenssikuorissaan samanlainen elektronikonfiguraatio: yksi s-elektroni. Koska valenssielektronit vaikuttavat suureen osaan alkuaineen kemiasta, voisimme olettaa, että näillä alkuaineilla olisi samanlainen kemia – ja niin onkin. Elektronien järjestäytyminen atomeissa selittää jaksollisen järjestelmän muodon lisäksi myös sen, että jaksollisen järjestelmän samassa sarakkeessa olevilla alkuaineilla on samanlainen kemia.
Sama käsite pätee jaksollisen järjestelmän muihin sarakkeisiin. Kussakin sarakkeessa olevilla alkuaineilla on samat valenssikuoren elektronikonfiguraatiot, ja alkuaineilla on joitakin samanlaisia kemiallisia ominaisuuksia. Tämä pätee ehdottomasti kaikkiin s- ja p-lohkojen alkuaineisiin. Koska d- ja f-lohkoissa on poikkeuksia alakuorien täyttymisjärjestyksessä, samanlaiset valenssikuoret eivät ole ehdottomia näissä lohkoissa. Näissä lohkoissa on kuitenkin paljon samankaltaisuuksia, joten kemiallisissa ominaisuuksissa on odotettavissa samankaltaisuutta.
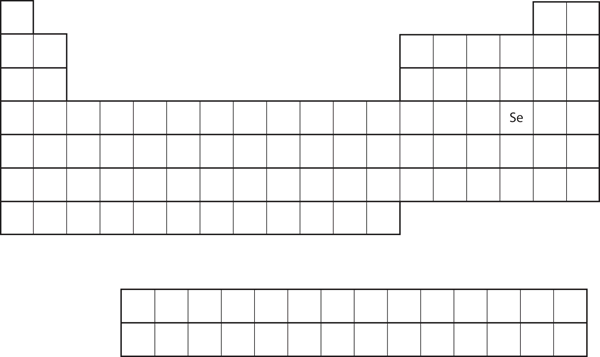
Valenssikuoren elektronikonfiguraation samankaltaisuus merkitsee sitä, että voimme määrittää atomin elektronikonfiguraation pelkästään sen sijainnin perusteella jaksollisessa järjestelmässä. Tarkastellaan Se:tä, joka on esitetty kuvassa 8.20 ”Seleeni jaksollisessa järjestelmässä”. Se on p-lohkon neljännessä sarakkeessa. Tämä tarkoittaa, että sen elektronikonfiguraation pitäisi päättyä p4-elektronikonfiguraatioon. Se:n elektronikonfiguraatio onkin odotetusti 4s23d104p4.
Kuva 8.20 Seleeni jaksollisessa järjestelmässä
Esimerkki 8
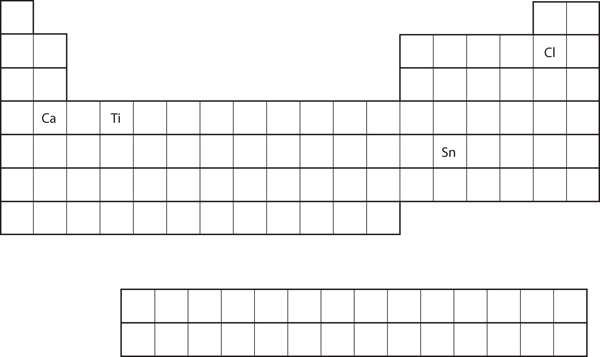
Ennustetaan alkuaineen sijoittuminen jaksollisessa järjestelmässä ja ennustetaan kunkin atomin valenssikuoren elektronikonfiguraatio. Katso kuva 8.21 ”Eri alkuaineet jaksollisessa järjestelmässä”.
- Ca
- Sn
Liuos
- Ca sijaitsee s-lohkon toisessa sarakkeessa. Odotamme, että sen elektronikonfiguraation pitäisi päättyä s2:een. Kalsiumin elektronikonfiguraatio on 4s2.
- Sn sijaitsee p-lohkon toisessa sarakkeessa, joten odotamme, että sen elektronikonfiguraatio päättyisi p2:een. Tinan elektronikonfiguraatio on 5s24d105p2.
Testaa itsesi
Ennusta kunkin atomin valenssikuoren elektronikonfiguraatio alkuaineen sijainnin perusteella jaksollisessa järjestelmässä. Katso kuva 8.21 ”Eri alkuaineet jaksollisessa järjestelmässä”.
- Ti
- Cl
Vastaus
- 4s23d2
- 3s23p5
Luku 8.21 Eri alkuaineet jaksollisessa järjestelmässä
Ruoka ja juoma App: Keinovärit
Kappaleiden väri syntyy eri mekanismilla kuin neon- ja muiden purkausvalojen värit. Vaikka värivalot tuottavat värinsä, esineet ovat värillisiä, koska ne heijastavat mieluiten tiettyä väriä niihin säteilevästä valkoisesta valosta. Esimerkiksi punainen tomaatti on kirkkaanpunainen, koska se heijastaa punaista valoa samalla kun se absorboi kaikki muut sateenkaaren värit.
Monet elintarvikkeet, kuten tomaatit, ovat erittäin värikkäitä; itse asiassa yleinen lausahdus ”syöt ensin silmilläsi” on implisiittinen tunnustus siitä, että ruuan visuaalinen miellyttävyys on yhtä tärkeää kuin sen maku. Mutta entä prosessoidut elintarvikkeet?
Moniin prosessoituihin elintarvikkeisiin on lisätty elintarvikevärejä. Elintarvikeväriaineita on kahdenlaisia: luonnollisia ja keinotekoisia. Luonnollisia elintarvikeväriaineita ovat karamellisoitu sokeri ruskean värin aikaansaamiseksi, annatto, kurkuma ja sahrami oranssin tai keltaisen eri sävyjen aikaansaamiseksi, punajuurista saatava betaniini violetin värin aikaansaamiseksi ja jopa karmiini, syvänpunainen väriaine, joka uutetaan sisäkorennosta, pienestä hyönteisestä, joka on kaktusten loinen Keski- ja Etelä-Amerikassa. (Aivan oikein: saatat syödä hyönteismehua!)
Jotkut väriaineet ovat keinotekoisia. Yhdysvalloissa Food and Drug Administration (elintarvike- ja lääkevirasto) hyväksyy tällä hetkellä vain seitsemän yhdistettä keinotekoisiksi väriaineiksi elintarvikkeisiin, juomiin ja kosmetiikkaan:
- FD&C Sininen #1: Brilliant Blue FCF
- FD&C Sininen #2: Indigotine
- FD&C Punainen #40: Allura Red AC
- FD&C Keltainen #5: Keltainen #6: Sunset Yellow FCF
FD&C Vihreä #3: Punainen #3: Erytrosiini
Alempana olevat värit eivät ole enää markkinoilla tai ne on poistettu eri syistä. Tyypillisesti nämä keinotekoiset väriaineet ovat suuria molekyylejä, jotka absorboivat tiettyjä valon värejä hyvin voimakkaasti, minkä vuoksi ne ovat käyttökelpoisia jopa hyvin pieninä pitoisuuksina elintarvikkeissa ja kosmetiikassa. Jotkut kriitikot väittävät, että pieni osa väestöstä (erityisesti lapset) on herkkiä keinotekoisille väriaineille, ja vaativat niiden käytön rajoittamista tai lopettamista. Viralliset tutkimukset keinotekoisista väriaineista ja niiden vaikutuksista käyttäytymiseen ovat kuitenkin olleet epäselviä tai ristiriitaisia. Tästä huolimatta suurin osa ihmisistä nauttii edelleen keinotekoisia väriaineita sisältäviä prosessoituja elintarvikkeita (kuten oheisessa kuvassa esitettyjä).

Teknisiä elintarvikeväriaineita on monissa elintarvikkeissa, kuten prosessoiduissa elintarvikkeissa, karkkeissa ja kananmunien väriaineissa. Jopa lemmikkieläinten ruoassa on keinotekoisia elintarvikeväriaineita, vaikka on todennäköistä, että eläin ei välitä!
Lähde:
Key Takeaways
- Elektronien sijoittelu atomeissa on vastuussa jaksollisen järjestelmän muodosta.
- Elektronikonfiguraatiot voidaan ennustaa atomin sijainnin perusteella jaksollisessa järjestelmässä.
Harjoituksia
-
Missä kohtaa jaksollista järjestelmää s alikuoret ovat elektronien käytössä?
-
Missä kohtaa jaksollista järjestelmää d-alakuoret ovat elektronien valtaamia?
-
Missä lohkossa Ra esiintyy?
-
Missä lohkossa Br esiintyy?
-
Mitkä ovat jaksollisen järjestelmän toisen sarakkeen alkuaineiden valenssikuoren elektronikonfiguraatiot?
-
Mitkä ovat jaksollisen järjestelmän toiseksi viimeisen sarakkeen alkuaineiden valenssikuoren elektronikonfiguraatiot?
-
Mitkä ovat p-lohkon ensimmäisen sarakkeen alkuaineiden valenssikuoren elektronikonfiguraatiot?
-
Mitkä ovat p-lohkon viimeisen sarakkeen alkuaineiden valenssikuoren elektronikonfiguraatiot?
-
Ennusta alkuaineen sijainnin perusteella jaksollisessa järjestelmässä kunkin atomin elektronikonfiguraatio.
a) Sr
b) S
10. Ennusta alkuaineen sijainnin perusteella jaksollisessa järjestelmässä kunkin atomin elektronikonfiguraatio.
a) Fe
b) Ba
11. Ennusta alkuaineen sijainnin perusteella jaksollisessa järjestelmässä kunkin atomin elektronikonfiguraatio.
a) V
b) Ar
12. Ennusta alkuaineen sijainnin perusteella jaksollisessa järjestelmässä kunkin atomin elektronikonfiguraatio.
a) Cl
b) K
13. Ennusta alkuaineen sijainnin perusteella jaksollisessa järjestelmässä kunkin atomin elektronikonfiguraatio.
a) Ge
b) C
14. Ennusta alkuaineen sijainnin perusteella jaksollisessa järjestelmässä kunkin atomin elektronikonfiguraatio.
a) Mg
b) I
Vastaukset
kahdesta ensimmäisestä sarakkeesta
s-lohko
ns27.
ns2np19.
a) 1s22s22p63s23p64s23d104p65s2
b) 1s22s22p63s23p411.
a) 1s22s22s22p63s23p64s23d3
b) 1s22s22s22p63s23p613.
a) 1s22s22s22p63s23p64s23d104p2
b) 1s22s22p2