- Background and Introduction
- Tapauksen esittely
- Keskustelu
- ADI:n patofysiologia
- Kirjallisuushaku
- ADI:n syyt
- ADI:n kliininen esitys
- ADI:n liitännäiskomplikaatiot
- Aivolisäkkeen ADI-oireyhtymän hoitokäytännöt
- Johtopäätös
- Tietojen saatavuus
- Eettiset lausunnot
- Osallistumislupa
- Tekijöiden panos
- Rahoitus
- Conflict of Interest Statement
- Kiitokset
Background and Introduction
Hypothalamic Adipsic Diabetes Insipidus (ADI), harvinainen oireyhtymä, jolla on harvinainen ja heterogeeninen kliininen oirekuva, jolle on ominaista useat puutteet vedentasapainon tasaantumisen homoostaattisissa mekanismeissa. Näihin kuuluvat janomekanismin osmoregulaatio, arginiinivasopressiinin eritys ja munuaisten kyky konsentroida virtsaa. Vaikeita tapauksia on raportoitu maailmanlaajuisesti alle sata viimeisten neljän vuosikymmenen aikana (1).
Tällaisten potilaiden hoito on erittäin haastavaa, sillä näillä potilailla on taipumus kärsiä plasman natriumin suurista vaihteluista silloinkin, kun DI on hyvin hallinnassa (2).
Raportoimme tapauksen vakavasta ADI:stä, joka ilmeni postoperatiivisesti aivojen arteriovenoottisen epämuodostuman (AVM) leikkauksen jälkeen. Kuvaamme tämän tapauksen mahdollisen patogeneesin ja käymme läpi kirjallisuuden kaikista vastaavista raportoiduista tapauksista ja kuvaamme mahdolliset asiaan liittyvät mekanismit, kliinisen esityksen, akuutin sekä kroonisen hoidon ja ennusteen.
Tapauksen esittely
27-vuotias nainen sai vasemman otsalohkon sisäisen aivoverenvuodon, jolla oli intraventrikulaarinen laajentuma, joka oli sekundaarinen basaaliganglioiden suuren kompleksin (AVM) aiheuttama, johon liittyi monimutkaisia valtimosyöttöjä vasemmanpuoleisista keskimmäisistä aivovaltimoista (MCA) ja etummaisista aivovaltimoista (ACA-valtimoista), ja jonka Spetzlerin-Martininin luokitusasteikolla se oli 3 (3).
Dekompressiivisen kraniotomian ja hyytymän poistoleikkauksen jälkeisen alkuvaiheen toipumisen jälkeen hänelle tehtiin valinnainen AVM:n poistoleikkaus ~2 viikkoa myöhemmin. AVM-leikkauksen aikana kirurgit raportoivat vilkasta verenvuotoa syöttöverisuonista (MCA, ACA ja suonikohjuverisuonet), joihin liittyi vakava aivonsisäinen verenvuoto ja kammionsisäinen verenvuoto, joka vaati massiivista verensiirtoa jopa 32 yksikköä intraoperatiivisesti. Hänet asetettiin barbituraatti-indusoituun koomaan ja indusoituun hypotensioon aivo-ödeeman minimoimiseksi (4).
Hänellä alkoi pian runsaan intraoperatiivisen verenvuodon episodin jälkeen polyuria, johon liittyi suuria virtsamääriä intraoperatiivisesti. Vaikka hänen natriumpitoisuutensa olivat preoperatiivisesti normaalit, natriumpitoisuudet olivat korkeammat välittömästi (ensimmäisen tunnin aikana) postoperatiivisesti välillä 151-160 mmol/l yhdessä virtsan alhaisen osmolaliteetin <130 mosm/l kanssa. Ohimenevää DI:tä pidettiin ohimenevänä, ja hänelle alettiin antaa suonensisäisesti desmopressiiniä (IV desmopressiini) 1 mcg, jota annettiin päivittäin yhdessä 3,5-4 L puolivahvan suolaliuosinfuusion kanssa kolmena peräkkäisenä päivänä.
Hän sai kuitenkin sittemmin keuhkoödeeman (joka oli todennäköisesti seurausta massiivisesta verensiirrosta intraoperatiivisesti, laskimonsisäisestä hypotonisesta nesteytyksestä ja samanaikaisesta laskimonsisäisestä desmopressiinista) postoperatiivisena päivänä 4. Laskimonsisäisen desmopressiinin anto lopetettiin ja hänelle annettiin tuoretta pakastettua veriplasmaa ja diureetteja (laskimonsisäistä furosemidiä 40 mg) verisuontenulkoisen ödeeman vähentämiseksi. Seuraavan tunnin aikana hänellä alkoi jälleen esiintyä polyuriaa, ja virtsaneritys oli 800 ml yhden tunnin aikana, ja hänen natriumpitoisuutensa nousi 172 mmol/l:iin. Samanaikaisen postoperatiivisen aivo-ödeeman vuoksi natriumpitoisuuksia päätettiin laskea kohdennetusti siten, että natriumin laskunopeus pysyi 5-10 mmol/l/vrk ja tavoitetasona 155 mmol/l. Laskimoon annettiin pieni annos desmopressiinia 0,25 mcg ja ehdotettiin titrausohjelmaa, jotta virtsaneritys pysyisi alle 100 ml/h tunnissa. Hän tarvitsi suonensisäisesti 0,75 mcg desmopressiinia postoperatiivisena päivänä 5 ja sitten suonensisäisesti 0,25 mcg kahdesti päivässä päivänä 6, kun tavoitetaso oli 155 mmol/l. Tämä natriumpitoisuus pystyttiin pitämään yllä desmopressiinin annostelulla vielä kahden päivän ajan.
Postoperatiivisena päivänä 9 desmopressiini lopetettiin, koska hän pystyi ylläpitämään matalan virtsanerityksen ilman desmopressiinia, ja natriumpitoisuudet olivat vakaat. Tässä vaiheessa katsottiin, että hänelle oli kehittynyt epäsopivan anti-diureettisen hormonin erityksen oireyhtymä (SIADH), ja nesteytys rajoitettiin 1 litraan päivässä. Hänen natriumpitoisuutensa pysyi vakaana 134-138 mmol/l:ssä tämän viikon aikana.
Postoperatiivisena päivänä 14 hänelle kehittyi jälleen polyuria ja natriumpitoisuudet ja seerumin osmolaliteetti nousivat. Tällöin aloitettiin uudelleen desmopressiinin antaminen suonensisäisesti 0,25 mcg kahdesti vuorokaudessa. Natriumpitoisuudet voitiin pitää 138-150 mmol/l:ssä suonensisäisellä desmopressiinillä (0,25 mcg kahdesti päivässä) ja nesteytyksellä. Hän oli käynyt läpi kolmivaiheisen vaiheen, jossa oli ohimenevä DI, jota seurasi SIADH ja sen jälkeen pysyvä DI (ks. kuva 1). Seerumin kortisoli-, kasvuhormoni-, insuliinin kaltainen kasvutekijä-1-, kilpirauhasen toiminta- ja prolaktiiniarvot olivat kaikki normaalialueella.

KUVIO 1. Kortisoli-, kasvuhormoni-, insuliinin kaltainen kasvutekijä-1-, kilpirauhasen toiminta- ja prolaktiiniarvot. Kaavio, jossa näkyvät kaikki sarjamittaukset potilaallamme koko sairaalahoidon ajan.
Kuusi viikkoa AVM:n poiston jälkeen hänelle asennettiin ventrikuloperitoneaalinen shuntti (tehtiin kallonsisäisen paineen ylläpitämiseksi), minkä jälkeen hänet siirrettiin kuntoutusosastolle, ja laskimonsisäinen desmopressiinihoito muutettiin subkutaaniseksi (SC) hoidoksi (ks. kuva 1). Kun nasogastrinen letkuruokinta lopetettiin, yritimme säädellä nesteitä janolla. Veritutkimukset osoittivat natriumpitoisuuden nousevan 165 mmol/l:iin, eikä hän tuntenut janoa tämän hypernatremian aikana, vaikka seerumin osmolaliteetti oli 350 mosm/kg. Hän pysyi adipsiassa afasian toipumisesta huolimatta. Janoasteikkoa ei käytetty, koska kysyttäessä hän sanoi, ettei tuntenut lainkaan janoa, eikä janoasteikkoa voitu käyttää. Näin ollen nesteitä oli säädeltävä natriumtasapainon ylläpitämiseksi. Hänen virtsanerityksensä pysyi vakaana ja natriumtasapaino hyvin säänneltynä desmopressiinilla, joka annettiin 0,5 mcg desmopressiiniä aamulla ja 0,375 mcg desmopressiiniä illalla, ja nesteitä annettiin säänneltynä 1,5-2 litraa vuorokaudessa. Hänellä ei ollut merkkejä lämmönsäätelyhäiriöistä. Polyeetterieetteriketoni (PEEK) kranioplastia tehtiin ~4 kuukautta alkuperäisen leikkauksen jälkeen.
Viiden kuukauden intensiivisen monialaisen kuntoutuksen jälkeen hänellä oli edelleen toimintakyvytön dominoiva oikea käsi ja merkittäviä kognitiivisia jäännösvajeita, eikä ihonalaisen desmopressiinin turvallinen annostelu ja omatoiminen antaminen ollut mahdollista pitkällä aikavälillä.
Nenän kautta annettavan desmopressiinin ja suun kautta otettavan desmopressiinin kokeilu osoitti merkittävää imeytymisen vaihtelua, mikä johti suurempiin vaihteluihin natriumpitoisuuksissa. Tämän jälkeen päätimme käyttää desmopressiini Melt -nimellä saatavaa sublingvaalista desmopressiinia. Useiden eri annostelujärjestelyjä koskevien kokeilujen jälkeen saimme virtsanerityksen pysymään noin 2 litrassa vuorokaudessa, kun käytimme desmopressin Melt -oraalista lyofilisoitua liuosvalmistetta 120 mikrogrammaa (2 tablettia) aamulla ja 60 mikrogrammaa (1 tabletti) illalla. Tällä annoksella hänellä oli kuitenkin hyponatremiaa tiettyinä vuorokauden aikoina. Lisäsimme annoksen titrausta leikkaamalla desmopressiinitabletit pinseteillä/pihdeillä nostamalla tabletit läpipainopakkauksesta ja leikkaamalla tabletit pillerileikkurin avulla tarkkoihin neljännesosiin (kukin 15 mcg). Aamulla 90 mcg:n (1,5 tablettia) ja illalla 75 mcg:n (1,25 tablettia) annostelulla saavutettiin samanlaiset tulokset kuin ihonalaisella annostelulla. Tällä järjestelmällä ja säännellyllä nesteen saannilla (2 litraa päivässä) hänen natriumpitoisuutensa pysyivät välillä 135-150 mmol/l ilman suurempia vaihteluita tai kognitiivisia oireita. Tämä annostelu mahdollisti myös hänen lisääntyneen aktiivisuutensa päivällä kuntoutusta varten, ja hän pystyi nukkumaan hyvin häiriintymättä yöllisestä polyuriasta.
Kuvassa 1 on esitetty tämän potilaan natriumin sarjamittaukset koko sairaalahoitojakson ajan edellä kuvattujen tapahtumien yhteydessä.
Kliinisen anamneesin ja sen seikan vuoksi, että hänen aivolisäkkeensä ja hypotalamuksensa ovat suurimmaksi osaksi vahingoittumattomia, on epätodennäköistä, että hänellä olisi ollut huomattavia baroregulaatiovirheitä.
Keskustelu
ADI:n patofysiologia
Fysiologisissa olosuhteissa plasman natrium-, osmolaliteetti- ja vesitasapaino pysyvät kapeilla vaihteluväleillä toissijaisesti janon ja veden saannin, neurohypofyysisen vasopressiinin erityksen ja munuaisten distaalisten keräysputkien antidiureesin huolellisen vuorovaikutuksen ansiosta.
Perifeeriset signaalit (orofaryngeaaliset, suoliston osmosensorit, veren osmolaliteetti) koodaavat reaaliaikaisesti tietoa senhetkisestä nesteytystilasta, ja ne integroidaan keskitetysti (5). Dehydraatiotila johtaa stimuloiviin signaaleihin subfornikaaliseen elimeen (SFO), joka hierarkkisesti lähettää signaaleja lamina terminaliksen organum-vasculosumiin (OVLT) ja mediaaniseen preoptiseen ytimeen (MnPO) (6). MnPO, joka voi toimia ”keskusilmaisimena”, lähettää stimuloivia signaaleja hypotalamuksen ytimiin lisäämään vasopressiinin vapautumista ja lähettää myös lisääntyneen janosignaalin SFO:n ja OVLT:n kautta (7, 8). Janoon liittyvät hermoradat, jotka yhdistävät SFO:n ja OVLT:n cingulaariseen ja insulaariseen aivokuoreen, johtavat janon tietoiseen havaitsemiseen (7, 8). Riittävän nesteytyksen vallitessa perifeeristen antureiden signaalit johtavat päinvastoin näiden alueiden inhibitioon ja MnPO:n negatiiviseen palautteeseen, joka johtaa janon tukahduttamiseen ja vähentää vasopressiinin eritystä ja vapautumista (punainen piiri). Itse asiassa MnPO:n, OVLT:n ja SFO:n neuronit ovat laajasti ja vastavuoroisesti yhteydessä toisiinsa, koska minkä tahansa näiden alueiden neuronien optogeneettinen ja kemogeneettinen aktivointi voi stimuloida janoa (9). Näin ollen soluvaurioon johtava verenkierron häiriö johtaa rasvoittumiseen. Myös SFO:n ja OVLT:n hermosolujen autoimmuunisuudesta johtuvia ADI-tapauksia on julkaistu, mikä osoittaa näiden hermosolujen antureiden toiminnallisen merkityksen janonsäätelyssä (10).
AVP-neuroneilla on toimintapotentiaalien ”faasimaista” aktiivisuutta, ja niiden välillä on välejä, joissa AVP:tä vapautuu aksoniterminaaleissa. Vasopressiinin vapautumista säätelevät MnPO:n osmosensoriset tulot baroreseptoreiden kautta, ja lisäksi on olemassa ennakoiva säätely, jossa vasopressiinin vapautumista stimuloidaan ennen aterioita (prandial), hypertermian yhteydessä ja vuorokausirytmin mukaisesti (11). Vasopressiinin eritys verenkierrossa on vuorokausirytmissä, jolloin pitoisuudet kasvavat kello 24:00 ja 02:00 välisenä aikana, ja pitoisuudet laskevat asteittain vuorokauden aikana siten, että ne ovat alimmillaan kello 16:00 ja 20:00 välisenä aikana (12). Tämä vasopressiinin vapautumisen lisääntymisen aiheuttama vuorokausittainen keskiyöllinen nousu johtuu osittain suprachiasmaattisen ytimen, jonka tiedetään säätelevän vuorokausirytmiä, magnosellulaaristen neurosekretoristen neuronien lisääntyneestä synaptisesta eksitaatiosta (11). ADI:ssä vasopressiinin erityksen osmosensorinen säätely vaikuttaa eniten, ja muut vaikutukset saattavat vaihdella vamman paikasta ja laajuudesta riippuen, kun taas baroreseptorivasteen tiedetään säilyneen monilla potilailla, joilla on vain vähän vammoja, kuten eräässä tutkimuksessa osoitettiin (13).
AVP vaikuttaa munuaisten keräysputkiin vasopressiini-2 (V2)-reseptoreiden välityksellä lisättäen veden läpäisevyyttä, mikä johtaa virtsan muodostumisen vähenemiseen. Veden takaisinimeytymistä ohjataan vesikanavan, akvaporin-2:n (AQP2), säätelyn kautta. AVP indusoi lyhyellä aikavälillä AQP2:ta sisältävien vesikkelien solunsisäisen translokaation apikaaliseen plasmakalvoon, mikä säätelee AQP2:n kulkeutumista. Pitkällä aikavälillä riittävillä AVP-pitoisuuksilla se säätelee AQP2-geenin transkriptiota lisäten AQP2-proteiinin määrää keräyskanavassa (14). ADI:ssä oletamme, että on todennäköistä, että akuutti osmosensorinen vaste vaikuttaa enemmän kuin krooninen vaste. Näin ollen akvaporinin suhteellinen runsaus säilyy, mutta akuutti kulkeutuminen apikaaliseen kalvoon kärsii.
Kuvassa 2 on yksityiskohtainen kuvaus mekanismeista.
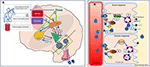
Kuvio 2. Mekanismit. Kaavamainen esitys nestetasapainon säätelystä ihmisellä. (A) Vasopressiinin erityksen ohjaus ja säätely aivoissa. (A) Perifeeriset signaalit (orofaryngeaaliset, suoliston osmosensorit, veren osmolaliteetti) koodaavat tietoa senhetkisestä nesteytystilasta reaaliaikaisesti (1) ja keskitetysti integroituna (2). Dehydraatiotila johtaa stimuloiviin signaaleihin SFO:lle, joka lähettää hierarkkisesti signaaleja OVLT:lle ja MnPO:lle (3). MnPO, joka voi toimia ”keskusilmaisimena”, lähettää stimuloivia signaaleja hypotalamuksen ytimiin lisäämään vasopressiinin vapautumista (4) ja lähettää myös lisääntyneen janosignaalin SFO:n ja OVLT:n kautta (5, sininen piiri kuvassa). Riittävän nesteytyksen tilassa perifeeristen antureiden antamat signaalit sitä vastoin estävät näitä alueita ja MnPO:n negatiivinen palaute johtaa janon tukahduttamiseen ja vähentää vasopressiinin eritystä ja vapautumista (punainen piiri 6). Janoon liittyvät hermoradat, jotka yhdistävät SFO:n ja OVLT:n cingulaariseen ja insulaariseen aivokuoreen, johtavat janon tietoiseen havaitsemiseen (7). Adipsisessa DI:ssä osmosensoristen ärsykkeiden puuttuessa niihin liittyvät hermopiirit, jotka johtuvat soluvauriosta, vasopressiinin stimuloivasta vapautumisesta tai estämisestä, ja janon tietoinen havaitseminen ovat molemmat häiriintyneet. (B) Vasopressiinin vaikutusmekanismi munuaisten keräysputkissa. (B) Verenkierrossa oleva vasopressiini kiinnittyy vasopressiinireseptoriin 2 munuaisten distaalisen keräilyputken pääsolujen luminaalipinnalla (1). Akuutissa vaiheessa se muodostaa AC:n (adenylaattisyklaasi) kautta ATP:stä cAMP:n synteesin kautta proteiinikinaasi A:ta (2), joka stimuloi akvaporiinin translokaatiota varastointivesikkelistä apikaaliseen kalvoon ja veren luminaalipinnalle (3). Tämä johtaa veden kulkeutumiseen soluun (4) ja sen imeytymiseen verenkiertoon (5). Kroonisessa vaiheessa akvaporiinigeenin cAMP-välitteisen transkriptionaalisen kontrollin (6) kautta akvaporiini-vesikanavan lisääntyneitä pitoisuuksia voidaan havaita pääsoluissa (7). Adipsisessa DI:ssä akuutti vaste vaikuttaa todennäköisesti enemmän kuin krooninen vaste, koska osmoosiin liittyvä vasopressiinin eritys vaikuttaa.
Kirjallisuushaku
Toteutimme systemaattisen kirjallisuushaun, joka sisälsi Pubmedin, Scopuksen ja Embasen, ADI:n tapausselostuksina tai tapaussarjoina raportoiduista tapauksista vuosilta 1980-2018. Käytimme hakusanaa: Adipsia, Adipsic disorder ja Adipsic DI, ja rajasimme haun englanninkieliseksi ja koskemaan ihmistä. Haimme myös kaikkia muita viitteitä, jotka tunnistimme kunkin tapausraportin/tapaussarjan lukemisen aikana. Löysimme 25 viitettä (10, 13, 15-39), joissa oli yhteensä 45 kirjallisuudessa raportoitua tapausta. Olemme tehneet yhteenvedon kaikista tapausraporteista taulukkoon 1.
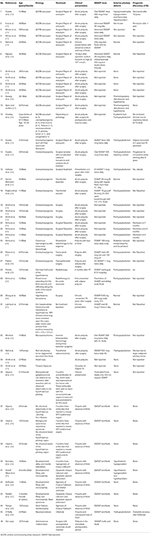
TAULUKKO 1. Kirjallisuudessa raportoitujen adipsista diabetes insipidusta sairastavien potilaiden demografiset tiedot, etiologia, kliininen esitys, hoito ja ennuste.
ADI:n syyt
Kirjallisuudessa kuvatuista ADI-tapauksista 40 prosenttia (17/46) ilmeni sekundaarisesti anteriorisen kommunikoivan valtimon (ACOM) aneurysman repeämisen ja leikkauksen jälkeisen leikkauksen jälkeen otsalohkon kraniektomian lähestymistapaa käyttäen. Yhdessä tapauksessa kuvattiin kaksoispatologia, kraniofaryngioma ja ACOM-aneurysma (15). OVLT:n valtimosyötön on kuvattu tulevan neljästä lähteestä (40): (1) ylemmästä mediaanilähteestä, joka haarautuu etummaisesta viestivästä valtimosta, (2) ja (3) kahdesta lateraalilähteestä, jotka tulevat valtimoista, jotka haarautuvat kustakin etummaisesta aivovaltimosta etummaisen viestivän valtimon alapuolella, ja (4) alemmasta mediaanilähteestä, joka nousee näköhermon alapuolelta. On tyypillistä, että tätä elintä reunustavat kapillaarit sijaitsevat veri-aivoesteen ulkopuolella, joten nämä elimet voivat helposti aistia osmolaliteetin muutoksen (41). On huomattava, että kirurgisten tekniikoiden parantuminen ja kelauksen käyttö leikkauksen sijasta voi vähentää näitä komplikaatioita. Hyvissä kliinisissä olosuhteissa olevien potilaiden, joilla on repeytynyt aneurysma anteriorisessa verenkierrossa ja jotka soveltuvat kelausleikkaukseen, meta-analyysin tiedot osoittavat, että kelausleikkaus on yhteydessä parempaan lopputulokseen (42). Verrattuna klippaukseen, jossa ACA:n molemmat päät leikataan, jolloin hypotalamuksen verenkierto katkeaa, kelauksen asettaminen aneurysmaan pystyy useimmissa tapauksissa säilyttämään hypotalamuksen syöttöaukot.
Toisena ADI:n syynä on kuvattu suprasellulaarinen kraniofaryngioma (17/46). Näissä tapauksissa tehdään usein transfrontaalinen poisto, ja joissakin tapauksissa on kuvattu toipumista leikkauksen jälkeen. On myös kuvattu kavernoottisen hemangiooman tapaus, jolla on samanlainen ilmenemismuoto verenvuotokohtauksen jälkeen (26).
Hypotalamuksen kasvaimet, mukaan lukien hamartooma, käpyrauhaskasvain ja itusolukasvain, voivat aiheuttaa ADI:n (26, 29, 30). On raportoitu tapaus hepatosellulaarisesta karsinoomasta, jolla oli etäpesäkkeitä hypotalamukseen ja joka johti ADI:hen (31).
Mielenkiintoista on, että vain kaksi tapausta aivolisäkekasvaimista, joihin liittyy ADI, on kuvattu (18, 32). Molemmissa näissä tapauksissa kasvain oli aggressiivinen, ja siihen liittyi useita transfrontaalisia resektioita ja kallonsisäinen verenvuoto intraoperatiivisesti. Kumpikin tapaus on kuvattu myös päävamman ja tolueenialtistuksen yhteydessä (13).
Neljässä tapauksessa on kuvattu äkillinen akuutti polyuria ja hypernatremia. Näillä potilailla ei ollut rakenteellisia poikkeavuuksia hypotalamuksessa, ja yksityiskohtaisissa tutkimuksissa havaittiin todisteita OVLT-elinten vasta-aineista. Näiden tapausten taustalla on oletettu olevan autoimmuunipatologia (10, 33).
Synnynnäisiä tai varhaislapsuuden tapauksia potilailla, joilla on corpus callosumin kehityshäiriöitä, on myös kuvattu ADI:n ilmenemismuotona (34-38). On myös kuvattu tapaus neurosarkoidoosia, joka vaikutti laajasti aivolisäkkeen etuosaan, aivolisäkkeen takaosaan ja hypotalamukseen ja johon liittyi ADI (39).
ADI:n kliininen esitys
Kliininen esitys useimmissa kuvatuissa tapauksissa on polyuria heti AVM:n kirurgisen leikkauksen tai kraniotomian jälkeisellä viikolla. Biokemiallinen oirekuva on hypernatremia, jossa seerumin osmolaliteetti on kohonnut, kun virtsan määrä on epätarkoituksenmukaisesti laimea ja suuri. Jos janon tunnetta arvioidaan janoasteikolla, nämä ADI-potilaat raportoivat vähäisestä tai vähäisestä janosta hypernatremiasta huolimatta. Mielenkiintoista on, että näillä potilailla on normaali vaste hypotensioon ja heidän baroreseptorimekanisminsa on ehjä (13).
Potilaamme kävi läpi kolmivaiheisen alkuvaiheen DI:n, jota seurasi SIADH ja sitten pysyvä DI. Tätä trifaasivasteeksi kuvattua mallia on kuvattu aivolisäke- ja kraniofaryngioomaleikkausten jälkeen. Kolmivaiheisen vasteen patofysiologia näyttää selittyvän varhaisella hypotalamuksen toimintahäiriöllä (jolle on ominaista polyuria ja hypernatremia), sitä seuraavalla valmiiksi muodostuneen vasopressiinin vapautumisella posteriorisen aivolisäkkeen varastorakkuloista (joka ei liity mihinkään ärsykkeeseen) (jolle on ominaista SIADH) ja lopulta vasopressiinivarastojen tyhjentymisellä (pysyvällä DI:llä) (43). Potilaallamme on todennäköistä, että kolmannessa vaiheessa vasopressiinin vapautumisen osmolaliteettivasteen puute paljastuu SIADH:n hävittyä, eikä niinkään vasopressiinin absoluuttinen ehtyminen.
ADI:n liitännäiskomplikaatiot
Vähäisissä tapausselostuksissa on kuvattu lämmönsäätelyhäiriöitä. Panhypopituitarismia on raportoitu vain kraniofaryngiomatapauksissa ja aivolisäkekasvaintapauksissa, eikä sitä esiintynyt potilaallamme.
Vaikkei sitä olekaan johdonmukaisesti raportoitu, muita tärkeitä hypernatremian komplikaatioita ovat muun muassa syvät laskimotromboosit, minkä vuoksi matalamolekyylipainoinen hepariini voi olla indikoitua akuutin sairastumisen ja immobilisaation aikana (18).
Hypotalamuksellista liikalihavuutta ja uniapneataajuutta on raportoitu niin ikään tavallisesti (18). Eräässä tapaussarjassa (13), jossa arvioitiin AVP-vastetta hypotensioon, todettiin, että kraniofaryngioomia sairastavilla potilailla oli myös baro-reguloidun AVP-vasteen menetys. Näillä potilailla oli viitteitä panhypopituitarismista, mikä viittaa siihen, että heidän kasvaimiensa leikkaus oli jättänyt laajempia vaurioita aivolisäkkeeseen, mukaan lukien aivolisäkkeen takaosaan, joka on AVP:n erityksen viimeinen yhteinen reitti.
Aivolisäkkeen ADI-oireyhtymän hoitokäytännöt
Näiden tapausten hoitoa on kuvattu (15, 18). Potilaan ja perheen valistaminen vesitasapainon ja hallinnan periaatteista on ratkaisevan tärkeää. Vedensaanti voidaan vahvistaa 1,5-2 litraan vuorokaudessa, minkä jälkeen suoritetaan desmopressiinin titraus. Päivittäinen painonseuranta on hyödyllistä nestehukan tai nesteen ylikuormituksen havaitsemiseksi. On suositeltavaa tehdä viikoittaiset plasman natriumpitoisuudet vaihteluiden seuraamiseksi. Tiukasta seurannasta huolimatta plasman natriumpitoisuuksien ympärivuorokautista kontrollia, joka jäljittelisi fysiologista osmoregulaatiota, on vaikea saada aikaan. Natriumpitoisuuksien nopeiden vaihteluiden riskin ja matalalla viitealueella ilmenevien hyponatremian oireiden vuoksi on suositeltavaa pitää natriumpitoisuudet korkeammalla viitealueella.
Desmopressiini, AVP:n synteettinen analogi, otettiin ensimmäisen kerran käyttöön DI:n hoidossa vuonna 1972 (44). Useimmat potilaat pärjäävät hyvin pienillä desmopressiiniannoksilla, joita annetaan kahdesti päivässä. Tasapaino on hieno, ja natriumpitoisuudet voivat heilahtaa hyvin alhaisille tasoille pienillä annoserotuksilla.
Potilaamme pärjäsi hyvin hyvin hyvin hyvin pienillä parenteraalisesti annostelluilla annoksilla, joiden biologisen hyötyosuuden vaihtelu on tunnetusti vähäisintä (45). Intranasaalisten valmisteiden imeytyminen on hyvin vaihtelevaa erityisesti lapsilla tai aikuisilla, joilla on kognitiivisia ongelmia, koska he eivät välttämättä hengitä liuosta johdonmukaisesti (46, 47). Suun kautta otettavat formulaatiot ovat hyvä vaihtoehto, sillä annoksen suurentaminen johtaa pidempään vaikutusaikaan, mutta sillä ei ole huippuvaikutusta (48-50). Kokeilimme tätä muotoa vaihtelevina 50-100 mcg:n annoksina, mutta havaitsimme, että tämän formulaation vaikutukset vaihtelivat huomattavasti päivittäin. Kielensisäinen desmopressiini (Minirin Melt) on ollut saatavilla vuodesta 2005 lähtien. Farmakologiset tutkimukset ovat osoittaneet, että sublingvaalisen reitin biologinen hyötyosuus on ~60 % suurempi kuin oraalisen reitin (49, 50). Sublinguaalisen desmopressiinin hienostuneet annokset voitaisiin saavuttaa leikkaamalla kukin 60 mcg:n tabletti, jolloin annosta voitaisiin säätää 65-90 mcg sublinguaalisesti. Tällaisten jaettujen tablettien samanlainen farmakokineettinen profiili on kuvattu (51). Samanaikaisen ruoan nauttimisen tiedetään vähentävän imeytymisnopeutta ja -laajuutta 40 %, joten on parasta välttää ruoan nauttimista tunnin sisällä ennen ja jälkeen sublingvaalisten desmopressiinitablettien antamisen. Hiljattain on kuvattu yksityiskohtainen nesteenantoprotokolla ja päivittäinen natriuminseuranta kiinteän annoksen ihonalaisella desmopressiinilla (28), mikä osoittaa päivittäisen seurannan vaikeuden. Toisessa hiljattain julkaistussa tapauskertomuksessa (27) on myös raportoitu, että ADI:n hoitoon on käytetty sublingvaalista desmopressiinimuotoa annoksina 60 ja 120 mcg vuorokaudessa. Sublingvaalisen desmopressiinin käyttö voi olla hyödyllinen vaihtoehto tapauksissa, joissa optimaalista vaikutusta ei voida saavuttaa muilla valmisteilla. Nämä potilaat vaativat päivittäisen painon, virtsamäärän ja nesteen saannin tiukkaa seurantaa ympäri vuorokauden. Ottaen huomioon kognitiiviset ja muistihäiriöt, joita näillä potilailla yleensä on, he tarvitsevat yleensä hoitajan valvomaan nesteen saantia varmistaakseen, että he juovat vaaditun määrän.
Tapaustutkimuksessamme ADI:n remissio oli tapahtunut kuudella potilaalla, joista kahdella liittyi ACOM-aneurysmaan (15, 16) ja neljällä kraniofaryngioomaan (15, 26). Yhdellä neurosarkoidoosia sairastavalla potilaalla infliksimabihoito johti remissioon (39). Tällaiset havainnot saattavat viitata siihen, että sekä janoa säätelevät osmoreseptorit että niiden efferentit radat osoittavat enemmän neuroplastisuutta kuin AVP:n tuotantoa säätelevät radat (26).
Johtopäätös
ADI on erittäin harvinainen hypotalamuksen häiriöiden komplikaatio, joka johtaa janokeskuksen toiminnan menetykseen. Janokeskuksen hierarkkisen ohjauksen vuoksi janon puuttumiseen liittyy myös vasopressiinisäätelyn menetys ja polyuria. ADI:stä kärsiviä henkilöitä on hoidettava hienovaraisesti pienillä desmopressiiniannoksilla ja nestetasapainolla. Nykyisillä seurannan ja yksilöllisen hoidon lähestymistavoilla ei ole vielä mahdollista jäljitellä kellon ympäri tapahtuvaa kvasifysiologista osmoregulaatiota.
Tietojen saatavuus
Kaikki tätä tutkimusta varten tuotetut tietokokonaisuudet sisältyvät käsikirjoitukseen/täydentäviin tiedostoihin.
Eettiset lausunnot
Henkilö(i)ltä/-henkilöiltä saatiin kirjallinen tietoisen suostumuksen antaminen tähän artikkeliin sisältyvien, potentiaalisesti yksilöitävissä olleiden kuvien tai tietojen julkaisemiseen.
Osallistumislupa
Olemme saaneet potilaan lähiomaisilta kirjallisen luvan tämän käsikirjoituksen kirjoittamiseen ja julkaisemiseen.
Tekijöiden panos
RD oli ensisijainen endokrinologi, joka hoiti potilaan nestetasapainoa, ideoi idean, kirjoitti käsikirjoituksen, teki kirjallisuuskatsauksen, hankki tiedot, kirjoitti ja tarkisti lopullisen käsikirjoituksen. HC, AC ja JH olivat tämän potilaan hoitoon osallistuneita erikoislääkäreitä ja tarkistivat lopullisen käsikirjoituksen. HT oli tämän potilaan tehohoitovaiheen aikana vastuussa oleva anestesiologi, ideoi idean ja arvioi lopullisen käsikirjoituksen kriittisesti. KC oli potilaan päävastuullinen kuntoutusasiantuntija, hän ideoi idean ja arvioi lopullisen käsikirjoituksen kriittisesti. BB ideoi idean ja arvioi kriittisesti lopullisen käsikirjoituksen.
Rahoitus
RD:tä tukivat osittain kansallisen lääketieteellisen tutkimusneuvoston keskusapuraha (NMRC/CG/017/2013) ja kansallisen lääketieteellisen tutkimusneuvoston Clinician Scientist Award (MOH-CSAINV17nov-0006).
Conflict of Interest Statement
Tekijät ilmoittavat, että tutkimus suoritettiin ilman kaupallisia tai taloudellisia suhteita, jotka voitaisiin tulkita mahdolliseksi eturistiriidaksi.
Kiitokset
Kiitokset
Kiitämme potilasta ja hänen vanhempiaan siitä, että he ovat antaneet meille luvan kirjoittaa ja julkaista tämän käsikirjoituksen.
1. Eisenberg Y, Frohman LA. Adipsinen diabetes insipidus: katsaus. Endocr Pract. (2016) 22:76-83. doi: 10.4158/EP15940.RA
PubMed Tiivistelmä | CrossRef Full Text | Google Scholar
2. Robertson GL. Janon säätelyn poikkeavuudet. Kidney Int. (1984) 25:460-9. doi: 10.1038/ki.1984.39
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Spetzler RF, Martin NA. Arteriovenoosisten epämuodostumien ehdotettu luokitusjärjestelmä. J Neurosurg. (1986) 65:476-83. doi: 10.3171/jns.1986.65.4.0476
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Verenkiertohäiriöt. Ellens NR, Figueroa BE, Clark JC. Barbituraatin aiheuttaman kooman käyttö aivoverisuonten neurokirurgisten toimenpiteiden aikana: kirjallisuuskatsaus. Brain Circ. (2015) 1:140-6. doi: 10.4103/2394-8108.172887
CrossRef Full Text | Google Scholar
5. Aivoverenkiertohäiriöt. Zimmerman CA, Huey EL, Ahn JS, Beutler LR, Tan CL, Kosar S, et al. A gut-to-brain signal of fluid osmolarity controls thirst satiation. Nature. (2019) 568:98-102. doi: 10.1038/s41586-019-1066-x
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Jano. Augustine V, Gokce SK, Lee S, Wang B, Davidson TJ, Reimann F, et al. Hierarkkinen hermoarkkitehtuuri janonsäätelyn taustalla. Nature. (2018) 555:204-9. doi: 10.1038/nature25488
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Bichet DG. Janon ja vasopressiinin vapautumisen säätely. Annu Rev Physiol. (2019) 81:359-73. doi: 10.1146/annurev-physiol-020518-114556
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Fysiologian laitos. McKinley MJ, Denton DA, Ryan PJ, Yao ST, Stefanidis A, Oldfield BJ. Aistinvaraisista kehäelimistä aivokuorelle: janoa ja nälkää ohjaavat hermoradat. J Neuroendocrinol. (2019) 31:e12689. doi: 10.1111/jne.12689
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Johtopäätökset. McKinley MJ, Yao ST, Uschakov A, McAllen RM, Rundgren M, Martelli D. Median preoptic nucleus: kehon nesteen, natriumin, lämpötilan, unen ja kardiovaskulaarisen homeostaasin säätelyn eturintamassa. Acta Physiol. (2015) 214:8-32. doi: 10.1111/apha.12487
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Fysioterapia. Hiyama TY, Matsuda S, Fujikawa A, Matsumoto M, Watanabe E, Kajiwara H, et al. Autoimmuniteetti aivojen natriumtason sensorille aiheuttaa essentiaalista hypernatremiaa. Neuron. (2010) 66:508-22. doi: 10.1016/j.neuron.2010.04.017
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Johtopäätökset ja suositukset. Baylis PH, Thompson CJ. Vasopressiinin erityksen ja janon osmoregulaatio terveydessä ja sairaudessa. Clin Endocrinol. (1998) 29:549-76. doi: 10.1111/j.1365-2265.1988.tb03704.x
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Gizowski C, Bourque CW. Homeostaattisen ja ennakoivan janon hermostollinen perusta. Nat Rev Nephrol. (2018) 14:11-25. doi: 10.1038/nrneph.2017.149
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Smith D, McKenna K, Moore K, Tormey W, Finucane J, Phillips J, et al. Vasopressiinin vapautumisen baroregulaatio adipsic diabetes insipiduksessa. J Clin Endocrinol Metab. (2002) 87:4564-8. doi: 10.1210/jc.2002-020090
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Johtopäätökset. Jung HJ, Kwon TH. Akvaporin-2:n säätelevät molekyylimekanismit munuaisten keräyskanavassa. Am J Physiol Renal Physiol. (2016) 311:F1318-28. doi: 10.1152/ajprenal.00485.2016
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Cuesta M, Gupta S, Salehmohamed R, Dineen R, Hannon MJ, Tormey W, et al. Heterogenous patterns of recovery of thirst in adult patients with adipsic diabetes insipidus. QJM. (2016) 109:303-8. doi: 10.1093/qjmed/hcv175
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Ks. esim. Imai E, Kaneko S, Tsukamoto Y. Munuaisten kompensoiva sopeutuminen vedenkäsittelyyn potilaalla, jolla on adipsinen diabetes insipidus etummaisen kommunikoivan valtimon repeytyneen aneurysman leikkauksen jälkeen. Clin Nephrol. (2017) 88:112-6. doi: 10.5414/CN108963
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Millaisia tuloksia on saatu? McIver B, Connacher A, Whittle I, Baylis P, Thompson C. Adipsic hypothalamic diabetes insipidus anterior communicating artery aneurysman leikkauksen jälkeen. BMJ. (1991) 303:1465-7. doi: 10.1136/bmj.303.6815.1465
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Vrt. Ball SG, Vaidya B, Bayliss PH. Hypotalamuksen adipsinen oireyhtymä: diagnoosi ja hoito. Clin Endocrinol. (1997) 47:405-9. doi: 10.1046/j.1365-2265.1997.2591079.x
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Nguyen BN, Yablon SA, Chen CY. Hypodipsinen hypernatremia ja diabetes insipidus etummaisen viestivaltimon aneurysman leikkauksen jälkeen: diagnostiset ja terapeuttiset haasteet amnestisella kuntoutuspotilaalla. Brain Injury. (2001) 15:975-80. doi: 10.1080/02699050110063459
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Aivoverenkierto. Nussey SS, Ang VT, Jenkins JS. Krooninen hypernatremia ja hypotermia subaraknoidaalivuodon jälkeen. Postgrad Med J. (1986) 62:467-741. doi: 10.1136/pgmj.62.728.467
CrossRef Full Text | Google Scholar
21. Spiro SG, Jenkins JS. Adipsia ja hypotermia subaraknoidaalivuodon jälkeen. BMJ. (1971) 3:411-2. doi: 10.1136/bmj.3.5771.411
CrossRef Full Text | Google Scholar
22. Crowley RK, Sherlock M, Agha D, Smith D, Thompson CJ. Kliinisiä oivalluksia adipsic diabetes insipiduksesta: laaja tapaussarja. Clin Endocrinol. (2007) 66:475-82. doi: 10.1111/j.1365-2265.2007.02754.x
PubMed Abstract | Ristiintaulukoitu kokoteksti | Google Scholar
23. Colleran K, Sanchez-Goettler L, Sloan A. Hypotalamuksen liikalihavuus, jota komplisoi adipsinen sentraalinen diabetes insipidus kraniofaryngioman kirurgisen resektion jälkeen. J Clin Hypertens. (2009) 11:608-10. doi: 10.1111/j.1751-7176.2009.00057.x
PubMed Abstract | CrossRef Full Text | Google Scholar
24. J. Hyper Hyper Hyperia. Zantut-Wittmann D, Garmes HM, Panzan AD, Lima Mde O, Baptista MT. Vakava rabdomyolyysi johtuen adipsisesta hypernatremiasta kraniopharyngiomaleikkauksen jälkeen. Arq Bras Endocrinol Metabol. (2007) 51:7. doi: 10.1590/S0004-27302007000700023
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Raghunathan V, Dhaliwal MS, Gupta A, Jevalikar G. From cerebral salt wasting to diabetes insipidus with adipsia: tapausraportti lapsesta, jolla on craniopharyngioma. J Pediatr Endocrinol Metab. (2015) 28:323-6. doi: 10.1515/jpem-2014-0224
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Voi olla, ettet ole koskaan kuullut tästä. Sinha A, Ball S, Jenkins A, Hale J, Cheetham T. Objektiivinen arviointi janon palautumisesta potilailla, joilla on adipsinen diabetes insipidus. Pituitary. (2011) 14:307-11. doi: 10.1007/s11102-011-0294-3
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Pérez MA, Millán HA, Naranjo JA, Flórez Romero A. Adipsic diabetes insipidus secondary to craniopharyngioma resection. BMJ Case Rep. (2019) 12:e225903. doi: 10.1136/bcr-2018-225903
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Pabich S, Flynn M, Pelley E. Päivittäinen natriuminseuranta ja nesteen saannin protokolla: toistuvan sairaalahoidon ehkäisy adipsic diabetes insipiduksessa. J Endoc Soc. (2019) 3:882-6. doi: 10.1210/js.2018-00406
PubMed Abstract | CrossRef Full Text | Google Scholar
29. J Endoc Soc (2019) 3:882-6. Pereira MC, Vieira MM, Pereira JS, Salgado D. Adipsia diabetes insipidus -potilaalla. Case Rep Oncol. (2015) 8:385-8. doi: 10.1159/000440611
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Fysioterapia. Zhang Y, Wang D, Feng Y, Zhang W, Zeng X. Juveniili alkava kihti ja adipsinen diabetes insipidus: tapausselostus ja kirjallisuuskatsaus. J Int Med Res. (2018) 46:4829-36. doi: 10.1177/0300060518800114
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Latcha S, Lubetzky M, Weinstein AM. Vaikea hyperosmolariteetti ja hypernatremia adipsisella nuorella naisella. Clin Nephrol. (2011) 76:407-11. doi: 10.5414/CN106617
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Sherlock M, Agha A, Crowley R, Smith D, Thompson CJ. Adipsinen diabetes insipidus makroprolaktinooman aivolisäkeleikkauksen jälkeen. Pituitary. (2006) 9:59-64. doi: 10.1007/s11102-006-8280-x
PubMed Tiivistelmä | CrossRef Full Text | Google Scholar
33. Hiyama TY, Utsunomiya AN, Matsumoto M, Fujikawa A, Lin CH, Hara K, et al. Adipsinen hypernatremia ilman hypotalamuksen vaurioita, joihin liittyy subfornikaalisen elimen autovasta-aineita. Brain Pathol. (2017) 27:323-31. doi: 10.1111/bpa.12409
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Ks. esim. Komatsu H, Miyake H, Kakita S, Ikuta H. Corpus callosumin hypoplasia, johon liittyy adipsinen hypernatremia ja hypotalamuksen hypogonadotropinismi: tapausselostus ja kirjallisuuskatsaus. Pediatr Int. (2001) 43:683-7. doi: 10.1046/j.1442-200X.2001.01453.x
PubMed Abstract | CrossRef Full Text | Google Scholar
35. Johtopäätökset ja tutkimukset. Schaff-Blass E, Robertson GL, Rosenfield RL. Krooninen hypernatremia synnynnäisestä janon ja vasopressiinin osmoregulaation viasta. J Pediatr. (1983) 102:703-8. doi: 10.1016/S0022-3476(83)80237-6
PubMed Abstract | CrossRef Full Text | Google Scholar
36. Fysioterapeuttinen tutkimus. AvRuskin TW, Tang SC, Juan C. Essentiaalinen hypernatremia, antidiureettinen hormoni ja neurohypofysiinin eritys: vaste klorpropamidille. Acta Endocrinol. (1981) 96:145-53. doi: 10.1530/acta.0.0960145
CrossRef Full Text | Google Scholar
37. Ks. esim. Radetti G, Rizza F, Mengarda G, Pittschieler K. Adipsinen hypernatremia kahdella sisaruksella. Am J Dis Child. (1991) 145:321-5. doi: 10.1001/archpedi.1991.02160030091028
PubMed Abstract | CrossRef Full Text | Google Scholar
38. Takeya T, Hamano K, Iwasaki N, Kitazawa R, Tsuji C, Jougamoto M. Kroonisen hypernatremian tapaus, johon liittyy corpus callosum -ageneesi. Nippon Shounikagakkai Zasshi. (1996) 100:1392-5.
Google Scholar
39. O’Reilly MW, Sexton DJ, Dennedy MC, Counihan TJ, Finucane FM, O’Brien T, et al. Radiologinen remissio ja janontuntemuksen palautuminen infliksimabihoidon jälkeen neurosarkoidoosiin sekundaarisesti liittyvässä diabeteksen insipiduksessa. QJM. (2015) 108:657-9. doi: 10.1093/qjmed/hct023
PubMed Abstract | CrossRef Full Text | Google Scholar
40. Duvernoy H, Koritké JG, Monnier G. . Zeitschrift für Zellforschung und mikroskopische Anatomie. (1969) 102:49-77. doi: 10.1007/BF00336416
PubMed Abstract | CrossRef Full Text | Google Scholar
41. Fysiologian laitos. Duvernoy HM, Risold PY. Ympäröivät elimet: vertailevan anatomian ja verisuonituksen atlas. Brain Res Rev. (2007) 56:119-47. doi: 10.1016/j.brainresrev.2007.06.002
PubMed Abstract | CrossRef Full Text | Google Scholar
42. Lindgren A, Vergouwen MD, van der Schaaf I, Algra A, Wermer M, Clarke MJ, et al. Endovascular coiling versus neurosurgical clipping for people with aneurysmal subarachnoid hemorrhage. Cochrane Database Syst Rev. (2018) 8:CD003085. doi: 10.1002/14651858.CD003085.pub3
PubMed Abstract | CrossRef Full Text | Google Scholar
43. Ewout JH, Robert Z. Vesitasapainon häiriöt neurokirurgian jälkeen: kolmiportainen vaste uudelleen tarkasteltuna. NDT Plus. (2010) 3:42-4. doi: 10.1093/ndtplus/sfp117
CrossRef Full Text | Google Scholar
44. Vesi- ja nestehäiriöt. Andersson KE, Arner B. DDAVP:n, vasopressiinin synteettisen analogin, vaikutukset potilailla, joilla on kraniaalinen diabetes insipidus. Acta Med Scand. (1972) 192:21-7. doi: 10.1111/j.0954-6820.1972.tb04772.x
PubMed Abstract | CrossRef Full Text | Google Scholar
45. Rembratt A, Graugaard-Jensen C, Senderovitz T, Norgaard JP, Djurhuus JC. Suun kautta tai suonensisäisesti annostellun desmopressiinin farmakokinetiikka ja farmakodynamiikka päivällä tai yöllä terveillä 55-70-vuotiailla miehillä. Eur J Clin Pharmacol. (2004) 60:397-402. doi: 10.1007/s00228-004-0781-9
PubMed Abstract | CrossRef Full Text | Google Scholar
46. Minkälainen se on? Vande Walle J, Stockner M, Raes A, Nørgaard JP. Desmopressiini 30 vuotta kliinisessä käytössä: turvallisuuskatsaus. Curr Drug Saf. (2007) 2:232-8. doi: 10.2174/157488607781668891
PubMed Abstract | CrossRef Full Text | Google Scholar
47. Ks. Yutaka O, Robertson GL, Nørgaard JP, Juul KV. Neurohypofyysisen diabetes insipiduksen hoito. J Clin Endocrinol Metabol. (2013) 98:3958-67. doi: 10.1210/jc.2013-2326
CrossRef Full Text | Google Scholar
48. Fjellestad-Paulsen A, Höglund P, Lundin S, Paulsen O. 1-deamino-8-D-arginiini vasopressiinin farmakokinetiikka eri antoreittien jälkeen terveillä vapaaehtoisilla. Clin Endocrinol. (1993) 38:177-82. doi: 10.1111/j.1365-2265.1993.tb00990.x
CrossRef Full Text | Google Scholar
49. Ks. esim. Lam KS, Wat MS, Choi KL, Ip TP, Pang RW, Kumana CR. Suun kautta otettavan 1-deamino-8-D-arginiinivasopressiinin farmakokinetiikka, farmakodynamiikka, pitkäaikaisteho ja turvallisuus aikuispotilailla, joilla on sentraalinen diabetes insipidus. Br J Clin Pharmacol. (1996) 42:379-85. doi: 10.1046/j.1365-2125.1996.39914.x
PubMed Abstract | CrossRef Full Text | Google Scholar
50. Steiner IM, Kaehler ST, Sauermann R, Rinosl H, Muller M, Joukhadar C. Desmopressiinin plasman farmakokinetiikka sublingvaalisen annostelun jälkeen: eksploratiivinen annos-eskalaatiotutkimus terveillä miespuolisilla vapaaehtoisilla. Int J Clin Pharmacol Ther. (2006) 44:172-9. doi: 10.5414/CPP44172
PubMed Abstract | CrossRef Full Text | Google Scholar
51. Ks. esim. De Waele K, Cools M, De Guchtenaere A, Van de Walle J, Raes A, Van Aken S, et al. Desmopressiini-lyofilisaatti keskushermostoperäisen diabetes insipiduksen hoitoon: ensimmäiset kokemukset hyvin pienillä imeväisillä. Int J Endocrinol Metab. (2014) 12:e16120. doi: 10.5812/ijem.16120
PubMed Abstract | CrossRef Full Text | Google Scholar
.