- Introduction
- Materiaalit ja menetelmät
- Sisäänottokriteerit
- Munasarjojen stimulaatio ja munasolujen talteenotto
- Embryonsiirtokäytäntö
- Primääriset tulosmittaukset ja tilastollinen analyysi
- Tulokset
- Oosyytti- ja alkionparametrit
- Raskauden tulokset ja kumulatiivinen elävänä syntyneiden määrä (CLBR)
- Keskustelu
- Johtopäätös
- Tietojen saatavuus
- Eettinen lausunto
- Tekijöiden panos
- Rahoitus
- Esintäristiriitoja koskeva lausunto
- Kiitokset
Introduction
Viime aikoina kehitettiin uudenlainen järjestelmä, POSEIDON-kriteerit, luokittelemaan hedelmättömyyspotilaat, joilla on huono ennuste ja jotka ovat menossa ART-hoitoon (assisted reproductive technology) (1). Se on hyödyllinen järjestelmä sellaisten potilaiden tunnistamiseksi ja luokittelemiseksi, joilla on heikentynyt munasarjojen reservi tai huono munasarjavaste (POR), ja se antaa ohjeita näiden potilaiden diagnosointiin ja hoitoon (2). Neljää alaryhmää on ehdotettu määrällisten ja laadullisten parametrien perusteella, mukaan lukien ikä, munasarjojen reservin biomarkkerit ja munasarjavaste. Uudet kriteerit vähentävät merkittävästi Bolognan kriteerit täyttävien potilaiden heterogeenisuutta, koska ne mahdollistavat POR:n yksityiskohtaisemman stratifioinnin (3), mikä voi erottaa POR-potilaiden joukosta potilasryhmiä, jotka voidaan tunnistaa ja jotka voivat hyötyä erityisistä toimenpiteistä (4). Vaikka POSEIDON-kriteerit on laadittu ja joitakin erityisiä hoitosuosituksia ehdotettu tiettyjä potilasalaryhmiä varten (5), ei ole vielä riittävästi näyttöä POSEIDON-kriteereissä käytettyjen parametrien pätevyydestä eikä eri alaryhmien lopputulosten arvioinnista.
POSEIDON-kriteereihin perustuvista neljästä ryhmästä ryhmä 1 on epäilemättä paras ennustearvioinen ryhmä, kun otetaan huomioon niiden nuorempi ikä ja normaali munasarjojen reservi, kun taas ryhmässä 4 on huonoin ennuste pitkälle vietyjen ikävuosien ja munasarjojen heikentyneen reservin vuoksi. Mielenkiintoinen kysymys on kuitenkin se, kumman raskaustulos on parempi, iäkkäiden naisten (ryhmä 2), joilla on normaali munasarjojen reservi, vai nuorten naisten (ryhmä 3), joilla on heikentynyt munasarjojen reservi. Kumulatiivista elävänä syntyneiden määrää (CLBR, cumulative live birth rate) pidetään parempana IVF-hoidon onnistumisen mittarina (6). Tähän mennessä POSEIDON-kriteerien määrittelemien neljän potilasryhmän CLBR-arvoista on raportoitu hyvin vähän.
Potilaiden ominaisuuksien ja ennusteen perusteella olisi kehitettävä kliinisiä hoitostrategioita. Tämän tutkimuksen tavoitteena on luonnehtia heikon ennusteen potilaita hoitopäätösten tekemisen helpottamiseksi. Tässä tutkimuksessa analysoitiin POSEIDON-kriteerien mukaan määriteltyjen potilasryhmien perusominaisuuksia ja tuloksia, ja yhdestä imettyyn in vitro -hedelmöityshoitoon (IVF)/intrasytoplasmaattiseen sperman injektioon (ICSI) perustuvasta syklistä johtuvaa CLBR:ää ehdotettiin ensisijaiseksi lopputuloksen mittariksi IVF-hoitoa saaville matalan ennusteen potilaille (7).
Materiaalit ja menetelmät
Tämä retrospektiivinen tutkimus sisälsi 18 455 tuoretta imettyä IVF-sykliä, joihin liittyi myöhempi pakastetun alkion siirto tammikuusta 2014 tammikuuhun 2017 meidän keskuksessamme. Elävänä syntyneiden tulosta seurattiin vähintään 2 vuoden ajan tammikuuhun 2019 asti. Tutkimus hyväksyttiin Northwest Women’s and Children’s Hospitalin ihmisen avustetun lisääntymisteknologian kliinisen soveltamisen eettisessä komiteassa (nro 2018002). Eettinen komitea hyväksyi tämän tutkimuksen, jossa luovuttiin tietoon perustuvan suostumuksen hankkimisesta. Kaikki tutkimus suoritettiin asiaankuuluvien ohjeiden ja määräysten mukaisesti.
Sisäänottokriteerit
Potilaat luokiteltiin POSEIDON-kriteerien mukaisesti:
Matalan ennusteen potilaat
Ryhmä 1 (n = 879 sykliä): Ikä < 35, antraalinen follikkeliluku (AFC) ≥ 5, edellisessä syklissä otettujen munasolujen määrä ≤ 9;
Ryhmä 2 (n = 482 sykliä): Ikä ≥ 35, AFC≥5, edellisessä syklissä otettujen munasolujen määrä ≤ 9;
Ryhmä 3 (n = 858 sykliä): Ikä < 35, AFC < 5;
Ryhmä 4 (n = 1 306 sykliä): Ryhmä 5 (n = 664 sykliä): Ikä ≥ 35, AFC < 5;
Potilaat, joilla ei ole huonoa ennustetta
Ryhmä 5 (n = 664 sykliä):
Ryhmä 6 (n = 13708 sykliä): AFC ≥ 5, aiempi munasarjojen stimulaatio > 9 munasolua;
Ryhmä 6 (n = 13708 sykliä): AFC ≥ 5, ei aiempaa munasarjojen stimulaatiota.
Virtauskaavio ja tietojenkäsittelymenettely on lueteltu kuvassa 1. Potilaiden demografiset tiedot ja perusominaisuudet on esitetty taulukossa 1.
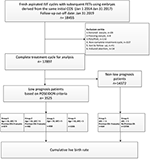
KUVIO 1. Potilaiden demografiset tiedot ja perusominaisuudet. Virtauskaavio ja tietojen käsittely.
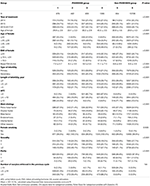
TAULUKKO 1. Demografiset tiedot ja perusominaisuudet.
Munasarjojen stimulaatio ja munasolujen talteenotto
Munasarjojen stimulaation (OS) protokolla määritettiin yksilöllisesti naisen iän, painoindeksin (Body Mass Index, BMI), follikkelia stimuloivan hormonin (FSH) basaalitason (Basal Follicle Stimulating Hormone, FSH) ja antraalisten follikkelien lukumäärän (Antral Follicle Count, AFC) mukaan. 94,33 prosenttia IVF-potilaista sai rekombinantti- ja/tai virtsagonadotropiinia (rFSH/hMG) GnRH-agonistiprotokollassa tai GnRH-antagonistiprotokollassa, jota seurasi IVF tai ICSI. Naisille, joilla oli heikentynyt munasarjojen reservi, käytettiin lievää stimulaatioprotokollaa tai luteaalivaiheen munasarjojen stimulaatiota tai luonnollista kiertoa. Ihmisen vaihdevuosien gonadotropiinia (hMG, Li Zhu, Kiina) lisättiin lievään ovulaatioprotokollaan tai Shanghain protokollaan potilaiden stimulaatiovasteen mukaan. Ihmisen koriongonadotropiinia (hCG) 4 000-10 000 IU tai rekombinanttia hCG:tä (r-hCG, MerckSerono S.p.A.) 250μg annettiin, kun 2-3 follikkelia oli vähintään 17 mm:n kokoisia. Kolmekymmentäkuusi tuntia myöhemmin munasolujen talteenotto suoritettiin transvaginaalisella ultraäänitutkimuksella ohjatulla aspiraatiolla. Kunkin ryhmän munasarjojen stimulaatioparametrit on lueteltu taulukossa 2.

TAULUKKO 2. Munasarjojen stimulaatioparametrit.
Embryonsiirtokäytäntö
Oosyyttien käsittely- ja alkionkehitysmenettelyt sekä alkioiden pisteytysjärjestelmä on kuvattu aiemmissa artikkeleissamme (8, 9). Kolmannen päivän 1-3 luokan alkioita pidettiin käyttökelpoisina alkioina, ja 1-2 luokan alkioita pidettiin hyvälaatuisina alkioina. Kaikki tuoreiden alkioiden siirrot (ET) tehtiin päivänä 3 tai päivänä 5. Tapauksissa, joissa oli riittävä määrä (≥ 3-4) hyvälaatuisia alkioita kolmantena päivänä, käytettiin blastokystansiirtoa viidentenä päivänä. Siirrettyjen alkioiden lisäksi potilaiden ylimääräiset alkiot lasitettiin päivänä 3 tai blastokystavaiheessa (päivä 5-6). Luokan 1-3 hajautumisvaiheen alkiot päivänä 3 ja blastokystat, joiden Gardner-pisteet olivat yli 4CC, kryosäilytettiin (Cryo-top, avoin järjestelmä, Kuwayama). Menetelmät ja pakastetun ET:n menettely on esitetty yksityiskohtaisesti ryhmämme aiemmassa verifiointitutkimuksessa (8, 9). Jos implantaatio epäonnistui tuoreessa syklissä, jäädytetty alkionsiirto (FET) suoritettiin käyttämällä jäljellä olevia lasitettuja alkioita tai blastokystia. Alle 35-vuotiaita potilaita, joilla oli hyvälaatuisia alkioita, kannustettiin tekemään yhden alkion siirto. Yhden alkion siirtokäytäntöä sovellettiin myös potilaisiin, joilla oli epänormaali kohtu (esim. arpeutunut kohtu, kohdun epämuodostuma) ja/tai muut tapaukset, jotka olivat ristiriidassa kaksosraskauden kanssa. Progesteronin lihaksensisäistä injektiota (60 mg/vrk) annettiin luteaalivaiheen tukemiseksi munasolujen talteenottopäivästä alkaen negatiiviseen seerumin beeta-hCG-arvoon tai 8. raskausviikkoon asti.
Primääriset tulosmittaukset ja tilastollinen analyysi
Primäärinen tulos oli kumulatiivinen elävänä syntynyt lapsi (CLB, cumulative live birth), joka määriteltiin siten, että vähintään yksi elävänä syntynyt lapsi oli tulosta yhdestä imetyksestä toteutetusta ART-ohjelmakierroksen tuoreesta ET-ohjelmakierroksen kierroksesta (fresh ET) tai sitä seuranneesta FET-ohjelmaan (FET = fetaalinen hedelmöityshoitokierroksen kierrokseen perustuvasta elävänä syntyneestä lapsesta), joka oli suhteutettu haettujen munasolujen lukuun. CLBR-laskennan osoittaja oli FET:ssä saavutettujen elävänä syntyneiden ja tuoreissa sykleissä saatujen elävänä syntyneiden synnytysten summa. Vain ensimmäinen synnytys laskettiin mukaan analyysiin, jos potilas sai useita synnytyksiä. CLBR määriteltiin kumulatiivisena elävänä syntymänä transvaginaalista munasolunäytteenottoa kohti terminologisen määritelmän mukaisesti (7, 10) Yksi hoitosykli määriteltiin munasolunäytteenotoksi. Yhdellä täydellisellä hoitosyklillä tarkoitettiin hoitosykliä, jossa saavutettiin elävänä syntyminen, tai hoitosykliä, jossa ei saavutettu elävänä syntymistä kaikilla siirretyillä alkioilla. Kumulatiivinen elävänä syntyneiden määrä tässä tutkimuksessa laskettiin täydellisen hoitosyklin perusteella, joten potilaat (n = 337), joiden hoito ei ollut täydellinen, jätettiin pois.
Tietojen käsittely ja tilastollinen analyysi suoritettiin EmpowerStats-ohjelmistolla (www.empowerstats.com) ja tilastollisilla ohjelmistopaketeilla R. CLBR:n todennäköisyyssuhteen (OR) arvioimiseksi eri potilasryhmissä laadittiin monimuuttujainen regressiomalli, jossa muuttujina olivat mahdolliset sekoittavat tekijät ja joka oli mukautettu hoitovuoden, naisen BMI:n, lapsettomuustyypin, lapsettomuuden keston, raskausajan, pariteetin, pääasiallisen etiologian, OS-protokollan, gonadotropiinityypin ja FSH:n aloitusannoksen suhteen. Potilaita otettiin mukaan 3 vuoden ajan, jonka aikana IVF-menettelyä tarkistettiin. Tämän tekijän aiheuttaman harhan poistamiseksi kumulatiivinen elävänä syntyneiden määrä oikaistiin hoitovuoden mukaan. Naisen BMI, lapsettomuustyyppi, lapsettomuuden kesto, graviditeetti, pariteetti ja pääasiallinen etiologia olivat tärkeitä raskauteen ja elävänä syntymiseen vaikuttavia tekijöitä kokemuksen tai kirjallisuuden perusteella. OS-protokolla, gonadotropiinityyppi ja FSH:n aloitusannos ovat keskeisiä indikaattoreita, jotka vaikuttavat talteen otettujen munasolujen määrään ja viime kädessä elävänä syntyneiden kumulatiiviseen mahdollisuuteen.
Tulokset
Oosyytti- ja alkionparametrit

Taulukko 3. Hoitotapahtuman tulokset. Oosyyttien ja alkioiden parametrit ja CLBR:t.
Raskauden tulokset ja kumulatiivinen elävänä syntyneiden määrä (CLBR)
Epäjohdonmukaisesti munasolujen ja alkioiden lukumäärän jakaantumismallin kanssa ryhmittäin CLBR:t suurimmasta pienimpään järjestyksessä olivat 44.6 % ryhmässä 1 (n = 879), 35,5 % ryhmässä 3 (n = 858), 24,5 % ryhmässä 2 (n = 482) ja 12,7 % ryhmässä 4 (n = 1306). Monimuuttujainen regressioanalyysi tehtiin taulukoissa 1 ja 2 kuvattujen, mahdollisesti sekoittavina tekijöinä toimivien muuttujien kanssa. Taulukossa 4 esitetään CLBR:n oikaistut kertoimisuhteet (OR) ja niiden 95 prosentin luottamusvälit (CI). Sopeuttamattomien tulosten suuntauksen mukaisesti CLBR oli ryhmässä 3 (OR 0,9, 95 % CI 0,7-1,2, p = 0,615) hieman alhaisempi ja ryhmässä 5 (OR 1,3, 95 % CI 0,9-1,7, p = 0,111) hieman korkeampi kuin CLBR ryhmässä 1 ilman merkittävää tilastollista eroa. CLBR ryhmässä 2 oli merkittävästi alhaisempi kuin ryhmässä 1 (OR 0,6, 95 % CI 0,4-0,8, p = 0,004) ja CLBR ryhmässä 4 oli alhaisin (OR 0,4, 95 % CI 0,3-0,6, p < 0,001) verrattuna ryhmään 1. Taulukossa 5 on esitetty raskaustulokset tuoresiirtoa tai FET:tä kohti matalan ennusteen potilailla. Iäkkäiden ryhmien (ryhmä 2 ja ryhmä 4) implantaatioluvut olivat merkitsevästi alhaisemmat kuin nuorten ryhmien (ryhmä 1 ja ryhmä 3).

TAULUKKO 4. Logistinen regressioanalyysi CLBR:n osalta.

TAULUKKO 5. Raskaustulokset siirtoa kohden sekä tuore- että pakastetun alkion siirtoa kohden matalan ennusteen potilailla.
Kuvio 2 osoitti keskeisten tapahtumien trendikaavion matalan ennusteen potilailla. Trendiviivat risteilivät ryhmän 2 ja ryhmän 3 välillä alkionsiirron jälkeen. Ryhmän 2 potilailla (ikä ≥ 35 vuotta; AFC ≥ 5) oli korkeampi AFC, enemmän talteen otettuja munasoluja, enemmän alkioita ja enemmän hyvälaatuisia alkioita, mutta implantoitumisaste ja CLBR laskivat. Päinvastoin, vaikka ryhmän 3 (ikä < 35; AFC < 5) potilailla oli vähemmän munasoluja ja alkioita, CLBR osoittautui korkeammaksi kuin ryhmässä 2. SWOT-analyysi POSEIDON-kriteerien mukaan määritellyistä huono-ennusteisten potilaiden neljästä ryhmästä on esitetty kuviossa 3.
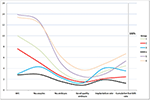
KUVIO 2. Potilaiden SWOT-analyysi. Keskeisten tapahtumien trendikaavio matalan ennusteen potilailla. Trendiviivat risteävät ryhmän 2 (punainen) ja ryhmän 3 (sininen) välillä alkionsiirron jälkeen. X-akseli kuvaa keskimääräistä AFC:n lukumäärää, munasolujen lukumäärää, alkioiden lukumäärää, hyvälaatuisten alkioiden lukumäärää, implantaatioprosenttia ja kumulatiivisen elävänä syntyneen lapsen lukumäärää. Vasemmalla oleva Y-akseli edustaa neljän ensimmäisen muuttujan lukumäärää (n) ja oikealla oleva Y-akseli edustaa kahden viimeisen muuttujan osuutta (%).

KUVIO3. SWOT-analyysi POSEIDON-kriteerien mukaan määriteltyjen heikon ennusteen potilaiden neljästä ryhmästä.
Keskustelu
Tämän POSEIDON-kriteerien mukaan määritellyssä populaatiossa tehdyn retrospektiivisen tutkimuksen pääasiallinen havainto oli se, että CLBR oli korkein ryhmässä 1, seuraavaksi korkein ryhmässä 3 ja ryhmässä 2 ja alhaisin ryhmässä 4. Tulostemme mukaan CLBR oli nuorilla naisilla, joilla oli huono munasarjojen reservi (ryhmä 3), hieman alhaisempi kuin nuorilla naisilla, joilla oli hyvä munasarjojen reservi ja aiempi matala vaste (ryhmä 1). Vaikka ryhmään 2 kuuluvilla potilailla (ikä ≥ 35; AFC ≥ 5) oli parempi munasarjojen reservi, enemmän munasoluja ja enemmän alkioita, CLBR ja implantaatioprosentti olivat päinvastoin alhaisemmat kuin ryhmään 3 kuuluvilla potilailla, joilla oli huonompi munasarjojen reservi, vähemmän munasoluja ja vähemmän alkioita. Tämä havainto voi helpottaa hoitostrategioiden kehittämistä heikon ennusteen potilaille.
Innovatiivisilla POSEIDON-kriteereillä pyritään tunnistamaan ja osittamaan heikon ennusteen potilaat neljään eri ryhmään naisen iän, AFC:n ja edellisen kierron munasarjavasteen perusteella (4). Ryhmän 2 potilaille oli ominaista hyvä munasarjojen reservi ja korkea ikä, aivan päinvastoin kuin ryhmän 3 potilaille, joilla oli huono munasarjojen reservi mutta jotka olivat nuorempia. Tutkimukset (11-13) ovat osoittaneet, että CLBR lisääntyy talteen otettujen munasolujen määrän kasvaessa myös korkean iän omaavilla naisilla (14). On ehdotettu, että otettujen munasolujen määrä on erittäin tärkeä muuttuja, joka liittyy itsenäisesti CLBR:ään. Ryhmän 2 potilailla, joilla oli enemmän munasoluja, odotettiin olevan parempi ennuste kuin ryhmän 3 potilailla, koska ryhmän 2 potilailla oli enemmän siirrettäviä alkioita. CLBR ja implantaatioprosentti olivat kuitenkin päinvastoin korkeammat ryhmässä 2 kuin ryhmässä 3.
Tuloksemme ovat yhdenmukaisia aiempien tutkimusten (15, 16) kanssa, jotka koskivat munasarjojen reservin ja raskaustuloksen yhteyttä. Chang ym. (15) havaitsivat, että normaalin hedelmöittymisen, jakautumisen, korkealaatuisten alkioiden, implantaation ja raskauden osuus oli alhaisempi iäkkäillä naisilla kuin nuoremmilla naisilla, joiden munasarjojen reservi oli heikentynyt. Ensisijainen syy oli ikääntyvän munasolun haitallinen vaikutus raskaustulokseen (alhainen implantaatioprosentti ja korkea raskaudenkeskeytysprosentti), joka johtui kromosomipoikkeavuuksista (17) ja sytoplasman toimintahäiriöistä (18). Hedelmällisyyden heikkeneminen ikääntymisen myötä liittyy sekä munasolujen määrään että laatuun. Implantoituminen ja keskenmenot liittyvät munasolujen laatuun, mutta eivät välttämättä munasarjojen reserviin (16). Ryhmän 2 munasarjojen reilu reservi lisäisi mahdollisuutta saada enemmän munasoluja ja alkioita siirrettäväksi, mutta samalla korkeampi aneuploidiaprosentti johtaisi matalaan implantaatioprosenttiin ja korkeaan keskenmenoprosenttiin.
Ryhmään 2 kuuluvien potilaiden hoidossa olisi kiinnitettävä enemmän huomiota strategioiden kehittämiseen munasolujen laadun parantamiseksi eikä niinkään munasolujen määrän tai alkioiden määrän parantamiseksi. Koska ryhmässä 2 saavutetaan enemmän alkioita kolmantena päivänä, alkioiden viljely blastokystavaiheeseen siirtoa varten on hyvä vaihtoehto. Päivän 5-6 alkioiden segmentaalisen aneuploidian osuus on alhaisempi (19) ja niiden elinkelpoisuus implantaation kannalta parempi (20) kuin päivän 2-3 alkioiden. Myös aneuploidian preimplantaatiogeneettinen testaus (PGT-A) on edistyneille naisille hyödyllinen keino valita euploidinen alkio siirrettäväksi (21). Optimaalinen munasarjojen stimulaatiohoito munasolujen laadun parantamiseksi (22, 23) voisi olla vaihtoehtoinen vaihtoehto. Lisäravinteita, kuten dehydroepiandrosteronia, on kokeiltu parantamaan follikkelien kehittymistä (24), vaikka niiden käytöstä näillä potilailla ei ole riittävästi näyttöä.
Ryhmän 3 potilailla (ikä < 35; AFC < 5) oli huono munasarjojen reservi, ja heidän odotettiin reagoivan huonosti ja heidän raskaustuloksensa oli huono. Mielenkiintoista oli, että ryhmässä 3 munasolujen tuottoprosentti (145,3 % talteen otetuista munasoluista AFC:tä kohti) oli merkittävästi korkeampi kuin muissa ryhmissä, vaikka FSH:n aloitusannosta ei lisätty merkittävästi (taulukko 2). Tämä viittasi siihen, että antraalifollikkelien vaste gonadotropiinille on saattanut saavuttaa toimintakykynsä rajan, joten päivittäisten gonadotropiiniannosten lisäämisestä ei ole lisähyötyä munasolujen määrään (25). Munasarjojen herkkyyden arviointi FSH:lle on keskeinen tekijä IVF:n onnistumisprosentin parantamisessa näillä heikon ennusteen potilailla ja uusien hoitonäkymien avaamisessa (26). Ryhmän 3 korkea munasolujen määrä AFC:tä kohti tuki myös raportoitua suositusta 300 IU rFSH:n enimmäisvuorokausiannoksesta (5). Ryhmän 3 potilaiden kohdalla olisi keskityttävä enemmän ponnisteluihin munasolujen määrän lisäämiseksi, sillä kliininen raskaustulos rauhoittuu, kun munasoluja on saatu.
Ryhmän 5 potilaat olivat niitä ei-matalan ennusteen potilaita, joilla oli hyvä munasarjavaste (yli 9 munasolua edellisessä noutokierrossa), mutta suurin osa näistä potilaista ei kuitenkaan onnistunut synnyttämään elävää lasta edellisessä IVF-syklissä. Verrattaessa toiseen ei-alhaisen ennusteen potilaaseen, jolla oli ensimmäinen IVF-hoito (ryhmä 6), vaikka ryhmän 5 potilailla oli enemmän AFC:tä ja haettujen munasolujen määrää, alkion kehitys ja raskaustulos olivat huonommat kuin ryhmässä 6. Siksi epäonnistuminen ensimmäisellä IVF-hoidolla potilailla, joilla oli hyvä munasarjavaste, voi olla huono ennuste myöhempää IVF-hoitoa varten.
Lantion ja munanjohtimen välinen tekijä on tavallisin lapsettomuuden syy, ja se on noin 10,8-78,3 %:n osuus hedelmättömistä naisista Kiinass aa (27, 28). Tubaalitekijään liittyy pääasiassa tubusten tukkeutuminen ja vatsakalvon patologia, joka aiheuttaa adheesiota, joka diagnosoitiin hysterosalpingografialla ja laparoskopialla. Emättimen aiheuttaman lapsettomuuden yleisin syy oli lantion tulehdussairaus (PID), salpingiitti ja endometrioosi (29). Tämän tutkimuksen potilasryhmissä tubaalinen tekijä on tärkein lapsettomuuden etiologia, joka vaihteli 62,9-71,4 prosentista, mikä oli korkeampi kuin muiden maiden ja alueiden lapsettomuusnaisilla. Siksi tulosten laajempien vaikutusten tulkinnassa on oltava varovainen.
Rajoitukset liittyvät tutkimuksen retrospektiiviseen luonteeseen, ja se, että tiedot olivat yhdestä keskuksesta, heikentää myös havaintojemme yleispätevyyttä. Muita mahdollisia rajoituksia voi olla se, että ei-GnRH-analogista protokollaa käytettiin joillakin naisilla, joilla oli heikentynyt munasarjojen reservi, eikä niillä, joilla oli normaali munasarjojen reservi. Tuoreet syklit, jotka eivät tuottaneet yhtään munasolua, eivät sisältyneet tähän tutkimukseen, esimerkiksi syklit, joissa munasarjojen stimulaatio oli peruutettu.
Tämän tutkimuksen tulokset voivat tarjota uusia näkemyksiä matalan ennusteen potilaiden hoitostrategioiden kehittämiseksi. Huonon ennusteen potilaiden hoidon avuksi klinikalla tehtiin SWOT-analyysi, joka tehtiin POSEIDON-raporttien (1, 2, 4, 5) ja tämän tutkimuksen tietojen perusteella. Antraalifollikkelien reagointikyky gonadotropiiniin oli erittäin korkeampi ryhmässä 3 kuin muissa ryhmissä. Kun otetaan huomioon ryhmän 3 ilahduttava CLBR-tulos, ehdotamme munasolujen saannon lisäämiseksi, että kokeillaan useampia munasarjojen stimulaatioita mutta ei kovempaa munasarjojen stimulaatiota liiallisella päivittäisellä gonadotropiiniannoksella. Vaikka ryhmän 2 potilailla oli enemmän munasarjojen reserviä sekä enemmän munasoluja ja alkioita, CLBR-arvo oli odotettua alhaisempi. Ryhmän 2 hoitostrategian pitäisi pikemminkin parantaa elävänä syntyneiden potilaiden määrää kuin lisätä talteen otettujen munasolujen määrää.
Johtopäätös
Johtopäätöksenä voidaan todeta, että ristiriidassa munasolujen ja alkioiden määrän jakautumismallin kanssa potilasryhmittäin CLBR-arvot olivat suurimmasta pienimpään järjestyksessä ryhmässä 1 (nuoret naiset, joilla on hyvä munasarjojen reservi), ryhmässä 3 (nuoret naiset, joilla on huono munasarjojen reservi), ryhmässä 2 (pitkälle kehittyneessä iässä olevat naiset, joilla on hyvä munasarjojen reservi) ja viimeisenä ryhmässä 4 (pitkälle kehittyneessä iässä olevat naiset, joilla on huono munasarjojen reservi.
Tietojen saatavuus
Tekijät luovuttavat tämän käsikirjoituksen johtopäätöksiä tukevat raakadatat ilman aiheettomia varauksia kaikkien pätevien tutkijoiden saataville.
Eettinen lausunto
Tutkimuksen on hyväksynyt Luoteisen nais- ja lastensairaalan ihmisen avusteisen lisääntymisteknologian kliinistä soveltamista käsittelevä eettinen komitea (nro 2018002). Tämän tutkimuksen hyväksynyt eettinen komitea luopui tietoon perustuvan suostumuksen hankkimisesta. Kaikki tutkimus suoritettiin asiaankuuluvien ohjeiden ja määräysten mukaisesti.
Tekijöiden panos
WS ja JS ideoivat ja suunnittelivat tutkimuksen. WS ja WZ laativat ja tarkistivat käsikirjoituksen. WS, ZZ ja WZ analysoivat ja tulkitsivat tiedot. LT, ZZ ja HZ keräsivät ja selvittivät tiedot. Kaikki kirjoittajat ovat lukeneet ja hyväksyneet käsikirjoituksen lopullisen version.
Rahoitus
Tutkimusta rahoittivat Shaanxin maakunnan sosiaalisen kehityksen yleiset hankkeet (nro 2018SF-247) ja Luoteisen naisten ja lasten sairaalan henkilöstön koulutusohjelma (2018ZD02).
Esintäristiriitoja koskeva lausunto
Tekijät ilmoittavat, että tutkimus suoritettiin ilman kaupallisia tai taloudellisia suhteita, jotka voitaisiin tulkita mahdolliseksi eturistiriidaksi.
Kiitokset
Kiitämme kaikkia luoteisen naisten- ja lastensairaalan kliinikoita, tiedemiehiä ja embryologeja avusta tietojen keräämisessä ja kaikkia potilaita heidän panoksestaan tähän tutkimukseen. Kiitämme kiitollisena tohtori Xinglin Cheniä Bostonin X&Y solutions Inc:n epidemiologian ja biostatistiikan osastolta hänen panoksestaan tilastolliseen tukeen.
1. Johtopäätökset. Alviggi C, Andersen CY, Buehler K, Conforti A, De Placido G, Esteves SC, et al. Uusi yksityiskohtaisempi stratifikaatio munasarjojen stimulaatioon heikosti reagoivista: huonosta munasarjavasteesta matalan ennusteen käsitteeseen. Fertil Steril. (2016) 105:1452-3. doi: 10.1016/j.fertnstert.2016.02.005
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Humaidan P, Alviggi C, Fischer R, Esteves SC. Uudenlainen POSEIDON-stratifikaatio ”matalan ennusteen potilaille avusteisessa lisääntymisteknologiassa” ja sen ehdotettu onnistuneen lopputuloksen merkkipaalu. F1000Res. (2016) 5:2911. doi: 10.12688/f1000research.10382.1
CrossRef Full Text | Google Scholar
3. Ferraretti AP, La Marca A, Fauser BC, Tarlatzis B, Nargund B, Nargund G, Gianaroli L, ym. ESHRE:n yhteisymmärrys määritelmästä, joka koskee ”huonon vasteen” määrittelemistä munasarjojen stimulaatioon koeputkihedelmöityksessä käytettävien munasarjojen stimuloinnissa: Bolognan kriteerit. Hum Reprod. (2011) 26:1616-24. doi: 10.1093/humrep/der092
PubMed Abstract | CrossRef Full Text | Google Scholar
4. JOHDANTO. Esteves SC, Roque M, Bedoschi GM, Conforti A, Humaidan P, Alviggi C. Matalan ennusteen potilaiden määrittely avusteista lisääntymistekniikkaa käytettäessä: POSEIDON-kriteerit – miksi. Front Endocrinol. (2018) 9:461. doi: 10.3389/fendo.2018.00461
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Shi W, Zhang S, Zhao W, Xia X, Wang M, Wang H, et al. Kliiniseen raskauteen liittyvät tekijät vitrifioidun-lämmitetyn alkionsiirron jälkeen: retrospektiivinen ja monimuuttujainen logistinen regressioanalyysi 2313 siirtosyklistä. Hum Reprod. (2013) 28:1768-75. doi: 10.1093/humrep/det094
PubMed Abstract | CrossRef Full Text | Google Scholar
11. JOHDANTO. Polyzos NP, Drakopoulos P, Parra J, Pellicer A, Santos-Ribeiro S, Tournaye H, et al. Cumulative live birth rates according to the number of oocytes retrieved after the first ovarian stimulation for in vitro fertilization/intracytoplasmic sperm injection: a multicenter multicentral multinational analysis including approximately 15,000 women. Fertil Steril. (2018) 110:661-70 e1. doi: 10.1016/j.fertnstert.2018.04.039
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Millaisia tuloksia? Zhou J, Wang B, Hu Y, Sun H. Haettujen munasolujen lukumäärän ja kumulatiivisen elävänä syntyneiden määrän välinen yhteys 35-40-vuotiailla naisilla, joille on tehty pitkät GnRH-agonistiset IVF/ICSI-syklit. Arch Gynecol Obstet. (2017) 296:1005-12. doi: 10.1007/s00404-017-4503-9
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Millaisia tuloksia? Malchau SS, Henningsen AA, Forman J, Loft A, Nyboe Andersen A, Pinborg A. Kumulatiivisen elävänä syntyvyyden ennuste, joka perustuu edellisissä ART-sykleissä imettyjen munasolujen määrään. Hum Reprod. (2019) 34:171-80. doi: 10.1093/humrep/dey341
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Humrep. Devesa M, Tur R, Rodriguez I, Coroleu B, Martinez F, Polyzos NP. Kumulatiivinen elävänä syntyneiden määrä ja otettujen munasolujen määrä vuotiailla naisilla. Yhden keskuksen analyysi, johon kuului 4500 >/ = 38-vuotiasta naista. Hum Reprod. (2018) 33:2010-17. doi: 10.1093/humrep/dey295
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Humrep. Chang Y, Li J, Li X, Liu H, Liang X. Munasolujen laatu ja raskaustulos nuorilla hedelmättömillä naisilla, joilla on vähentynyt munasarjojen reservi. Med Sci Monit. (2018) 24:7279-84. doi: 10.12659/MSM.910410
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Bishop LA, Richter KS, Patounakis G, Andriani L, Moon K, Devine K. Vähentynyt munasarjojen reservi mitattuna lähtötilanteen follikkelia stimuloivan hormonin ja antraalisen follikkelimäärän avulla ei liity raskauden menetykseen nuoremmilla koeputkihedelmöityspotilailla. Fertil Steril. (2017) 108:980-7. doi: 10.1016/j.fertnstert.2017.09.011
CrossRef Full Text | Google Scholar
17. Millaisia tuloksia? Igarashi H, Takahashi T, Nagase S. Oocyte aging underlies female reproductive aging: biological mechanisms and therapeutic strategies. Reprod Med Biol. (2015) 14:159-69. doi: 10.1007/s12522-015-0209-5
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Fysioterapia. Babariya D, Fragouli E, Alfarawati S, Spath K, Wells D. The incidence and origin of segmental aneuploidy in human oocytes and preimplantation embryos. Hum Reprod. (2017) 32:2549-60. doi: 10.1093/humrep/dex324
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Humrep. Zeng M, Su S, Li L. Raskaustulosten vertailu vitrifikaation jälkeen halkaisu- ja blastokystavaiheessa: meta-analyysi. J Assist Reprod Genet. (2018) 35:127-34. doi: 10.1007/s10815-017-1040-1
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Lin LT, Vitale SG, Chen SN, Wen ZH, Tsai HW, Chern CU, et al. Luteaalivaiheen munasarjastimulaatio voi parantaa munasolujen talteenottoa ja munasolujen laatua huonosti reagoivilla munasarjoilla, joille tehdään koeputkihedelmöitys: alustavia tuloksia yhden keskuksen prospektiivisesta pilottitutkimuksesta. Adv Ther. (2018) 35:847-56. doi: 10.1007/s12325-018-0713-1
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Narkwichean A, Maalouf W, Baumgarten M, Polanski L, Raine-Fenning N, Campbell B, et al. Dehydroepiandrosteronin (DHEA) tehokkuus munasarjojen ikääntymisen vaikutuksen voittamiseksi (DITTO): periaatteellinen kaksoissokkoutettu satunnaistettu plasebokontrolloitu kaksoistutkimus. Eur J Obstet Gynecol Reprod Biol. (2017) 218:39-48. doi: 10.1016/j.ejogrb.2017.09.006
PubMed Abstract | CrossRef Full Text | Google Scholar
26. JOHDANTO (2017) 218:39-48. Grynberg M, Labrosse J. Follikulaarisen tuotosnopeuden (FORT) ymmärtäminen ja sen vaikutukset POSEIDON-kriteereihin. Front Endocrinol. (2019) 10:246. doi: 10.3389/fendo.2019.00246
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Hou LY. Epidemiologinen tutkimus hedelmättömyydestä Kiinan kolmessa maakunnassa. Phd Thesis, Graduate School of Peking Union Medical College, Beijing, China (2011).
Google Scholar
28. Zhu Hui-li HW. Munasarjan hedelmättömyyden epidemiologia ja etiologia. J Int Reprod Health/Family Plann. (2016) 35:212-216.
Google Scholar