Kun vety on kovalenttisesti sitoutunut erittäin elektronegatiiviseen atomiin, kuten fluoriin, klooriin, happiin tai typpeen, H-atomilla on osittainen positiivinen varaus, joka kirjoitetaan Hδ+.
Hδ+ on fysikaalisesti hyvin pieni, joten sen varaustiheys on epätavallisen suuri.
Kuvitellaan, että toinen negatiivinen tai elektronegatiivinen atomi, vaikkapa toisessa molekyylissä, lähestyy Hδ+:aa;syntyy molemminpuolinen vetovoima, jolloin syntyy erityisen voimakas dipoli-dipoli-veto.Tätä vetovoimaa kutsutaan vetysidokseksi.
Yleisesti vetysidokset ovat heikompia kuin ionisidokset ja kovalenttiset sidokset, mutta vahvempia kuin van der Waalsin voimat.

Vetysidokset vedessä
Tunnetuin esimerkki vetysidoksista on vesi:
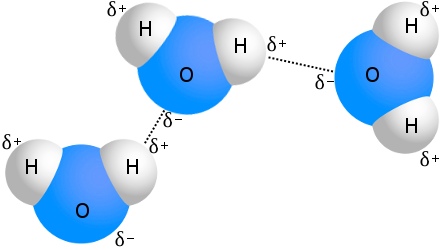
Jokaiseen vesimolekyyliin voi liittyä vetysidoksia jopa neljän muun vesimolekyylin kanssa.Huoneenlämpöisessä vedessä vetysidoksia on vesimolekyyliä kohti keskimäärin 3,6.
Molekyylien satunnainen lämpöliike takaa sen, että yksittäisen vetysidoksen elinikä vedessä on lyhyt, keskimäärin vain 10 pikosekuntia.Uuden sidoksen muodostumiseen kuluva aika on kuitenkin vieläkin lyhyempi.
Yksittäisen vetysidoksen pysyvään katkaisemiseen vedessä kuluu 21 kJ mol-1, mikä on merkittävä energiapanos.
Tuloksena on, että veden sulamis- ja kiehumispisteet ovat paljon korkeammat kuin näin pienen molekyylipainon molekyyliltä voisi odottaa.
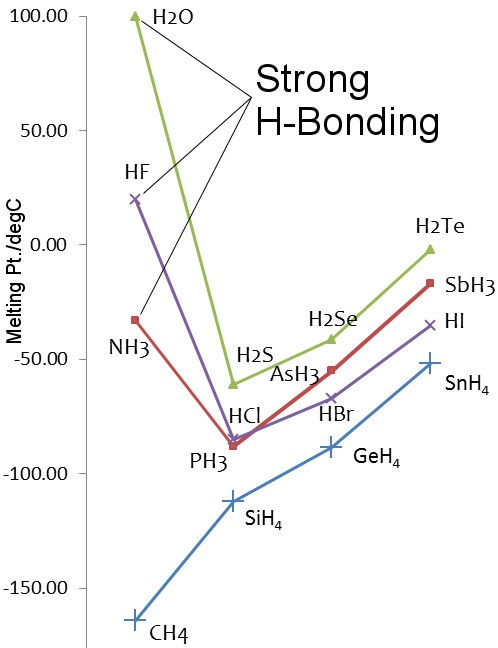
Tarkastellaan vettä vs. metaania.Vesimolekyylit vetävät toisiaan puoleensa melko voimakkaasti vetysidoksin, kun taas metaanissa vallitsevat van der Waalsin voimat.Niinpä vaikka niiden molekyylimassat ovat samankaltaiset, vedellä 18 ja metaanilla 16, niiden fysikaaliset ominaisuudet eroavat toisistaan suuresti.Esimerkiksi vesi sulaa 0,00 °C:ssa ja kiehuu 99,98 °C:ssa; metaani sulaa -182,5 °C:ssa ja kiehuu -161,5 °C:ssa.
Vetysidokset vedessä vs. rikkivety
Rikki on jaksollisen järjestelmän ryhmässä 16, samoin kuin happi. Rikki on happea raskaampi, jotenH2S:llä pitäisi olla korkeammat sulamis- ja kiehumispisteet kuin H2O:lla.Näin ei kuitenkaan ole, koska rikki on vähemmän elektronegatiivinen kuin happi, ja siksi vetysidos H2S:ssä on heikko.

Mol. Mass: 16
Sulatus Pt.: 0.00 °C
Kiehumis Pt.: 99.98 °C
O:n elektronegatiivisuus (Pauling): 3.44
vetysidoksen entalpia: 21 kJ mol-1

Mol. Mass: 34
Sulamispt.: -82 °C
Kiehumispt.: -60 °C
S:n elektronegatiivisuus (Pauling): 2.58
Vetysidonnan entalpia: ≅ 3 kJ mol-1
Vetysidonta ammoniakissa ja fluorivedyssä
Fluori ja typpi ovat elektronegatiivisimpia alkuaineita jaksollisen järjestelmän ryhmissään, ja vetyä sitovaa vetyä havaitaan vetyfluoridissa ja ammoniakissa.
Veden tavoin fluorivedyn ja ammoniakin sulamis- ja kiehumispisteet ovat korkeammat kuin niiden ryhmien raskaampien alkuaineiden hydridien.
Ryhmän 14-17 alkuaineiden hydridien sulamispisteet
Hydrogen bonding in DNA
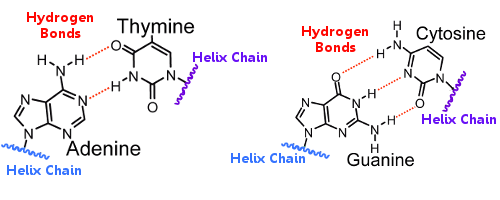
DNA:n emäsparit yhdistävät sen kahta kierteistä ketjua.emäsparit kantavat DNA:n geneettistä informaatiota.
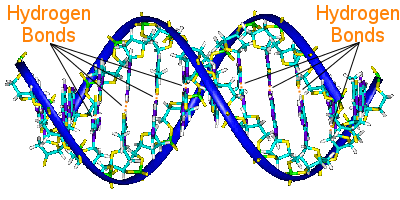
Toisen kierteen emäsparit liittyvät toisen kierteen emäspareihin vetysidoksin.
Siten vetysidokset pitävät kierteet yhdessä luoden kuuluisan kaksoiskierteen.
DNA:n replikoituessa vetysidokset katkeavat ja mahdollistavat molempien kierteiden irtoamisen toisistaan.
Vetysidoksilla on näin olennainen merkitys DNA:n replikaatiomekanismiin kuuluvassa emäspareiden lukitsemisessa.
Vetysidokset villassa
Villassa, kuten muissakin proteiinikuiduissa, on vetysidoksia.Alla olevassa kuvassa näkyy, miten vetysidokset (oranssit pisteet) yhdistävät villan α-helix-ketjun kierteet (vihreät).
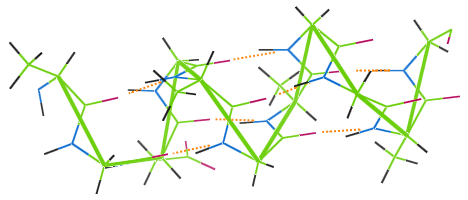
Jos villavaatetta pestään korkeassa lämpötilassa, vetysidokset tuhoutuvat, käämit menettävät kimmoisuutensa ja vaatteesta tulee huonokuntoinen.
