Esittely
ß-amyloidi ja fosforyloituneet tau-proteiinit ovat Alzheimerin taudin (AD) patologisia tunnusmerkkejä, jotka kerääntyvät ja leviävät ennustettavasti hajautettuihin hermoverkkoihin aiheuttaen eteneviä aineenvaihduntahäiriöitä, hermovaurioita ja solukuolemaa. Neurokuvantaminen helpottaa näiden patologisten muutosten yksityiskohtaista arviointia potilailla, joita tutkitaan kognitiivisen heikkenemisen vuoksi. Aiemmin Alzheimerin taudin lopullinen diagnoosi oli mahdollista vain kuolemanjälkeisen havainnoinnin ja näiden proteiiniaggregaattien neuroanatomisen vaiheistuksen avulla. Viimeaikaiset edistysaskeleet molekyylikuvantamisessa mahdollistavat kuitenkin amyloidi- ja tau-kertymien visualisoinnin elävistä ihmisaivoista, ja ne ovat tuoneet meidät lähemmäs AD:n lopullista in vivo -diagnoosia.
Rakennekuvantaminen
Amerikkalaisen neurologian akatemian (American Academy of Neurology, AAN) ohjeissa, jotka koskevat kognitiivisista valituksista kärsivien henkilöiden diagnostiikkaa1 , suositellaan, että aivojen rakenteellinen kuvantaminen ei-kontrastisella tietokonetomografialla (TT) tai magneettikuvantamisella (magneettikuvantamisella (MRI) tehtäisiin kaikille niille henkilöille, joilla on positiivinen anamneesi, ja joilla on havaittu objektiivisesti havaittavissa oleva kognitiivinen muutos. Tässä yhteydessä aivojen kuvantamisen ensisijaisena tehtävänä on sulkea pois ei-degeneratiiviset rakenteelliset vauriot, joista 5 prosenttia ei välttämättä näy kliinisessä anamneesissa tai fyysisessä tutkimuksessa2 ja jotka ovat mahdollisesti hoidettavissa. AAN suosittelee myös vaskulaarisen dementian (VaD), Lewyn kappaleisiin perustuvan dementian (DLB) ja frontotemporaalisen dementian (FTD) kliinistä poissulkemista. Rakenteellinen kuvantaminen voi parantaa diagnostista varmuutta ja muuttaa kliinistä diagnoosia 19-28 %:ssa sekä hoitoa 15 %:ssa kliinisistä tapauksista.2
Rakenteellisen atrofian arvioinnissa käytettävät kuvantamismenetelmät ovat tietokonetomografia ja magneettikuvaus. Atrofian tautikohtaiset mallit on kuvattu ja validoitu perusteellisesti näillä menetelmillä. Vaikka atrofia on havaittavissa tietokonetomografiassa, luonnostaan alhaisempi spatiaalinen resoluutio ja heikompi harmaan ja valkoisen aineen kontrasti johtavat siihen, että neurodegeneratiivisia muutoksia koskevat mahdollisesti hyödylliset hienovaraiset havainnot jäävät tekemättä. Tämän vuoksi lääkärit turvautuvat usein magneettikuvaukseen arvioidessaan rakenteellisten muutosten mallia ja vakavuutta, sulkeakseen pois kognitiivisen heikkenemisen muut kuin neurodegeneratiiviset syyt ja arvioidakseen valkean aineen muutosten vakavuutta ja laajuutta, kuten jäljempänä käsitellään yksityiskohtaisemmin.
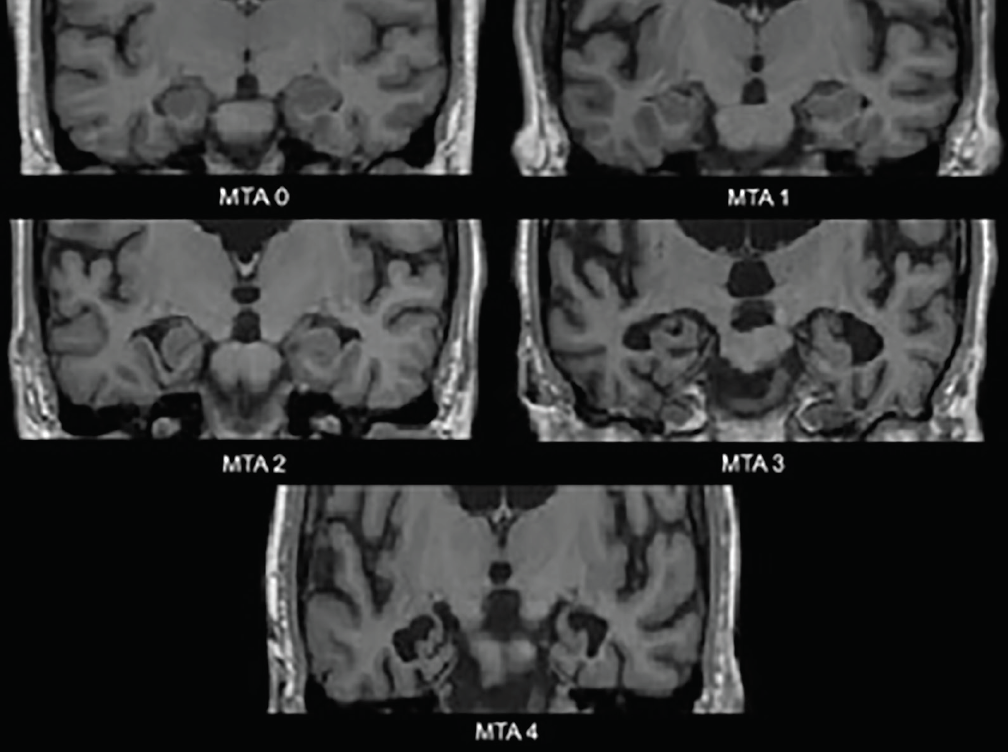
Varhaisimmat Alzheimerin taudin hermoston rappeutumismuutokset tapahtuvat mediaalisissa ohimolohkoissa – hippokampuksessa, entorhinaalisessa aivokuoressa ja parahippokampuksen gyrusissa. Atrofian alkaessa suonikalvon halkeama ja sivukammion temporaalisarvi laajenevat; nämä muutokset arvioidaan parhaiten koronaalitasossa. Näihin rakenteisiin perustuva yleisesti käytetty visuaalinen arviointiasteikko – mediaalinen temporaalinen atrofia-asteikko (MTA-asteikko) (kuva 1) – on kliinisesti3 ja neuropatologisesti4 validoitu. Eri tutkimukset, joissa on käytetty tätä asteikkoa tai sen arvioimia rakenteita, ovat osoittaneet merkittävää kykyä erottaa Alzheimerin tautia sairastavat henkilöt iän mukaisista kontrolleista4 tai henkilöistä, joilla on DLB4 tai vaskulaarinen kognitiivinen heikentymä (VCI).5 Mediaalinen temporaalinen atrofia ennustaa myös muuttumista amnestisesta lievästä kognitiivisesta heikentymästä (MCI, mild cognitive impairment) Alzheimerin dementiaksi.3
Klikkaa nähdäksesi suurempana
Kuva 1. Mediaalisen temporaalin atrofian (MTA) asteikkoluokitukset. MTA 0 – ei lainkaan tai minimaalisesti aukkoinen suonikalvohalkeama; MTA 1 – suonikalvohalkeaman hienoinen laajentuminen; MTA 2 – suonikalvohalkeaman, joka yhtyy sivukammion temporaalisarveen, laajeneminen entisestään, hippokampusmuodostuman korkeuden lievä lasku; MTA 3 – hippokampusmuodostuman korkeuden kohtalainen lasku, sivukammion ohimosarven selvä laajentuminen; MTA 4 – hippokampusmuodostuman korkeuden voimakas lasku, sivukammion ohimosarven selvä laajentuminen.
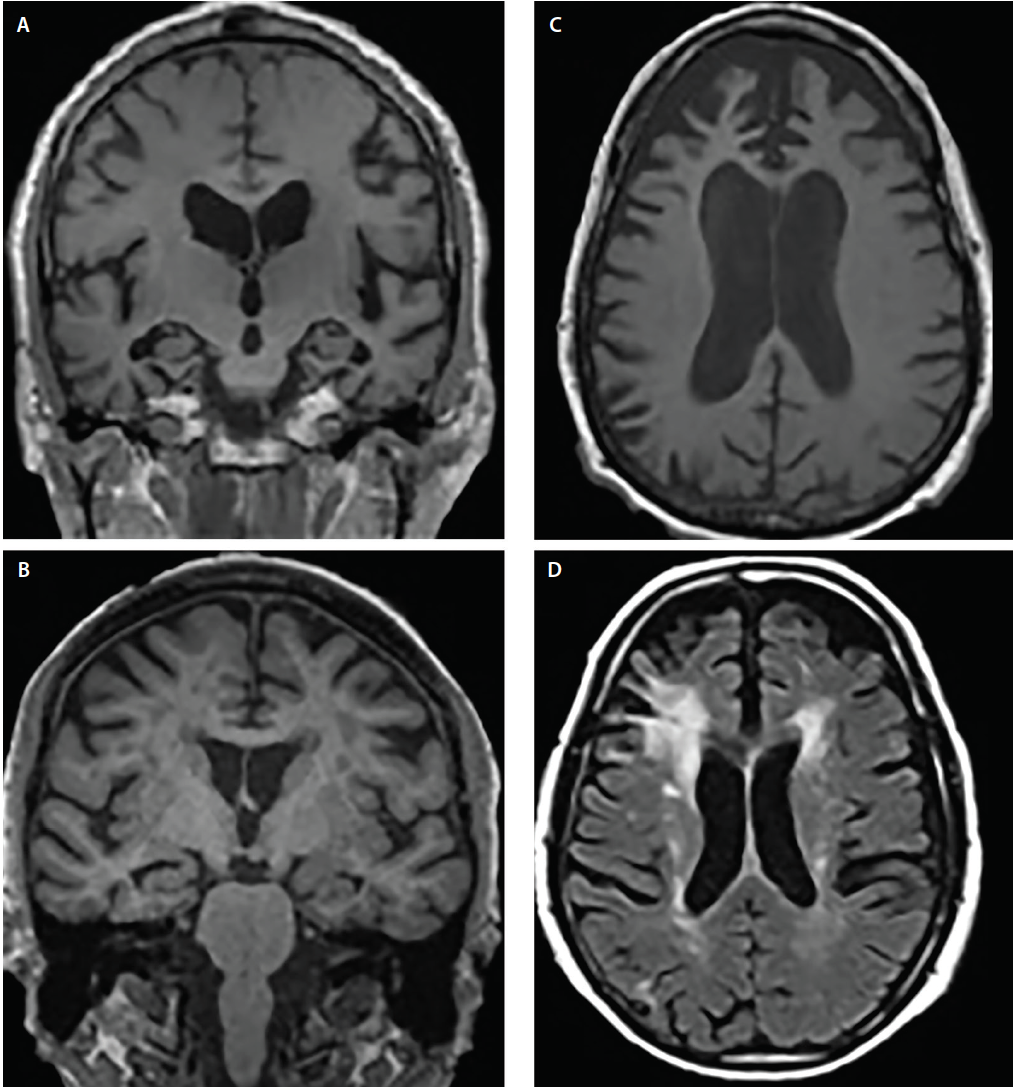
Dementiaoireyhtymissä esiintyy tyypillisesti kanonisia atrofian malleja6 , jotka vastaavat kognitiivisia ja käyttäytymisoireita; mukana olevat rakenteet voivat kuitenkin olla päällekkäisiä. Esimerkiksi AD:ssa ja DLB:ssä on molemmissa havaittavissa mediaalisen ohimolohkon osallistuminen, mutta useat kuvantamistutkimukset ja neuropatologiset tutkimukset ovat osoittaneet, että suhteessa AD:hen DLB:ssä on huomattavasti vähemmän mieltymystä mediaalisiin ohimorakenteisiin4,5 (kuva 2).
Klikkaa nähdäksesi suurempana
Kuva 2. Rakenteelliset surkastumismallit Alzheimerin taudissa (A), Lewyn kappaleisiin perustuvassa dementiassa (DLB) (B), frontotemporaalisessa dementiassa (FTD) (C) ja vaskulaarisessa dementiassa (VaD) (D). Koronaalinen T1-painotteinen magneettikuvaus osoittaa yleistynyttä kortikaalista atrofiaa mutta eriasteista hippokampuksen atrofiaa AD:ssa (A) ja DLB:ssä (B). Aksiaalinen T1-painotteinen magneettikuvaus osoittaa bvFTD:n atrofiaa, jonka painopiste on mediaalisessa ja lateraalisessa prefrontaalisessa aivokuoressa (C). Aksiaalinen T2-painotteinen magneettikuvaus osoittaa konfluenssia periventrikulaarista valkean aineen hypointensiteettiä (WMH), joka käsittää corona radiatan ja ulottuu lateraaliseen prefrontaaliseen aivokuoreen, lieviä hajanaisia WMH:ita ja WMH:ita subependymaalisessa kammion limakalvossa ja septum pellucidumissa VaD:ssa (D).
Kummassakin Alzheimerin taudissa ja frontotemporaalilohkodegeneraatiossa (FTLD) on päällekkäisiä atrofia-alueita, mukaan lukien prefrontaalisen, orbitofrontaalisen ja anteriorisen saarekekorteksin alueet sekä anterioriset ja mediaaliset ohimolohkot.6 Suhteessa toisiinsa Alzheimerin tauti osoittaa kuitenkin huomattavasti enemmän atrofiaa lateraalisissa parietaali- ja takaraivokuorissa, kun taas FTLD osoittaa enemmän atrofiaa otsalohkoissa (kuva 2).6
On tärkeää arvioida systemaattisesti kaikki aivoalueet ja huomioida alueet, joilla on sekä rakenteellista atrofiaa että anatomisia säästöjä, jotta diagnostisesta kuvantamisesta saadaan paras mahdollinen hyöty. Laajassa monikeskustutkimuksessa arvioitiin hiljattain kuuden visuaalisen luokitteluasteikon kykyä luokitella oikein 186 patologisesti vahvistettua AD-, DLB- ja FTLD-tapausta.6 Tutkimus osoitti, että useiden tautispesifisten alueiden samanaikainen arviointi tuotti huomattavasti paremman erottelukyvyn kuin yksittäiseen alueeseen keskittyminen.4
Vaskulaarinen vaurio on tärkeä näkökohta arvioitaessa henkilöitä, joilla on kognitiivisia häiriöitä. Iskeemiset muutokset ovat yleisiä normaalissa ikääntymisessä, ja niitä kiihdyttävät yleiset liitännäissairaudet (esim. verenpainetauti, diabetes ja hyperkolesterolemia). Vaskulaarinen osuus kognitiivisen heikentymisen taustalla on usein pääteltävissä, kun T2-painotteisessa tai FLAIR-sekvenssissä (FLAIR = fluid attenuated inversion recovery) havaitaan merkittäviä valkean aineen hyperintensiteettejä (WMH = white matter hypertentensities), kortikaalisia aivohalvauksia tai strategisesti sijoitettuja lacuneja. Tyvitumakkeiden lakunaariset aivohalvaukset ja WMH:t centrum semiovalessa ja corona radiatassa ovat kroonisen pienten verisuonten iskeemisen vaurion indikaattoreita (kuva 2). Sen sijaan periventrikulaariset lakit ovat usein alkuperältään ei-iskeemisiä ja kuvastavat subependymaalista glioosia.7 On olemassa useita WMH:n vakavuusasteikkoja (esim. Fazekasin asteikko)7 , joita voidaan käyttää kliinisissä tilanteissa. Tällaiset pisteytysalgoritmit ovat kaikki yhtä mieltä siitä, että laajalle levinnyt konfluentti WMH ja subkortikaaliset lakunaariset infarktit ovat ainakin osittain todennäköisesti kognitiivista heikkenemistä edistäviä tekijöitä.7
Diffuusiotensorikuvantaminen (DTI) on uusi magneettikuvaussekvenssi, joka on herkkä veden diffuusion havaitsemiselle kudoksessa ja jonka avulla voidaan arvioida valkean aineen eheyttä, koska aksonien arkkitehtuuri rajoittaa veden virtausta. Keskimääräistä diffuusiokykyä ja fraktionaalista anisotropiaa käytetään usein kuvaamaan neurodegeneratiivisia muutoksia DTI:ssä. Edellinen mittaa diffuusion suuruutta ja jälkimmäinen mittaa sitä, virtaako vesi ensisijaisesti yhteen suuntaan, kuten terveissä aksoneissa odotetaan. Sekä MCI- että dementia- ja AD-populaatioissa on johdonmukaisesti raportoitu keskimääräisen diffuusiokyvyn ja fraktionaalisen anisotropian vähenemistä.8 Useissa tutkimuksissa on myös havaittu DTI-muutoksia oireettomilla henkilöillä, joilla on riski sairastua Alzheimerin tautiin9 , mikä viittaa siihen, että nämä muutokset tapahtuvat varhaisessa vaiheessa taudin kulkua. Valkoisen aineen eheyden arvioinnin lisäksi DTI:tä voidaan käyttää mallintamaan bruttorakenteellista kytkeytyneisyyttä aivokuoren alueiden välillä traktografia-algoritmien avulla. Tämä on saanut jalansijaa Alzheimerin taudin alalla, koska on näyttöä siitä, että amyloidi- ja tau-patologia voi levitä aivoyhteyksien kautta.10 Vaikka DTI:llä on potentiaalia valkean aineen eheyden mittarina, sen herkkyys liikkeelle ja muut tekniset rajoitukset rajoittavat ainakin toistaiseksi sen kliinistä käyttöä.
Funktionaalinen kuvantaminen
Aivojen hypometaboliaa havaitaan helposti hermoston rappeutumissairauksien yhteydessä, ja se voi olla avuksi diagnoosin tekemisessä. Hermosolujen toiminta on riippuvainen verestä saatavasta hapesta ja glukoosista, joiden toimittamista helpottaa alueellinen vasodilataatio. 18F-fluorodeoksiglukoosipositroniemissiotomografia (FDG-PET) heijastaa epäsuorasti aivokuoren aktiivisuuden astetta, ja sitä voidaan helposti käyttää neurodegeneratiivisten muutosten visualisointiin hyödyntämällä tätä metabolista riippuvuutta glukoosista.
Alzheimerin taudille ominainen aivokuoren hypometabolian tunnusmerkki koostuu varhaisista muutoksista takimmaisessa cingulaarisessa aivokurkiaisessa (PCC, posterior cingulate), prekuneuksessa (precuneus), temporaalisessa aivokurkiaisessa, päälaen- ja parietaalisessa aivokurkiaisessa, ja myöhäisemmissä vaiheissa myös otsakuoressa. Tämä kuvio ilmenee jo varhain, jopa oireiden alkuvaiheessa,11 ja se on kliinisesti hyödyllinen AD:n ja FTD:n erottamisessa toisistaan.12 Toisin kuin AD:n tapauksessa, FTD:n metabolinen oirekuva paljastaa otsa-, etummaisen ohimo-, tyvitumakkeen ja talamuksen hypometabolian, ja takimmaiset assosiaatioaivokuorteksit jäävät suhteellisen vähälle huomiolle.13 Kliinisesti epävarmoissa tilanteissa lääkärit voivat käyttää näitä metabolisia merkkejä erottaakseen AD:n ja FTD:n toisistaan.12 Vastaavasti, vaikka DLB:n neokortikaalinen metabolinen allekirjoitus voi olla hämmentävästi päällekkäinen AD:n allekirjoituksen kanssa, DLB-tapauksissa voi esiintyä myös takaraivon hypometaboliaa.14 .
Center for Medicare & Medicaid Services pitää FDG-PET:tä ”kohtuullisena ja tarpeellisena” vain niille henkilöille, jotka täyttävät sekä AD:n että FTD:n kriteerit ja joilla AAN:n ohjeiden1 mukainen täysi diagnostinen työstö ei ole lopullisesti osoittanut etiologiaa.15
Funktionaalinen magneettikuvaus (fMRI) voi myös mitata aivojen aktiivisuutta käyttämällä sekvenssejä, jotka ovat herkkiä aivojen aktiivisuudesta johtuville ajallisille muutoksille hapettuneessa/hapettoman veren hemoglobiinin määrässä. Tällä tavoin fMRI on sukua FDG-PET:lle, koska hemoglobiinin muutokset johtuvat aivotoiminnan edellyttämästä glukoosiaineenvaihdunnasta. Alueiden välisiä ajallisia riippuvuuksia voidaan käyttää funktionaalisen kytkeytyvyyden päättelyyn (eli siihen, mitkä alueet kommunikoivat aktiivisesti). Verrattuna FDG-PET:hen fMRI tarjoaa paremman spatiaalisen resoluution, mikä mahdollistaa tarkemman liitettävyyden kartoittamisen. Toinen fMRI:n etu on se, että se voidaan ottaa tehtävän suorittamisen aikana tai levossa. Ensin mainitussa tapauksessa tunnistetaan tiettyjen aktiivisten tilojen ohjaamat liitettävyysmallit, kun taas jälkimmäisessä tapauksessa tunnistetaan levossa olevat liitettävyysmallit, joita kutsutaan oletustilaverkoksi (DMN). DMN:n määrittelevät toiminnalliset solmukohdat, PCC ja precuneus, jotka yhdistyvät dorsaaliseen mediaaliseen osajärjestelmään ja mediaaliseen temporaaliseen osajärjestelmään.16 Amyloidin laskeuman uskotaan alkavan DMN:n toiminnallisista solmukohdista. DMN:n tiedetään olevan vaurioitunut Alzheimerin taudissa.16 Sitä vastoin FTD:ssä DMN on säästynyt, kun taas salience- tai attention-verkostot ovat vaurioituneet.17 Tällä hetkellä fMRI-teknologia rajoittuu tutkimussovelluksiin, mutta keinoja kehittää relevantteja kliinisesti sovellettavia algoritmeja tutkitaan aktiivisesti.
Molekulaarinen kuvantaminen
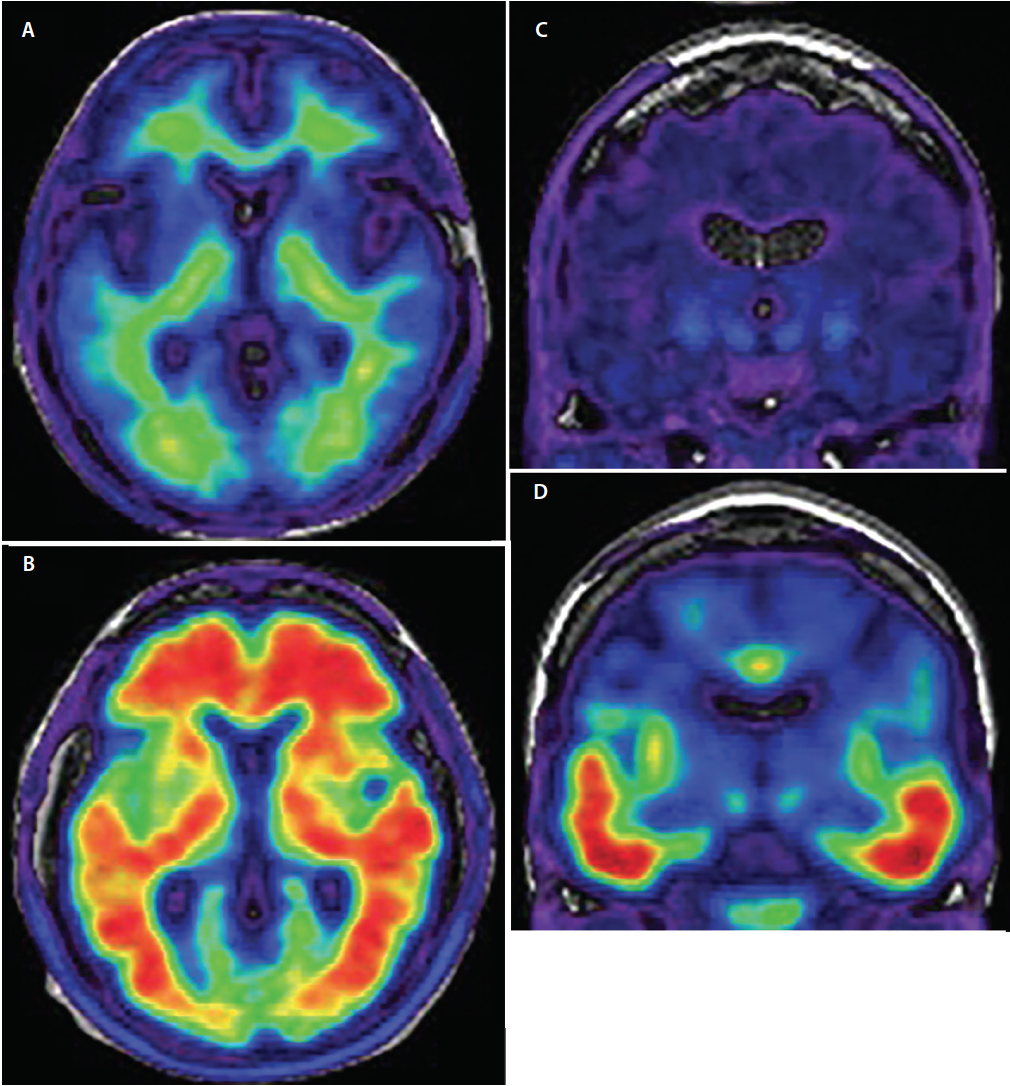
Kriteeristandardi Alzheimerin taudin lopullisen diagnoosin määrittämiseksi on kuolemanjälkeinen neuropatologinen aivojen tutkimus. Jopa kokeneiden dementia-asiantuntijoiden käsissä AD:n kliininen diagnoosi saavuttaa vain huolestuttavan herkkyyden 70,9-87,3 % ja spesifisyyden 44,3-70,8 %.18 Alzheimerin taudin kliinisen diagnoositarkkuuden parantamisen kannalta olennaisinta on ollut sellaisten radiomerkittyjen PET-kuvantamisen merkkiaineiden kehittäminen, joilla on spesifinen affiniteetti Alzheimerin tautiin liittyviin ß-amyloidi- ja fosforyloituneisiin tau-aggregaatteihin (kuva 3) ja jotka mahdollistavat niiden taustalla olevan neuropatologian (taulukko) in vivo -demonstraation (taulukko), joka ennen oli mahdollista vain post mortem.
Klikkaa nähdäksesi suuremmassa muodossa
Kuva 3. Aksiaalinen amyloidi-PET, jossa näkyy amyloidinegatiivinen (A) ja amyloidipositiivinen kuvaus (B). Amyloidinegatiivisissa kuvissa (A) radioaktiivisen merkkiaineen signaali on vähäistä ja rajoittuu epäspesifiseen valkean aineen sitoutumiseen. Harmaan ja valkoisen aineen rajapinta on säilynyt. Amyloidipositiivisissa kuvissa (B) radioaktiivisen merkkiaineen signaali on voimakasta ja ulottuu diffuusisti aivokuoren harmaan aineen alueille peittäen harmaan ja valkoisen aineen rajapinnan. Koronaalinen tau-PET osoittaa tau-negatiiviset (C) ja tau-positiiviset (D) kuvat. Tau-negatiivisissa kuvissa on minimaalinen, epäspesifinen, matala intensiteetiltään matala radiosädesignaali mediaalisella temporaalialueella, tyvitumakkeissa ja tyvitumakkeissa. Tau-positiivisissa kuvissa (D) radioaktiivisen merkkiaineen signaali on voimakkaampi, ja se kattaa alemman ja lateraalisen ohimolohkon neurofibrillaaristen kyhmyjen tunnetun etenemisreitin mukaisesti.
Amyloidipositroniemissiotomografia
Amyloidikuvantaminen ja viime aikoina myös tau-kuvantaminen ovat mullistaneet kykymme visualisoida Alzheimerin taudin patologiaa jopa esiasteella.19 Amyloidi-PET-kuvantamisen merkkiaineet ovat päteviä ja luotettavia AD-patologian havaitsemiseksi in vivo taudin eri vaiheissa. Nämä kuvantamismerkkiaineet sitovat amyloidiproteiinin spesifisiä konformaatiomotiiveja ja johtavat merkkiaineen imeytymiseen, joka korreloi tiukasti kuolemanjälkeisen amyloidin kerrostumisen kanssa.20
Tauhun verrattuna amyloidipatologia alkaa hajanaisemmin jakautuneena alueellisena kuviona, joka leviää frontaali-, temporaali- ja okcipitaalilohkojen basaalisista osista dorsaalisiin neokortikaalisiin assosiaatioalueisiin, ja primaariset sensoriset ja motoriset aivokuoren osat osallistuvat siihen vasta myöhemmässä vaiheessa.21 Merkittävimmät merkkiaineen ottoalueet ovat otsa-, parietaali- ja lateraaliset ohimolohkot (kuva 3), ja merkkiaineen otto on 1,5-2 kertaa suurempi Alzheimerin tautia sairastavilla kuin kontrolliryhmillä22 tai muita dementioita sairastavilla.23
Amyloidi-PET-kuvissa arvioidaan kortikaalisen merkkiaineen otto Alzheimerin taudille tyypillisiltä amyloidijakauman alueilta. Positiivisissa kuvissa näkyy harmaan ja valkoisen aineen eron häviäminen, kun merkkiaineen imeytyminen ulottuu neokorteksin alueelle. Negatiivisissa kuvissa harmaan ja valkean aineen ero säilyy, ja niissä näkyy vain valkean aineen sitoutuminen muualle kuin kohteeseen.24 Amyloidi-PET-kuvantamismallit voivat luotettavasti ennustaa kognitiivista heikkenemistä sekä terveillä ihmisillä että MCI:tä sairastavilla20 .
Elintarvike- ja lääkevirasto (FDA) on hyväksynyt 18F-florbetapirin, 18F-florbetabeenin ja 18F-flutemetamolin kliiniseen käyttöön.20 Vakuutusyhtiöt eivät kuitenkaan ole ottaneet tekniikkaa omakseen kustannusten ja kliinisen liikakäytön riskin vuoksi, kun tautia muokkaavia hoitoja ja todettua kustannushyötyä ei ole. Meta-analyysin mukaan positiivinen amyloidi-PET-kuvaus on 95 prosentin herkkyydellä ja 57 prosentin spesifisyydellä ennustanut MCI:n muuttumista Alzheimerin taudiksi.25
Kustannusten, riskien ja hyötyjen epävarma suhde on johtanut siihen, että amyloidikuvantamiselle on kehitetty tarkoituksenmukaisuuskriteerit, joiden mukaan amyloidi-PET-arviointi on tarpeen henkilöille, joilla on selittämätön MCI-oireyhtymä, epätyypillisiä Alzheimerin taudin muotoja ja varhaisessa vaiheessa alkanut dementia.26 Asiantuntijat ovat myös määritelleet amyloidikuvantamisen epätarkoituksenmukaisia käyttöaiheita, joita ovat muun muassa itsenäinen arviointi kognitiivisten ongelmien varalta ennen perusteellista kliinistä, kognitiivista, laboratorio- ja rakenteellista neurokuvantamistutkimusta, objektiivisen kognitiivisen heikentymisen puuttuessa, Alzheimerin taudin suurella todennäköisyydellä (ts. kliinisen epätasapainon puuttuessa) ja dementian vaikeusasteen määrittämiseksi.
IDEAS-tutkimuksessa (imaging dementia-evidence for amyloid scanning), joka on meneillään oleva Center for Medicare and Medicaid Services -tutkimus, validoidaan parhaillaan tarkoituksenmukaisen käytön kriteerejä ja arvioidaan PET:llä määritetyn amyloidistatuksen vaikutusta sairauden hallintaan ja pitkäaikaistuloksiin Medicare-korvauksen saajilla, joilla on MCI-tautia tai epätyypillisiä oireita. Väliaikainen analyysi osoitti, että amyloidi-PET:n sisällyttäminen kliiniseen tutkimukseen johti sairauden hoidon muutoksiin 60,2 prosentilla MCI:tä sairastavista ja 63,5 prosentilla dementiaa sairastavista.27 Pitkäaikaistuloksia selvitetään vielä.
Tau-positroniemissiotomografia
Tau on toinen valkuaisaine, joka kerrostuu Alzheimerin tautia sairastavien aivoihin. Tau-PET-kuvantamisen merkkiaineita kehitetään parhaillaan, ja ne ovat jo lupaavia. Samoin kuin amyloidi-PET, tau-PET-merkkiaineet kohdistuvat tiettyihin fosforyloituneen taun konformaatiomotiiveihin. Tau-merkkiaineiden spesifisyys on validoitu post mortem28 , ja havaittu tau-PET-signaali vastaa läheisesti neurofibrillaaristen kyhmyjen anatomista jakaumaa, jota nykyisin käytetään Alzheimerin taudin neuropatologisessa diagnoosissa.29 Tau-patologian varhaisimmat tau-patologian vaiheet, jotka voidaan visualisoida tau-PET-kuvantamismenetelmällä, ovat neurofibrillaaristen kyhmyjen kerrostumat entorinaalisessa aivokuoressa ja hippokampuksessa. Seuraavaksi tau-kertymiä on havaittavissa inferiorisessa ja lateraalisessa temporaalissa (kuva 3), sitten parietaalisessa ja occipitaalisessa aivokuoressa ja lopuksi otsalohkossa noudattaen vakiintunutta Braakin ja Braakin tau-kertymän patologista porrastusta aivoissa.21 Tau-merkkiaineilla on diagnostisia rajoituksia, ja niitä kehitetään edelleen, jotta niiden kliininen rooli voitaisiin määritellä paremmin. Koska tau-merkkiaineen sitoutuminen kuitenkin muuttuu dynaamisesti koko Alzheimerin taudin kliinisen kulun ajan, tällä kuvantamismenetelmällä on todennäköisesti merkittävä rooli taudin vaikeusasteen määrittämisessä in vivo.30
Tulevaisuuden suuntaviivat
Kun otetaan huomioon, että Alzheimerin taudin patologia voidaan havaita helposti jopa 20 vuotta ennen dementian diagnoosia19 ja että se noudattaa ennustettavaa vaiheittaista jakaumaa, tutkimuksessa keskitytään nyt oireiden varhaiseen havaitsemiseen ja diagnoositarkkuuden parantamiseen biomarkkereiden avulla (taulukko).31 Ehdotettu amyloidi-tau-neuron rappeutumisen (ATN) tutkimuskehys, jossa keskitytään havaitsemaan kolmea biomarkkerimuutosta aivoissa, ennustaa multimodaalisen kuvantamisen kliinistä merkitystä.31 ATN-luokitusjärjestelmä on kliinisistä oireyhtymistä riippumaton, ja se kattaa koko neurodegeneratiivisten sairauksien kirjon Alzheimerin taudin biomarkkerien näkökulmasta. Jatkokehityksen ja -parannuksen jälkeen ATN:n odotetaan objektiivisen in vivo -biomarkkeriluokittelun avulla parantavan merkittävästi kliinistä diagnoositarkkuutta ja parantavan hoidon laatua.
Johtopäätös
Neurokuvantaminen tarjoaa ainutlaatuista tietoa kognitiivisen heikentymisen taustalla olevasta etiologiasta ja helpottaa potilaiden ja perheiden opastamista pelottavan ja epävarman kokemuksen läpi. Kaikissa neurodegeneratiivisissa sairauksissa on huomattavaa kliinistä heterogeenisuutta, ja ennen viimeisimpiä molekyylikuvantamisen edistysaskeleita mitään niistä ei voitu diagnosoida lopullisesti ennen kuolemaa. Nykyaikaisella aivojen kuvantamistekniikalla pystytään havaitsemaan monia epifenomenaalisia ilmiöitä, jotka heijastavat taustalla olevaa neuropatologiaa ja joista osa on varsin lähellä taudin lähdettä. Varmin kliininen diagnoosi perustuu tällä hetkellä kliinisen anamneesin, lääkärin havaintojen, fyysisen tutkimuksen, lääketieteellisen tutkimuksen, neuropsykologisen testauksen ja diagnostisen neurokuvauksen asiantuntevan tulkinnan yhdistelmään. Kun ATN:n biomarkkerit tarkentuvat entisestään, kliiniset diagnoosit voidaan tehdä aikaisemmin ja varmemmin elävillä potilailla, ne perustuvat vähemmän oireiden luokitteluun ja tarjoavat mahdollisuuksia varhaisempiin hoitotoimenpiteisiin, jotka voivat muuttaa hermoston rappeutumissairauden kulkua.
1. Knopman DS, DeKosky ST, Cummings JL, et al. Practice parameter: diagnosis of dementia (an evidence-based review). American Academy of Neurologyn laatustandardien alakomitean raportti. Neurologia. 2001;56(9):1143-1153.
2. Chui H, Zhang Q. Evaluation of dementia: a systematic study of the usefulness of the American Academy of Neurology’s practice parameters. Neurologia. 1997;49(4):925-935.
3. Apostolova LG, Thompson PM, Green AE ym. 3D-vertailu matalan, keskitason ja pitkälle edenneen hippokampusatrofian välillä MCI:ssä. Hum Brain Mapp. 2010;31(5):786-797.
4. Harper L, Fumagalli GG, Barkhof F, et al. MRI visual rating scales in the diagnosis of dementia: evaluation in 184 post mortem confirmed cases. Brain. 2016;139(Pt 4):1211-1225.
5. Burton EJ, Barber R, Mukaetova-Ladinska EB, et al. Medial temporal lobe atrophy on MRI differentiates Alzheimer’s disease from dementia with Lewy bodies and vascular cognitive impairment: a prospective study with pathological verification of diagnosis. Brain. 2009;132(Pt 1):195-203.
6. Harper L, Bouwman F, Burton EJ, et al. Patterns of atrophy in pathologically confirmed dementias: a voxelwise analysis. J Neurol Neurosurg Psychiatry. 2017;88(11):908-916.
7. Fazekas F, Kleinert R, Offenbacher H, et al. Pathologic correlates of incidental MRI white matter signal hyperintensities. Neurology. 1993;43(9):1683-1689.
8. Huang J, Friedland RP, Auchus AP. Diffuusiotensorikuvaus normaalilta näyttävästä valkoisesta aineesta lievässä kognitiivisessa heikentymisessä ja varhaisessa Alzheimerin taudissa: alustavia todisteita aksonidegeneraatiosta ohimolohkossa. AJNR Am J Neuroradiol. 2007;28(10):1943-1948.
9. Selnes P, Fjell AM, Gjerstad L, et al. Valkoisen aineen kuvantamismuutokset subjektiivisessa ja lievässä kognitiivisessa häiriössä. Alzheimers Dement. 2012;8(5 Suppl):S112-S121.
10. Jacobs HIL, Hedden T, Schultz AP, et al. Rakenteelliset ratamuutokset ennustavat myöhempää taun kertymistä amyloidipositiivisilla iäkkäillä henkilöillä. Nat Neurosci. 2018;21(3):424-431.
11. Apostolova LG, Thompson PM, Rogers SA, et al. Surface feature-guided mapping of cerebral metabolic changes in cognitively normal and mildly impaired elderly. Mol Imaging Biol. 2010;12(2):218-224.
12. Foster NL, Heidebrink JL, Clark CM, et al. FDG-PET parantaa tarkkuutta frontotemporaalisen dementian ja Alzheimerin taudin erottamisessa. Brain. 2007;130(Pt 10):2616-2635.
13. Ishii K, Sakamoto S, Sasaki M, et al. Aivojen glukoosiaineenvaihdunta potilailla, joilla on frontotemporaalinen dementia. J Nucl Med. 1998;39(11):1875-1878.
14. Mosconi L, Tsui WH, Herholz K, et al. Multicenter-standardoitu 18F-FDG-PET-diagnostiikka lievän kognitiivisen heikentymisen, Alzheimerin taudin ja muiden dementioiden yhteydessä. J Nucl Med. 2008;49(3):390-398.
15 . Centers for Medicare & Medicaid Serivces. Decision Memo for Positron Emission Tomography (FDG) and Other Neuroimaging Devices for Suspected Dementia (CAG-00088R)https://www.cms.gov/medicare-coverage-database/details/nca-decision-memo.aspx?NCAId=104. Accessed May 4, 2019.
16. Buckner RL, Sepulcre J, Talukdar T, et al. Cortical hubs revealed by intrinsic functional connectivity: mapping, assessment of stability, and relation to Alzheimer’s disease. J Neurosci. 2009;29(6):1860-1873.
17. Seeley WW, Crawford RK, Zhou J, Miller BL, Greicius MD. Neurodegeneratiiviset sairaudet kohdistuvat ihmisen suuriin aivoverkkoihin. Neuron. 2009;62(1):42-52.
18. Beach TG, Monsell SE, Phillips LE, Kukull W. Alzheimerin taudin kliinisen diagnoosin tarkkuus National Institute on Aging Alzheimer Disease Centersissä 2005-2010. J Neuropathol Exp Neurol. 2012;71(4):266-273.
19. Jagust W. Alzheimerin taudin kehityksen ja patofysiologian kuvantaminen. Nat Rev Neurosci. 2018;19(11):687-700.
20. Rice L, Bisdas S. FDG- ja amyloidi-PET:n diagnostinen arvo Alzheimerin taudissa – systemaattinen katsaus. Eur J Radiol. 2017;94:16-24.
21. Braak H, Braak E. Alzheimeriin liittyvien muutosten neuropatologinen vaiheistus. Acta Neuropathol. 1991;82(4):239-259.
22. Klunk WE, Engler H, Nordberg A, et al. Aivojen amyloidin kuvantaminen Alzheimerin taudissa Pittsburgh Compound-B:llä. Ann Neurol. 2004;55(3):306-319.
23. Ossenkoppele R, Jansen WJ, Rabinovici GD, et al. Prevalence of amyloid PET positivity in dementia syndromes: a meta-analysis. JAMA. 2015;313(19):1939-1949.
24. Minoshima S, Drzezga AE, Barthel H, et al. SNMMI procedure standard/EANM Practice Guideline for Amyloid PET Imaging of the Brain 1.0. J Nucl Med. 2016;57(8):1316-1322.
25. Ma Y, Zhang S, Li J, ym. amyloidikuvantamisen ennustetarkkuus lievästä kognitiivisesta heikentymisestä Alzheimerin tautiin etenemisessä eri seuranta-aikoina: meta-analyysi. . Medicine (Baltimore). 2014;93(27):e150.
26. Johnson KA, Minoshima S, Bohnen NI, et al. Appropriate use criteria for amyloid PET: a report of the Amyloid Imaging Task Force, the Society of Nuclear Medicine and Molecular Imaging, and the Alzheimer’s Association. Alzheimers Dement. 2013;9(1):e1-e16.
27. Rabinovici GD, Gatsonis C, Apgar C, et al. Association of amyloid positron emission tomography with subsequent change in clinical management among medicare beneficiaries with mild cognitive impairment or dementia. JAMA. 2019;321(13):1286-1294.
28. Aguero C, Dhaynaut M, Normandin MD, ym. uuden tau PET-merkkiaineen -MK-6240 autoradiografinen validointi ihmisen post mortem aivokudoksessa. Acta Neuropathol Commun. 2019;7(1):37.
29. Chien DT, Bahri S, Szardenings AK, et al. Varhaiset kliiniset PET-kuvantamistulokset uudella PHF-tau-radioligandilla -T807. J Alzheimers Dis. 2013;34(2):457-468.
30. Wang L, Benzinger TL, Su Y, et al. Evaluation of tau imaging in staging Alzheimer disease and revealing interactions between beta-amyloid and tauopathy. JAMA Neurol. 2016;73(9):1070-1077.
31. Jack CR, Jr., Bennett DA, Blennow K, et al. NIA-AA Research Framework: Toward a biological definition of Alzheimer’s disease. Alzheimers Dement. 2018;14(4):535-562.
MRA ja DS eivät ilmoita mitään tietoja.
LGA on toiminut Eli Lillyn neuvoa-antavan komitean jäsenenä.