Oppimistavoitteet
- Aiemmin esiteltyjen tasapainokäsitteiden laajentaminen koskemaan happoja ja emäksiä, jotka voivat luovuttaa tai ottaa vastaan useamman kuin yhden protonin
Voidaan myös käyttää konjugoitujen happoemäsparien suhteellisia voimakkuuksia ymmärtämään suolaliuosten happo-emäsominaisuuksia. Neutralointireaktio voidaan määritellä hapon ja emäksen reaktioksi, jossa syntyy suola ja vettä. Toisin sanoen toinen kationi, kuten \(Na^+\), korvaa hapon protonin. Esimerkkinä voidaan mainita heikon hapon \(\ce{CH3CO2H}\) ja vahvan emäksen \(\ce{NaOH}\) reaktio:
\
Suola voi kuitenkin liueta veteen neutraaliksi, emäksiseksi tai happamaksi liuokseksi sen komponentti-ionien happo-emäs-ominaisuuksista riippuen.
Kun suola, kuten \(NaCl\) liukenee veteen, se tuottaa \(Na^+_{(aq)}\) ja \(Cl^-_{(aq)}\) ioneja. Lewisin lähestymistapaa käyttäen \(Na^+\)-ionia voidaan pitää happona, koska se on elektroniparin akseptori, vaikka sen alhainen varaus ja suhteellisen suuri säde tekevät siitä hyvin heikon hapon. \(Cl^-\)-ioni on vahvan hapon \(HCl\) konjugaattiemäs, joten sillä ei ole olennaisesti emäksistä luonnetta. Näin ollen \(NaCl\):n liuottaminen veteen ei vaikuta liuoksen \(pH\):aan, ja liuos pysyy neutraalina.
Vertaillaan nyt tätä käyttäytymistä kaliumsyanidin ja natriumasetaatin vesiliuosten käyttäytymiseen. Jälleen kerran kationeilla (\(K^+\) ja \(Na^+\)) ei ole olennaisesti mitään hapanta luonnetta, mutta anionit (\(CN^-\) ja \(CH_3CO_2^-\)) ovat heikkoja emäksiä, jotka voivat reagoida veden kanssa, koska ne ovat heikkojen happojen konjugaattiemäksiä \(HCN\) ja etikkahappo, vastaavasti.
\
\
Kumpikaan reaktio ei etene kovin pitkälle oikealle kirjoitettuna, koska heikomman happo-emäsparin muodostumista suositaan. Sekä \(HCN\) että etikkahappo ovat vahvempia happoja kuin vesi, ja hydroksidi on vahvempi emäs kuin joko asetaatti tai syanidi, joten molemmissa tapauksissa tasapaino on vasemmalla. Kummassakin reaktiossa syntyy kuitenkin riittävästi hydroksidi-ioneja emäksisen liuoksen tuottamiseksi. Esimerkiksi 0,1 M natriumasetaatti- tai kaliumsyanidiliuoksen \(pH\) 25 °C:ssa on 8,8 tai 11,1. Taulukoista E1 ja E2 nähdään, että \(CN^-\) on vahvempi emäs (\(pK_b = 4,79\)) kuin asetaatti (\(pK_b = 9,24\)), mikä on sopusoinnussa sen kanssa, että \(KCN\) tuottaa emäksisemmän liuoksen kuin natriumasetaatti samalla konsentraatiolla.
Heikon emäksen konjugaattihapon sen sijaan pitäisi olla heikko happo. Esimerkiksi ammoniumkloridi ja pyridiniumkloridi ovat suoloja, jotka saadaan reagoimalla ammoniakin ja pyridiinin kanssa \(HCl\). Kuten jo tiedät, kloridi-ioni on niin heikko emäs, että se ei reagoi veden kanssa. Sen sijaan näiden kahden suolan kationit ovat heikkoja happoja, jotka reagoivat veden kanssa seuraavasti:
\
\
Kuvasta \(\PageIndex{2}\) nähdään, että \(H_3O^+\) on vahvempi happo kuin \(NH_4^+\) tai \(C_5H_5NH^+\), ja päinvastoin ammoniakki ja pyridiini ovat kumpikin vettä vahvempia emäksiä. Tasapaino on siis molemmissa tapauksissa kaukana vasemmalla, mikä suosii heikompaa happo-emäsparia. Reaktioiden tuottama \(H_3O^+\)-pitoisuus on kuitenkin niin suuri, että liuoksen \(pH\) laskee merkittävästi: 0,10 M:n ammoniumkloridiliuoksen \(pH\) 25 °C:n lämpötilassa on 5,13 ja pyridiniumkloridiliuoksen \(pH\) 3,12.
Mitä tapahtuu ammoniumasetaatin kaltaisen suolan vesiliuoksessa, jossa sekä kationi että anioni voivat reagoida erikseen veden kanssa muodostaen vastaavasti hapon ja emäksen? Kuvan 16.10 mukaan ammoniumioni laskee \(pH\), kun taas kuvan 16.9 mukaan asetaatti-ioni nostaa \(pH\). Tämä tapaus on sikäli epätavallinen, että kationi on yhtä vahva happo kuin anioni on emäs (pKa ≈ pKb). Näin ollen nämä kaksi vaikutusta kumoavat toisensa, ja liuos pysyy neutraalina. Suoloissa, joissa kationi on vahvempi happo kuin anioni on emäs, lopullisen liuoksen \(pH\) < 7,00. Kääntäen, jos kationi on heikompi happo kuin anioni on emäs, lopullisen liuoksen \(pH\) > 7.00.
Hapan metalli-ioni
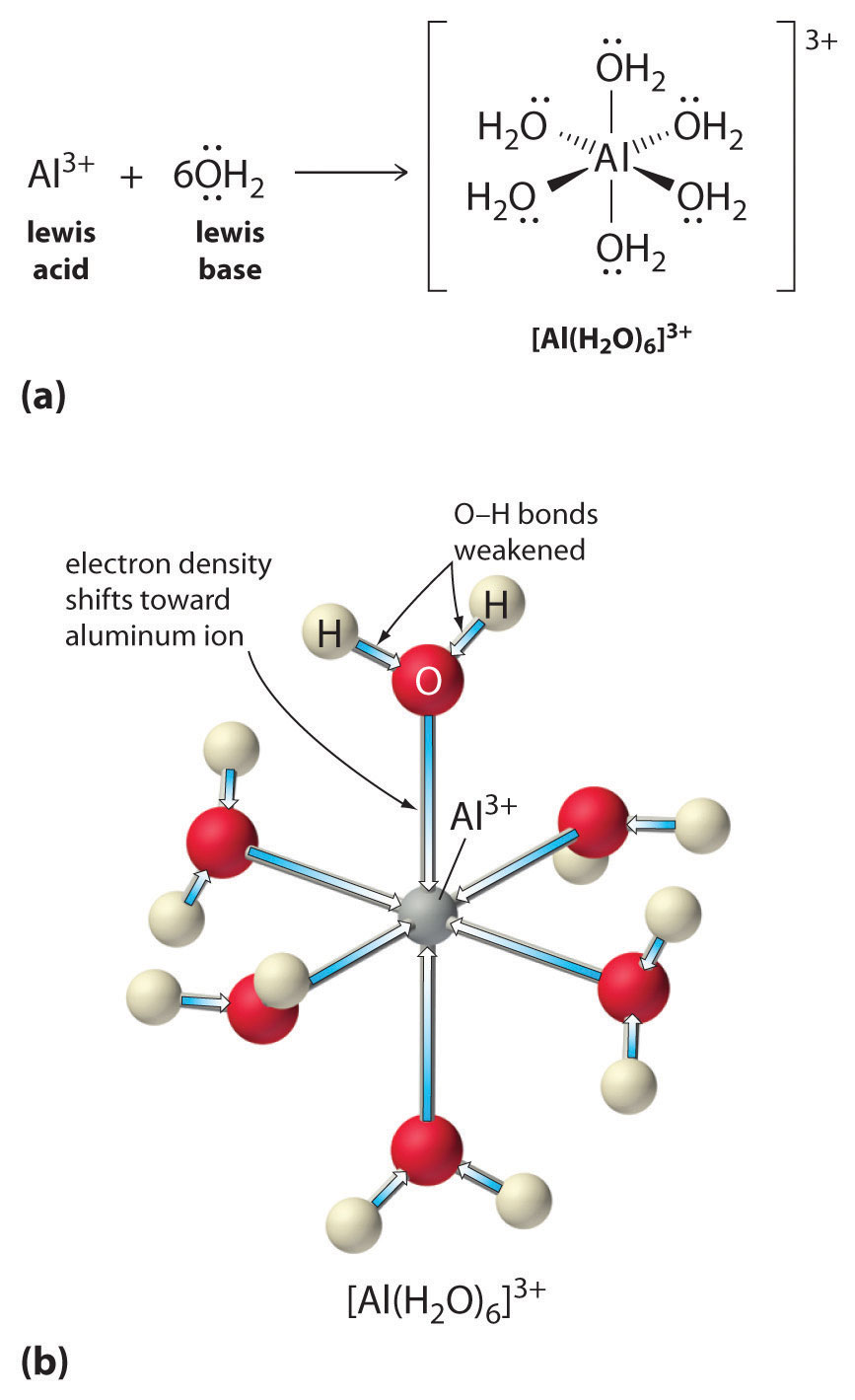
Metalli-ionien yksinkertaisten suolojen liuokset voivat myös olla happamia, vaikka metalli-ioni ei pysty luovuttamaan protonia suoraan veteen tuottaakseen \(H_3O^+\). Sen sijaan metalli-ioni voi toimia Lewisin happona ja olla vuorovaikutuksessa veden, Lewisin emäksen, kanssa koordinoimalla happiatomin yksinäisen elektroniparin kanssa muodostaen hydratoidun metalli-ionin (kuva \(\(\PageIndex{1a}\)). Metalli-ioniin koordinoitu vesimolekyyli on happamampi kuin vapaa vesimolekyyli kahdesta syystä. Ensinnäkin positiivisesti varautuneen metalli-ionin ja koordinoidun vesimolekyylin osittain positiivisesti varautuneiden vetyatomien väliset repulsiiviset sähköstaattiset vuorovaikutukset helpottavat koordinoidun veden protonin menetystä.
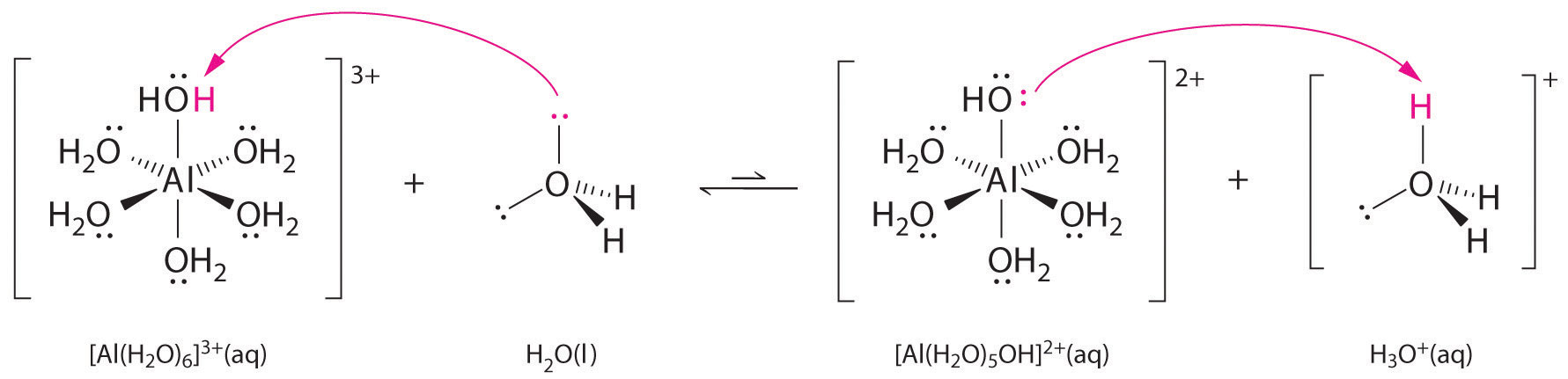
Toisekseen \(Al^{3+}\)-ionin positiivinen varaus vetää puoleensa elektronitiheyttä vesimolekyylien happiatomeista, mikä vähentää elektronitiheyttä \(\ce{O-H}\)-sidoksessa, kuten kuvassa \(\PageIndex{1b}\) on esitetty. Kun \(O\)-atomien ja H-atomien välinen elektronitiheys on pienempi, \(\ce{O-H}\)-sidokset ovat heikompia kuin vapaassa \(H_2O\)-molekyylissä, jolloin \(H^+\)-ionin menettäminen on helpompaa.
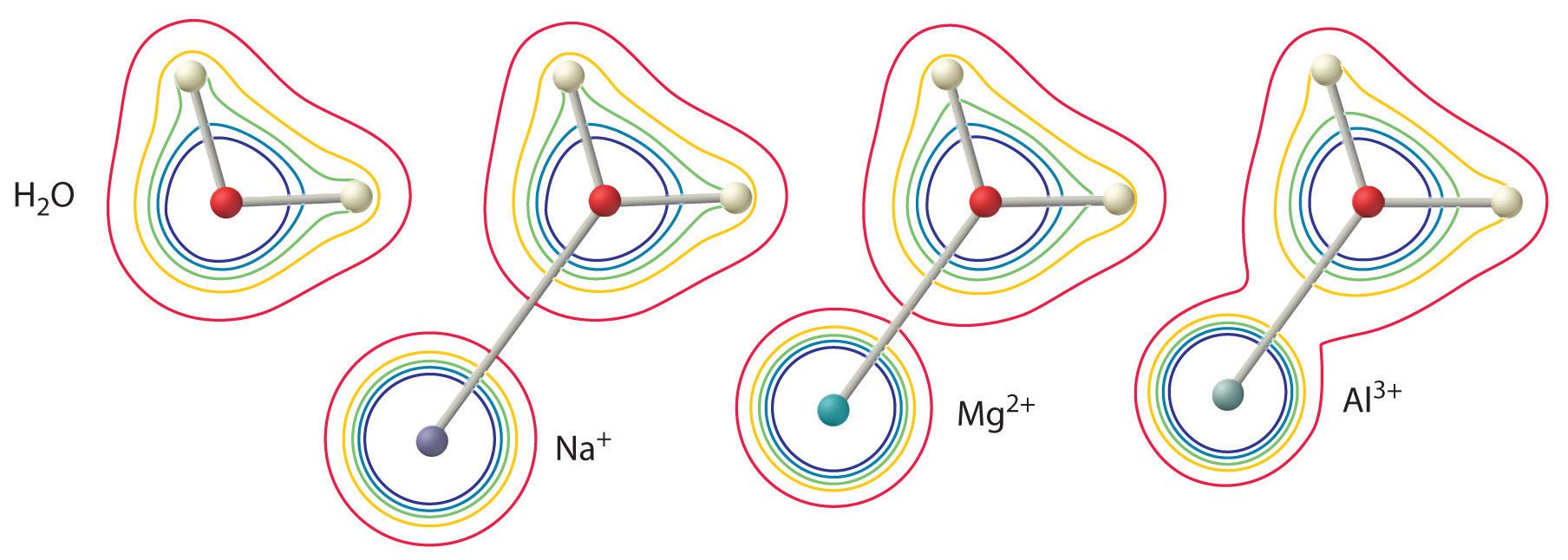
Tämän vaikutuksen suuruus riippuu seuraavista kahdesta tekijästä (kuva \(\PageIndex{3}\)):
- Metalli-ionin varaus. Kaksiarvoisella ionilla (\(M^{2+}\)) on noin kaksi kertaa niin voimakas vaikutus koordinoidun vesimolekyylin elektronitiheyteen kuin saman säteen omaavalla yksiarvoisella ionilla (\(M^+\)).
- Metalli-ionin säde. Saman varauksen omaavilla metalli-ioneilla mitä pienempi ioni on, sitä lyhyempi on sisäydinetäisyys vesimolekyylin happiatomiin ja sitä suurempi on metallin vaikutus elektronitiheysjakaumaan vesimolekyylissä.
Siten pienten, voimakkaasti varautuneiden metalli-ionien, kuten \(Al^{3+}\) ja \(Fe^{3+}\), vesiliuokset ovat happamia:
\^{3+}_(aq)} \rightleftharpoons ^{2+}_{(aq)}+H^+_{(aq)} \label{16.36}\]
\(^{3+}\)-ionin \(pK_a\) on 5,0, joten se on lähes yhtä vahva happo kuin etikkahappo. Edellä kuvattujen kahden tekijän vuoksi tärkein parametri, jonka avulla voidaan ennustaa metalli-ionin vaikutusta koordinoitujen vesimolekyylien happamuuteen, on metalli-ionin varaus-radiussuhde. Useilla metalli-ionipareilla, jotka sijaitsevat jaksollisen järjestelmän diagonaaliviivalla, kuten \(Li^+\) ja \(Mg^{2+}\) tai \(Ca^{2+}\) ja \(Y^{3+}\), on erisuuruiset ja -varautuneet, mutta samankaltaiset varauksen ja säteen suhteet. Tämän seurauksena näillä metalli-ionipareilla on samanlaisia vaikutuksia koordinoitujen vesimolekyylien happamuuteen, ja niillä on usein myös muita merkittäviä kemiallisia yhtäläisyyksiä.
Hapan metalli-ioni
Pienten, vahvasti varautuneiden metalli-ionien liuokset vedessä ovat happamia.
Tässä jaksossa käsiteltyjen kaltaisia reaktioita, joissa suola reagoi veden kanssa muodostaen happaman tai emäksisen liuoksen, kutsutaan usein nimellä hydrolyysitoimenpiteet. Erillisen nimen käyttäminen tämäntyyppisille reaktioille on valitettavaa, koska se antaa ymmärtää, että ne ovat jotenkin erilaisia. Itse asiassa hydrolyysireaktiot ovat vain happo-emäsreaktioita, joissa happo on kationi tai emäs on anioni; ne noudattavat samoja periaatteita ja sääntöjä kuin kaikki muutkin happo-emäsreaktiot.
Hydrolyysi
Hydrolyysireaktio on happo-emäsreaktio.
Esimerkki \(\PageIndex{1}\)
Arvioi, ovatko näiden yhdisteiden vesiliuokset happamia, emäksisiä vai neutraaleja. Vesiliuoksen happamuus tai emäksisyys
Strategia:
- Arvioi kationin ja anionin happo-emäsominaisuudet. Jos kationi on heikko Lewisin happo, se ei vaikuta liuoksen \(pH\) arvoon. Jos kationi on heikon emäksen konjugaattihappo tai suhteellisen voimakkaasti varautunut metallikationi, se kuitenkin reagoi veden kanssa muodostaen happaman liuoksen.
- Jos anioni on vahvan hapon konjugaattiemäs, se ei vaikuta liuoksen \(pH\) arvoon. Jos anioni on kuitenkin heikon hapon konjugaattiemäs, liuos on emäksinen.
Liuos:
a
- Kationilla \(K^+\) on pieni positiivinen varaus (+1) ja suhteellisen suuri säde (koska se on jaksollisen järjestelmän neljännellä rivillä), joten se on hyvin heikko Lewisin happo.
- \(NO_3-\)-anioni on vahvan hapon konjugaattiemäs, joten sillä ei ole olennaisesti emäksistä luonnetta (taulukko 16.1). Näin ollen kationi tai anioni ei reagoi veden kanssa muodostaen \(H^+\) tai \(OH^-\), ja liuos on neutraali.
b.
- \(Cr^{3+}\)-ioni on suhteellisen vahvasti varautunut metallikationi, jonka pitäisi käyttäytyä samoin kuin \(Al^{3+}\)-ionin ja muodostaa 3+-kompleksi, joka käyttäytyy heikon hapon tavoin: \^{3+}_{(aq)} \ce{ <=>>}} Cr(H_2O)_5(OH)]^{2+}_{(aq)} + H^+_({aq)}\]
- \(Br^-\)-anioni on hyvin heikko emäs (se on vahvan hapon \(HBr\) konjugaattiemäs), joten se ei vaikuta liuoksen \(pH\) arvoon. Näin ollen liuos on hapan.
c.
- \(Na^+\)-ioni on \(K^+\)-ionin tavoin hyvin heikko happo, joten sen ei pitäisi vaikuttaa liuoksen happamuuteen.
- Vastakohtaisesti \(SO_4^{2-}\) on heikon hapon \(HSO_4^-\)-ionin \(HSO_4^- \) konjugaattiemäs. Näin ollen \(SO_4^{2-}\)-ioni reagoi veden kanssa kuvan 16.6 osoittamalla tavalla antaen lievästi emäksisen liuoksen.
Harjoitus \(\PageIndex{1}\)
Arvioi, ovatko seuraavien aineiden vesiliuokset happamia, emäksisiä vai neutraaleja.
- \(KI\)
- \(Mg(ClO_4)_2\)
- \(NaHS\)
Vastaus a
neutraali
Vastaus b
hapan
Vastaus c
emäksinen (johtuen mm. \(HS^-\) reagoi veden kanssa muodostaen \(H_2S\) ja \(OH^-\))
Yhteenveto
Suola voi liueta veteen muodostaen neutraalin, emäksisen tai happaman liuoksen riippuen siitä, sisältääkö se anionina heikon hapon konjugoitua emästä (\(A^-\)), kationina heikon emäksen konjugoitua happoa (\(BH^+\)) vai molempia. Pieniä, voimakkaasti varautuneita metalli-ioneja sisältävät suolat tuottavat happamia liuoksia veteen. Suolan reaktiota veden kanssa happaman tai emäksisen liuoksen tuottamiseksi kutsutaan hydrolyysireaktioksi.