Cuando el hidrógeno está unido covalentemente a un átomo altamente electronegativo, como el flúor, el cloro, el oxígeno o el nitrógeno, el átomo de H tiene una carga positiva parcial, escrita Hδ+.
El Hδ+ es físicamente muy pequeño, por lo que la densidad de carga en él es inusualmente alta.
Imagina que otro átomo negativo o electronegativo, digamos en una molécula diferente, se acerca al Hδ+; habrá una atracción mutua, resultando en una atracción dipolo-dipolo particularmente fuerte.Esta atracción se llama enlace de hidrógeno.
En general, los enlaces de hidrógeno son más débiles que los enlaces iónicos y covalentes, pero son más fuertes que las fuerzas de van der Waals.

Enlace de hidrógeno en el agua
El ejemplo más conocido de enlace de hidrógeno es el agua:
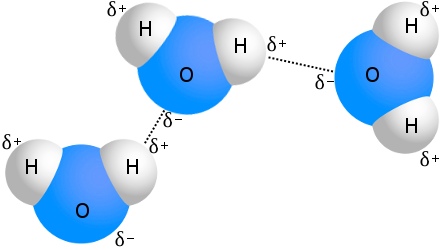
Cada molécula de agua puede estar unida por enlace de hidrógeno hasta con otras cuatro moléculas de agua.En el agua a temperatura ambiente, el número medio de enlaces de hidrógeno por molécula de agua es de 3,6.
El movimiento térmico aleatorio de las moléculas garantiza que la vida de cualquier enlace de hidrógeno individual en el agua sea corta, con una media de sólo 10 picosegundos.Sin embargo, el tiempo para formar un nuevo enlace es aún más corto.
Para romper permanentemente un solo enlace de hidrógeno en el agua se necesitan 21 kJ mol-1, un importante aporte de energía.El resultado es que los puntos de fusión y ebullición del agua son mucho más altos de lo que cabría esperar para un núcleo de tan bajo peso molecular.
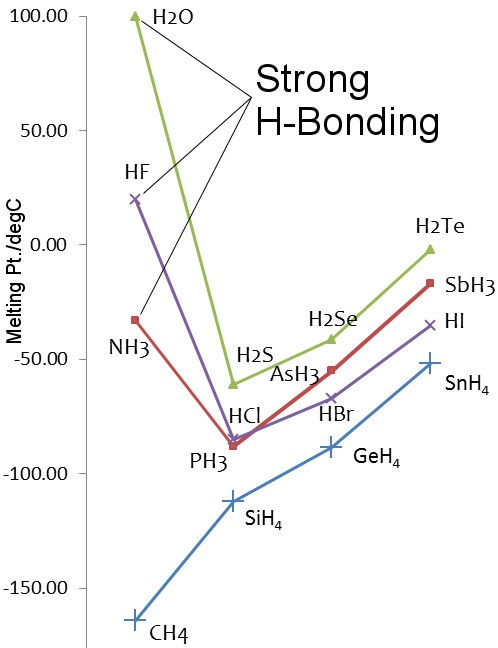
Considere el agua vs. el metano.Las moléculas de agua se atraen bastante fuertemente entre sí mediante enlaces de hidrógeno, mientras que las fuerzas de van der Waals prevalecen en el metano.Así, aunque sus masas moleculares son similares, de 18 para el agua y 16 para el metano, sus propiedades físicas son muy diferentes.Por ejemplo, el agua se funde a 0,00 °C y hierve a 99,98 °C; el metano se funde a -182,5 °C y hierve a -161,5 °C.
El enlace de hidrógeno en el agua frente al sulfuro de hidrógeno
El azufre está en el grupo 16 de la tabla periódica, igual que el oxígeno. El azufre es más pesado que el oxígeno, por lo que el H2S debería tener puntos de fusión y ebullición más altos que el H2O.Sin embargo, esto no es así porque el azufre es menos electronegativo que el oxígeno, y por lo tanto el enlace de hidrógeno en el H2S es débil.

Mol. Masa: 16
Pt. de fusión: 0,00 °C
Pt. de ebullición: 99,98 °C
Electronegatividad del O (Pauling): 3,44
Entalpía de enlace del hidrógeno: 21 kJ mol-1

Mol. Mass: 34
Pt. de fusión: -82 °C
Pt. de ebullición: -60 °C
Electronegatividad del S (Pauling): 2.58
Entalpía de enlace de hidrógeno: ≅ 3 kJ mol-1
Enlace de hidrógeno en amoníaco y fluoruro de hidrógeno
El flúor y el nitrógeno son los elementos más electronegativos en sus grupos de la tabla periódica, y el enlace de hidrógeno se observa en el fluoruro de hidrógeno y el amoníaco.
Como en el caso del agua, los puntos de fusión y ebullición del fluoruro de hidrógeno y del amoníaco son más altos que los de los hidruros de los elementos más pesados de sus grupos.
Puntos de fusión de los hidruros de los elementos del grupo 14-17
El enlace de hidrógeno en el ADN
Los pares de bases del ADN unen sus dos cadenas helicoidales.
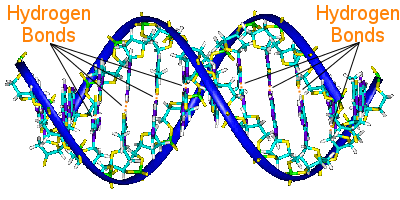
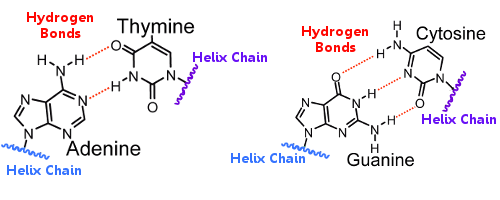
Los pares de bases de una hélice están unidos a los pares de bases de la otra hélice mediante enlaces de hidrógeno.Así, el enlace de hidrógeno mantiene las hélices unidas, creando la famosa doble hélice.
Cuando el ADN se replica, los enlaces de hidrógeno se rompen, permitiendo que las dos hélices se separen.De esta manera, el enlace de hidrógeno juega un papel esencial en el mecanismo de bloqueo de pares de bases de la replicación del ADN.
Enlace de hidrógeno en la lana
Al igual que otras fibras proteicas, la lana presenta enlaces de hidrógeno.La imagen siguiente muestra cómo los enlaces de hidrógeno (puntos naranjas) enlazan las bobinas de la cadena de hélices α de la lana (verde).
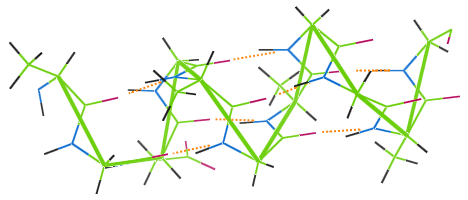
Si una prenda de lana se lava a alta temperatura, los enlaces de hidrógeno se destruyen, las bobinas pierden su elasticidad y la prenda se estropea.
