Wasserchemie 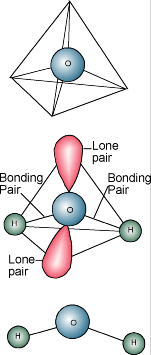 Sie wissen wahrscheinlich, dass die chemische Bezeichnung von Wasser H2O ist. Ein Wassermolekül besteht aus einem Sauerstoffatom, das an zwei Wasserstoffatome gebunden ist. Die Wasserstoffatome sind an eine Seite des Sauerstoffatoms „gebunden“, so dass das Wassermolekül auf der Seite mit den Wasserstoffatomen positiv und auf der anderen Seite mit dem Sauerstoffatom negativ geladen ist. Da sich entgegengesetzte elektrische Ladungen anziehen, neigen Wassermoleküle dazu, sich gegenseitig anzuziehen, wodurch Wasser eine Art „klebrig“ wird. Die Seite mit den Wasserstoffatomen (positive Ladung) zieht die Sauerstoffseite (negative Ladung) eines anderen Wassermoleküls an.
Sie wissen wahrscheinlich, dass die chemische Bezeichnung von Wasser H2O ist. Ein Wassermolekül besteht aus einem Sauerstoffatom, das an zwei Wasserstoffatome gebunden ist. Die Wasserstoffatome sind an eine Seite des Sauerstoffatoms „gebunden“, so dass das Wassermolekül auf der Seite mit den Wasserstoffatomen positiv und auf der anderen Seite mit dem Sauerstoffatom negativ geladen ist. Da sich entgegengesetzte elektrische Ladungen anziehen, neigen Wassermoleküle dazu, sich gegenseitig anzuziehen, wodurch Wasser eine Art „klebrig“ wird. Die Seite mit den Wasserstoffatomen (positive Ladung) zieht die Sauerstoffseite (negative Ladung) eines anderen Wassermoleküls an.
Alle diese Wassermoleküle, die sich gegenseitig anziehen, neigen dazu, sich zu verklumpen. Das ist der Grund, warum Wassertropfen tatsächlich Tropfen sind! Gäbe es nicht einige Kräfte auf der Erde, wie die Schwerkraft, wäre ein Wassertropfen kugelförmig – eine perfekte Kugel. Auch wenn es auf der Erde keine perfekte Kugel bildet, sollten wir froh sein, dass Wasser klebrig ist.
Wasser wird das „universelle Lösungsmittel“ genannt, weil es mehr Stoffe löst als jede andere Flüssigkeit. Das bedeutet, dass Wasser überall, wo es hingeht, sei es durch den Boden oder durch unseren Körper, wertvolle Chemikalien, Mineralien und Nährstoffe mitnimmt.
Reines Wasser hat einen neutralen pH-Wert. Reines Wasser hat einen pH-Wert von etwa 7, der weder sauer noch basisch ist.
Physikalische Eigenschaften des Wassers:
Wasser ist einzigartig, da es die einzige natürliche Substanz ist, die in allen drei Zuständen – flüssig, fest (Eis) und gasförmig (Dampf) – bei den auf der Erde üblichen Temperaturen vorkommt. Das Wasser auf der Erde ist in ständiger Wechselwirkung, Veränderung und Bewegung.
 Wasser gefriert bei 32° Fahrenheit (F) und kocht bei 212° F. Die Gefrier- und Siedepunkte von Wasser sind die Grundlage für die Messung der Temperatur: 0° auf der Celsius-Skala ist der Gefrierpunkt von Wasser, und 100° ist der Siedepunkt von Wasser. Eine Besonderheit des Wassers ist, dass die feste Form, das Eis, eine geringere Dichte hat als die flüssige Form, weshalb das Eis schwimmt.
Wasser gefriert bei 32° Fahrenheit (F) und kocht bei 212° F. Die Gefrier- und Siedepunkte von Wasser sind die Grundlage für die Messung der Temperatur: 0° auf der Celsius-Skala ist der Gefrierpunkt von Wasser, und 100° ist der Siedepunkt von Wasser. Eine Besonderheit des Wassers ist, dass die feste Form, das Eis, eine geringere Dichte hat als die flüssige Form, weshalb das Eis schwimmt.
Wasser hat einen hohen spezifischen Wärmeindex. Das bedeutet, dass Wasser sehr viel Wärme aufnehmen kann, bevor es heiß wird. Deshalb ist Wasser in der Industrie und im Kühler deines Autos als Kühlmittel so wertvoll. Der hohe spezifische Wärmeindex von Wasser trägt auch dazu bei, die Geschwindigkeit des Temperaturwechsels in der Luft zu regulieren, weshalb der Temperaturwechsel zwischen den Jahreszeiten allmählich und nicht plötzlich erfolgt, insbesondere in der Nähe der Ozeane.
Wasser hat eine sehr hohe Oberflächenspannung. Mit anderen Worten: Wasser ist klebrig und elastisch und neigt dazu, in Tropfen zu verklumpen, anstatt sich in einem dünnen Film auszubreiten. Die Oberflächenspannung ist für die Kapillarwirkung verantwortlich, die es dem Wasser (und den darin gelösten Stoffen) ermöglicht, sich durch die Wurzeln von Pflanzen und durch die winzigen Blutgefäße in unserem Körper zu bewegen.
Wassertemperatur:
Die Wassertemperatur ist nicht nur für Schwimmer und Angler wichtig, sondern auch für die Industrie und sogar für Fische und Algen. In Kraftwerken, die Strom erzeugen, wird viel Wasser für Kühlzwecke verwendet. Sie benötigen zunächst kühles Wasser und geben in der Regel wärmeres Wasser wieder an die Umwelt ab. Die Temperatur des abgeleiteten Wassers kann sich auf die flussabwärts gelegenen Lebensräume auswirken. Die Temperatur kann sich auch auf die Fähigkeit des Wassers auswirken, Sauerstoff zu speichern, sowie auf die Fähigkeit von Organismen, bestimmten Schadstoffen zu widerstehen.
pH:
Der pH-Wert gibt an, wie sauer/basisch das Wasser ist. Der Bereich reicht von 0 bis 14, wobei 7 neutral ist. pH-Werte unter 7 weisen auf Säure hin, während ein pH-Wert über 7 auf eine Base hinweist. Der pH-Wert ist ein Maß für die relative Menge an freien Wasserstoff- und Hydroxyl-Ionen im Wasser. Wasser, das mehr freie Wasserstoffionen enthält, ist sauer, während Wasser mit mehr freien Hydroxylionen basisch ist. Da der pH-Wert durch Chemikalien im Wasser beeinflusst werden kann, ist er ein wichtiger Indikator für Wasser, das sich chemisch verändert. Der pH-Wert wird in „logarithmischen Einheiten“ angegeben, ähnlich wie die Richterskala zur Messung von Erdbeben. Jede Zahl steht für eine 10-fache Veränderung des Säuregrads bzw. des Basengehalts des Wassers. Wasser mit einem pH-Wert von 5 ist zehnmal saurer als Wasser mit einem pH-Wert von sechs.
Verschmutzungen können den pH-Wert eines Wassers verändern, was wiederum den im Wasser lebenden Tieren und Pflanzen schaden kann. Wasser aus einer stillgelegten Kohlemine kann zum Beispiel einen pH-Wert von 2 haben, was sehr sauer ist und jeden Fisch schädigen würde, der verrückt genug ist, in diesem Wasser zu leben! Wenn man die Logarithmusskala anwendet, wäre dieses Grubenwasser 100.000 Mal saurer als neutrales Wasser – also halte dich von verlassenen Minen fern.
Spezifische Leitfähigkeit:
Die spezifische Leitfähigkeit ist ein Maß für die Fähigkeit von Wasser, einen elektrischen Strom zu leiten. Sie hängt stark von der Menge der gelösten Feststoffe (wie Salz) im Wasser ab. Reines Wasser, z. B. destilliertes Wasser, hat eine sehr niedrige spezifische Leitfähigkeit, während Meerwasser eine hohe spezifische Leitfähigkeit aufweist. Regenwasser löst oft Gase und Staub aus der Luft, während es sich in der Luft befindet, und hat daher oft eine höhere spezifische Leitfähigkeit als destilliertes Wasser. Die spezifische Leitfähigkeit ist ein wichtiges Maß für die Wasserqualität, da sie einen guten Eindruck von der Menge der gelösten Stoffe im Wasser vermittelt.
Wahrscheinlich hast du in der Schule das Experiment gemacht, bei dem du eine Batterie an eine Glühbirne anschließt und zwei Drähte von der Batterie in ein Becherglas mit Wasser führst. Wenn die Drähte in ein Becherglas mit destilliertem Wasser gelegt werden, leuchtet die Lampe nicht. Die Glühbirne leuchtet jedoch auf, wenn das Becherglas Salzwasser (Kochsalzlösung) enthält. Im Salzwasser hat sich das Salz aufgelöst und freie Elektronen freigesetzt, so dass das Wasser einen elektrischen Strom leitet.
Trübung:
Trübung ist ein Maß für die Trübung von Wasser. Sie wird gemessen, indem man einen Lichtstrahl durch das Wasser schickt und sieht, wie viel von den Partikeln im Wasser reflektiert wird. Die Wassertrübung wird durch Stoffe verursacht, die im Wasser schweben (z. B. Schmutz und Rückstände von Blättern). Kristallklares Wasser wie der Lake Tahoe (wo man hart daran arbeitet, dass keine Sedimente in den See gespült werden) hat eine sehr geringe Trübung. Aber schauen Sie sich einen Fluss nach einem Sturm an – er ist wahrscheinlich braun. Sie sehen den ganzen Schwebstoff im Wasser. Zum Glück für uns setzen sich die Stoffe, die die Trübung unseres Trinkwassers verursachen, entweder ab oder werden gefiltert, bevor das Wasser in unser Trinkglas zu Hause gelangt. Die Trübung wird in nephelometrischen Trübungseinheiten (NTU) gemessen.
Gelöster Sauerstoff:
Wassermoleküle enthalten zwar ein Sauerstoffatom, aber dieser Sauerstoff wird von den in unseren natürlichen Gewässern lebenden Wasserorganismen nicht benötigt. Eine kleine Menge Sauerstoff, bis zu zehn Sauerstoffmoleküle pro Million Wasser, ist tatsächlich im Wasser aufgelöst. Dieser gelöste Sauerstoff wird von Fischen und Zooplankton eingeatmet und von ihnen zum Überleben benötigt.
Schnell fließendes Wasser, wie in einem Gebirgsbach oder einem großen Fluss, enthält in der Regel viel gelösten Sauerstoff, während stehendes Wasser wenig enthält. Der Prozess, bei dem Bakterien im Wasser die Zersetzung von organischem Material unterstützen, das beispielsweise aus einer Kläranlage stammt, verbraucht Sauerstoff. Ein Übermaß an organischem Material in unseren Seen und Flüssen kann daher zu einer Sauerstoffmangelsituation führen. Wasserlebewesen haben es in stehendem Wasser mit viel verrottendem organischem Material schwer, besonders im Sommer, wenn der Gehalt an gelöstem Sauerstoff saisonal niedrig ist.
Härte:
Die Menge an gelöstem Kalzium und Magnesium im Wasser bestimmt seine „Härte“. Die Wasserhärte variiert in den Vereinigten Staaten. Wenn Sie in einem Gebiet leben, in dem das Wasser „weich“ ist, dann haben Sie vielleicht noch nie etwas von Wasserhärte gehört. Wenn Sie jedoch in Florida, New Mexico, Arizona, Utah, Wyoming, Nebraska, South Dakota, Iowa, Wisconsin oder Indiana leben, wo das Wasser relativ hart ist, werden Sie vielleicht feststellen, dass es schwierig ist, beim Händewaschen oder Wäschewaschen einen Schaum zu erzeugen. Und die Unternehmen in Ihrer Region müssen möglicherweise Geld ausgeben, um ihr Wasser zu enthärten, da hartes Wasser die Anlagen beschädigen kann. Hartes Wasser kann sogar die Lebensdauer von Textilien und Kleidung verkürzen! Heißt das, dass Schüler, die in Gegenden mit hartem Wasser leben, mit der neuesten Mode nicht Schritt halten können, weil ihre Kleidung schneller verschlissen ist?
Suspendiertes Sediment:
Suspendiertes Sediment ist die Menge an Boden, die sich in einem Fluss bewegt. Sie hängt stark von der Fließgeschwindigkeit des Wassers ab, denn schnell fließendes Wasser kann mehr Boden mitnehmen und suspendieren als ruhiges Wasser. Bei Stürmen wird Boden von den Ufern in den Bach gespült. Die Menge, die in einen Bach gespült wird, hängt von der Art des Bodens im Einzugsgebiet des Flusses und der den Fluss umgebenden Vegetation ab.
Wenn der Boden entlang eines Baches gestört wird und keine Schutzmaßnahmen ergriffen werden, kann überschüssiges Sediment die Wasserqualität eines Baches beeinträchtigen. Wahrscheinlich haben Sie schon einmal diese kurzen Plastikzäune gesehen, die Bauherren an den Rändern der Grundstücke aufstellen, die sie erschließen. Diese Schlammzäune sollen bei einem Regenschauer Sedimente auffangen und verhindern, dass sie in einen Bach gespült werden, denn überschüssige Sedimente können Bäche, Flüsse, Seen und Stauseen schädigen.
Sedimente, die in einen Stausee gelangen, sind immer ein Problem; wenn sie erst einmal hineingelangt sind, können sie nicht mehr herausgelangen – das meiste davon setzt sich auf dem Grund ab. Stauseen können „verschlammen“, wenn zu viele Sedimente in sie gelangen. Das Volumen des Stausees verringert sich, was zu einer geringeren Fläche für Bootsfahrten, Angeln und Freizeitaktivitäten führt und die Stromerzeugungskapazität des Kraftwerks im Damm verringert.
Geochemie der wässrigen Lösung:
Schauen Sie sich ein Diagramm des hydrogeochemischen Kreislaufs an.
- Säure = wasserstoffhaltige Substanz, die in Wasser gelöst freien Wasserstoff (H + ) ergibt
- Base = Substanz, die die OH-Gruppe enthält und in Wasser gelöst freien (OH – ) ergibt
-
Eine saure Lösung ist eine, die einen Überschuss an freiem H + enthält, und eine Base ist eine, die einen Überschuss an freiem OH – enthält. Eine Reaktion zwischen einer Säure und einer Base wird gewöhnlich als Neutralisation bezeichnet.
Zum Beispiel:
-
HCl (Säure) + NaOH (Base) ==> H 2 O + NaCl
, die in Ionen dissoziiert werden:
H + + Cl – + Na + + OH – ==> H 2 O + Na + + Cl – - d.h. Na + und Cl – bleiben unberührt.
- pH = inverser Logarithmus der Konzentration (Aktivität) des freien H + , oder pH = -log
-
Wasser dissoziiert in H + und OH – ;
-
die Dissoziationskonstante ist: K Wasser = =10 -14
- In einem Kilogramm neutraler Lösung bei der Standardtemperatur von 25°C müssen sich also je 10 -7 Mol H+ und OH – befinden. Ein Mol sind 6,023 x 10 23 Atome (oder Moleküle) und H 2 O hat ein Molekulargewicht von 18 Gramm pro Mol. Ein Kilogramm Wasser enthält etwa 1000/18 = 55,6 Mol Wasser oder etwa 3,35 x 10 25 Atome Sauerstoff und etwa doppelt so viele (6,7 x 10 25 Atome) H + (die Menge an freiem H + oder freiem OH – ist relativ klein im Vergleich zur Menge an undissoziiertem H 2 O).
- Der pH-Wert reicht bei 25°C von 0 bis 14; pH < 7 = saure Lösung; pH > 7 = basische Lösung. Wird HCl oder eine andere Säure zugegeben, sinkt der pH-Wert; wird NaOH oder eine andere Base zugegeben, steigt der pH-Wert.
- Der pH-Wert steigt, wenn Kohlensäure (eine schwache Säure) dissoziiert: Wenn sich Kohlendioxid mit Wasser verbindet, wie es in der Atmosphäre bei der Verbrennung fossiler Brennstoffe geschieht, bildet sich Kohlensäure: H 2 O + CO 2 ==> H 2 CO 3 . Bei aufeinanderfolgenden Dissoziationen wird freies H + verfügbar gemacht:
-
H 2 CO 3 ==> H + + HCO 3- Kohlensäure zu Bicarbonat, entsteht bei pH ~6,4
-
HCO 3 ==> H + + CO 32- Bicarbonat zu Carbonat, entsteht bei pH ~10.3
Denken Sie daran, dass freies H + nur im sauren Bereich oder bei einem pH-Wert < ~7 verfügbar ist. Die Dissoziation von Bicarbonat zu Carbonat erfolgt, wenn zu viel OH – im System vorhanden ist und H + „freigesetzt“ wird, um die Base auszugleichen.
- Gelöste Kationen und Anionen im Wasser
Kationen = Elektronendonatoren, positiv geladen: Na + , K + , Mg ++ , Ca ++ , Fe ++ oder Fe +++ , Mn ++ , Al +++
Anionen = Elektronenakzeptoren, neg. geladen: Cl – , F – , I – , Br – , SO 4– , CO 3– , HCO 3- , NO 3– , NO 2-
Metalle = verhalten sich meist wie Kationen: Cu, Zn, Pb, Co, Ni, Cr, As, Se, Mo, etc.
- Wasseranalysen – Notwendigkeit einer Kationen-Anionen-Bilanz
Milliäquivalent (MEQ) = moläquivalente Ladung oder Anion oder Kation, Maß für die Gesamtladung durch das betreffende Ion in der Lösung gelöst. Man beginnt mit der Konzentration, dividiert durch das Molgewicht und multipliziert mit der Ladung: XX mg/L / MW x CHG = MEQ
Beispiel: NaCl in Lösung, Na = 50 mg/L (50 ppm): 50/23 x 1 = 2,17 MEQ
Cl = 77 mg/L (77 ppm): 77/35,5 x -1 = -2,17 MEQ
Wenn also die Gesamt-MEQs von Kationen und Anionen nicht ausgeglichen sind, liegt ein Fehler in der Analyse vor.