Intrazelluläre Signale, wie z.B. Schäden an der DNA der Zelle, treiben die Apoptose hauptsächlich über den intrinsischen Weg an. Der intrinsische Apoptoseweg, an dem konservierte Signalproteine beteiligt sind, ist physisch mit Mitochondrien verbunden und reagiert bei Wirbeltieren empfindlich auf mitochondrialen oxidativen Stress. Der Weg wird von Mitgliedern der Bcl-Familie beeinflusst, die an die mitochondriale Membran gebunden sind, einschließlich der Gene Bax und Bcl-2, die als pro- bzw. anti-apoptotische Regulierungsproteine wirken.
Überblick über den intrinsischen Apoptoseweg
Der intrinsische Apoptoseweg wird beispielsweise durch Chemo- und/oder Strahlentherapie ausgelöst. Er wird durch eine Reihe von exogenen und endogenen Stimuli wie DNA-Schäden, Ischämie und oxidativen Stress aktiviert. Darüber hinaus spielt er eine wichtige Rolle in der Entwicklung und bei der Beseitigung geschädigter Zellen.
Beim intrinsischen Weg ist die funktionelle Folge der pro-apoptotischen Signalgebung eine Störung der mitochondrialen Membran und die Freisetzung von Cytochrom c im Zytoplasma, wo es einen Komplex oder ein Apoptosom mit dem apoptotischen Protease-Aktivierungsfaktor 1 (APAF1) und der inaktiven Form von Caspase-9 bildet. Dieser Komplex hydrolysiert Adenosintriphosphat, um Caspase-9 zu spalten und zu aktivieren. Die Initiator-Caspase-9 spaltet und aktiviert dann die Ausführungs-Caspasen-3/6/7, was zur Apoptose der Zelle führt. Dies unterscheidet sich völlig von den extrazellulären Signalen, die in der Regel von zytotoxischen Zellen des Immunsystems erzeugt werden und die Apoptose hauptsächlich über den extrinsischen Weg auslösen.
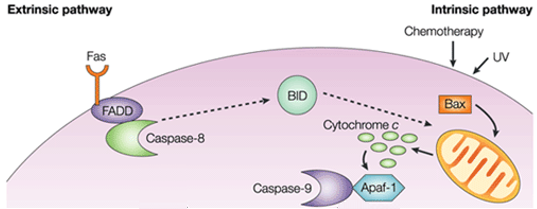
Abbildung 1. Unterschied zwischen extrinsischem Weg und intrinsischem Weg.
Prozess und Regulierung des intrinsischen Apoptosewegs
Der intrinsische Apoptoseweg induziert die Apoptose durch direkte Aktivierung von Caspase-3 oder durch Spaltung von Bid (BH3-interaktiver Domänen-Todesagonist), was zu mitochondrialer Dysfunktion und anschließender Freisetzung von Cytochrom c und Aktivierung von Caspasen-9 und Caspasen-3 führt. Caspase-3 fördert die typischen Apoptose-Merkmale, einschließlich DNA-Fragmentierung und Zelltod in verschiedenen Geweben.
Die B-Zell-Lymphom 2 (Bcl-2)-Proteinfamilie steuert die Aktivierung des intrinsischen Weges engmaschig. Sie ist in follikulären Lymphomen zu finden und wurde erstmals als eines der Gene identifiziert, die am Zelltod beteiligt sind, indem sie entweder die pro-apoptotische oder die anti-apoptotische Apoptose hemmen. Die Proteine einer Untergruppe, darunter Bid, Bad, Bim, Bmf, Puma und Noxa, enthalten eine einzige Bcl-2-Homologie-3-Domäne (BH3-only-Proteine) und haben eine pro-apoptotische Aktivität. Zwei andere Proteinuntergruppen haben mehrere BH-Domänen. Die erste Untergruppe, zu der das Bcl-2-assoziierte X-Protein (Bax), der Bcl-2-homologe Antagonist/Killer (Bak) und der Apoptoseregulator der Bcl-2-Familie (Bok) gehören, ist pro-apoptotisch; die andere Untergruppe, zu der Bcl-2, Bcl-XL und Mcl-1 gehören, ist anti-apoptotisch. Der mitochondriale Weg wird teilweise durch Mitglieder der Bcl-Familie beeinflusst, die an die mitochondriale Membran gebunden sind, darunter sowohl pro-apoptotische regulatorische Proteine Bax als auch anti-apoptotische regulatorische Proteine Bcl-2.
Die pro-apoptotischen Moleküle bewirken eine Permeabilisierung der äußeren mitochondrialen Membran, was zu einem Ausfluss von Cytochrom c führt, das den Adaptor Apaf-1 und den Initiator Caspase-9 im Zytosol bindet, um den Apoptosom-Komplex zu bilden. Dadurch wird die Caspase-9 stimuliert, die ihrerseits die Effektor-Caspasen aktiviert. Das Mitochondrium setzt auch ein Protein namens Smac/DIABLO in das Zytosol frei. Smac/DIABLO fördert indirekt die Apoptose, indem es die Wirkung einer Gruppe anti-apoptotischer Proteine, der so genannten Inhibitor-of-Apoptosis-Proteine (IAPs), blockiert.
Die anti-apoptotischen Proteine Bcl-2 und Bcl-XL hemmen die Freisetzung von Cytochrom c, während Bax, Bak und Bid, allesamt pro-apoptotische Proteine, die Freisetzung aus den Mitochondrien fördern. Cytochrom c und Desoxyadenosintriphosphat (dATP) binden sich an APAF-1 und bilden einen multimeren Komplex, der Pro-Caspase-9 rekrutiert und aktiviert, eine Apoptose-vermittelnde Exekutionsprotease, die wiederum die Caspase-Kaskade aktiviert, was zur Zellapoptose führt. Während dieses Prozesses sind Caspase-2, Caspase-8, Caspase-9 und Caspase-10 an der Auslösung der Apoptose beteiligt. Caspase-3, Caspase-6 und Caspase-7 sind an der Apoptose beteiligt. Caspase-3 und Caspase-7 regulieren die Hemmung der DNA-Reparatur und leiten den DNA-Abbau ein. Darüber hinaus reguliert Caspase-6 den Abbau der Lamina und des Zytoskeletts.
Intrinsischer Apoptoseweg in der Pathophysiologie
Die meisten chemotherapeutischen und gezielten Krebstherapien töten Tumorzellen durch die Erzeugung von Pro-Tod-Signalen, die den intrinsischen apoptotischen Weg des programmierten Zelltods einleiten. Der Punkt ohne Wiederkehr in der apoptotischen Kaskade ist die mitochondriale Außenmembran-Permeabilisierung (MOMP). Sobald sie eingetreten ist, führt die mitochondriale Permeabilisierung zur Bildung eines Apoptosoms, das die Caspase-Aktivierung erleichtert und anschließend die anderen Kennzeichen des apoptotischen Zelltods auslöst. Die zelluläre Entscheidung, MOMP zu initiieren, wird durch ein empfindliches Gleichgewicht zwischen den pro- und anti-apoptotischen Molekülen der BCL-2-Familie gesteuert.
Einer der Gründe für Chemotherapieresistenz ist, dass Tumorzellen aufgrund von Defekten im intrinsischen apoptotischen Weg (z. B. Veränderungen von p53) nicht in die Apoptose übergehen. Trotz erheblicher Verbesserungen in der Behandlung sind die Heilungsraten bei vielen Krebsarten nach wie vor suboptimal. Der Aufschwung der zytotoxischen Chemotherapie hat dazu geführt, dass eine Untergruppe von Krebsarten geheilt werden kann, obwohl die intrinsische Therapieresistenz bei einzelnen Patienten schwer vorherzusagen ist. Die Welle der molekularen zielgerichteten Therapien hat sich auf die Mutationen konzentriert, die den Wirkstoff aktivieren, und ist daher auf bestimmte Untergruppen von Patienten beschränkt. Der intrinsische mitochondriale Apoptoseweg stellt ein vielversprechendes Ziel für neue Therapien dar, und die erfolgreiche Beeinflussung dieses Weges hat das Potenzial, die therapeutische Landschaft für eine Vielzahl von Krebsarten zu verändern.