Thomas A. Oetting, MS, MD
Die Konversion zur extrakapsulären Kataraktextraktion (ECCE) kommt oft zu einem schwierigen Zeitpunkt. Die Linse ist im Begriff, nach Süden zu fallen, der Glaskörper ist vorgefallen und der Chirurg ist gestresst. Es ist wichtig, die Schritte und den Prozess der Umstellung auf ECCE zu verstehen, und ein Studium vor der Krise wird helfen, den Stress zu lindern, wenn dieser unvermeidliche Prozess eintritt. Wir werden mehrere Bereiche abdecken: Identifizierung von Patienten, bei denen das Risiko besteht, dass eine Umstellung auf ECCE erforderlich ist, Indikationen für eine Umstellung, Umstellung von topischem auf sub-Tenon, Wundvorbereitung, Ausdrücken des Linsenmaterials, Verschluss der Wunde, Platzierung der IOL, postoperative Probleme und ein kurzer Abschnitt über die anteriore Vitrektomie.
Patienten mit dem Risiko einer Konversion zu ECCE: Einer der wichtigsten Teile des präoperativen Prozesses bei Kataraktpatienten besteht darin, die Faktoren zu bewerten, die die chirurgischen Schwierigkeiten erhöhen, die zu einer Konversion zu ECCE führen oder das Verfahren anderweitig komplizieren können.Sie sollten Ihren Zeitplan für die Operation erweitern oder zusätzliche Ausrüstung anfordern. Möglicherweise möchten Sie zu einer superioren Limbuswunde wechseln, die die Umstellung auf eine ECCE erleichtert, anstatt einen temporalen klaren Hornhautschnitt vorzunehmen. Möglicherweise möchten Sie eine retrobulbäre Blockade anstelle einer Lokalanästhesie durchführen, da der Fall länger dauern oder sich komplizierter gestalten kann. In manchen Situationen sollten Sie aufgrund der präoperativen Risikofaktoren in Erwägung ziehen, einen erfahreneren Arzt mit dem Eingriff zu beauftragen.
Schwierigkeitsfaktoren (in abnehmender Reihenfolge der Wichtigkeit)1
- Zonuläre Laxität (Pseudoexfoliation-PXF, Trauma in der Vorgeschichte, Marfan-Syndrom usw.)
- Rockharte Linse (rote oder schwarze Linse)
- Pupillengröße (warum ist sie klein? PXF, Diabetes s/p Laser, zentrale hintere Synechien – CPS, schlaff durch Tamsulosin/Flomax)
- Kann nicht sehr lange flach liegen (z. B. Chronisch obstruktive Lungenerkrankung (COPD), Klaustrophobie, Tremor, starkes Übergewicht)
- Große Augenbraue, die den oberen Zugang einschränkt
- Enger Winkel, der den Raum der vorderen Augenkammer (AC) einschränkt
- Prädisposition für Hornhautdekompensation: (z.B.. Fuch’s Dystrophie oder Hornhautguttata, PPMD, harter Kern)
- Schwacher roter Reflex, weißer/schwarzer Katarakt, der eine kontinuierliche kurvilineare Kapsulorhexis (CCC) erschwert
- Vorangegangene Operationen, wie z.B. bestehende Trab. oder vergangene Pars-plana-Vitrektomie (PPVx)
- Prädisposition zur Exposition: z. B. Botox, früheres Lidtrauma, Diabetes mellitus (DM)
- Antikoagulanzien (z.g., Warfarin/Coumadin, Asparin)
- Monokulare Patienten
| Faktor | Zeit | Ausrüstung/Anästhesie |
|---|---|---|
| Zonuläre Laxität | Doppelt |
|
| Steinharte Linse | Zusatz 50% |
|
| Kleine Pupille | Zugabe 50% |
|
| Flomax | Hinzufügen 50% |
|
| Schwacher roter Reflex | Zusatz 50% |
|
| Big Brow | Zugabe von 25% |
|
| Narrow Angle | Add 25% |
|
| Prädisposition zu Hornhautdekompensation | 0% |
|
| Vorhandenes Trabekulektomie-Bläschen | 0% |
|
| Vorherige Vitrektomie (PPVx) | 0% |
|
| Kann nicht flach liegen | 0% |
|
| Antikoagulans | 0% |
|
| Monokularer Patient | 0% |
|
| (modifiziert von Oetting, Cataract Surgery for Greenhorns, http://medrounds.org/cataract-surgery-greenhorns) | ||
Indikationen für die Konversion: Die Konversion zur ECCE ist angezeigt, wenn die Phakoemulsifikation versagt. Manchmal ist dies auf eine sehr harte Linse zurückzuführen, die sich dem Ultraschall nicht unterwirft, oder auf eine Linse, die so hart ist, dass der Chirurg befürchtet, dass die erforderliche Ultraschallenergie eine empfindliche Hornhaut schädigen könnte (z. B. Fuchs’sche Endotheldystrophie oder posteriore polymorphe Dystrophie). Manchmal wird auf ECCE umgestellt, wenn eine fehlgeleitete Kapsulorhexis radial verläuft, insbesondere bei einer harten Linse, wenn der Chirurg befürchtet, dass das Risiko eines Linsentropfens bei fortgesetzter Phakoemulsifikation zu groß ist. Ein Chirurg kann sich für eine Umstellung auf ECCE entscheiden, wenn die vordere Kapsel schwer zu sehen ist und die Kapsulorhexis mit der Dosenöffnertechnik abgeschlossen werden muss (mit der Verwendung von Trypanblau-Färbung ist dies jedoch seltener angezeigt). Häufiger ist die Umstellung indiziert, wenn die Linse aufgrund schwacher Zonula oder eines hinteren Kapselrisses lose ist, so dass eine Phakoemulsifikation weniger sicher ist als die Erweiterung der Wunde und die Entfernung des restlichen Linsenmaterials. Zu den Indikationen für eine Umstellung auf ECCE gehören:
- Harte Augenlinse oder instabiles Endothel
- Radialer Riss in der vorderen Kapsel mit harter Linse
- Schlechte Visualisierung trotz Trypan-Farbstoff
- Hinterer Kapselriss
- Zonulardialyse
Umstellung auf Sub-Tenon-Anästhesie. Häufig werden Fälle von topischer klarer Hornhautanästhesie auf ECCE umgestellt. Auch wenn die ECCE unter örtlicher Betäubung durchgeführt werden kann, ist es in der Regel bequemer und sicherer, ein zusätzliches Anästhetikum zu verabreichen, in der Regel eine Sub-Tenon-Injektion von Bupivicain und Lidocain. Dadurch wird eine gewisse Bewegungslosigkeit und zusätzliche Anästhesie erreicht. In der Regel kommt es zu einer subkonjunktivalen Blutung, und wenn die Injektion zu anterior erfolgt, kann es zu einer Chemoisis und einer Ballonierung der Bindehaut kommen. Die Schritte der Sub-Tenon-Injektion werden im Folgenden beschrieben:1
- Machen Sie eine 3cc-Spritze mit gleichen Teilen von 2% Lidocain/0.75% Bupivacain vorbereiten
- Tränenkanüle (oder Masket-Kanüle) mit einer leichten Krümmung platzieren, um sich der des Augapfels anzunähern
- Einen Quadranten für die Blockade auswählen (am besten einen seitlichen Quadranten, um schräge Muskeln zu vermeiden)
- Den Patienten vom gewählten Quadranten wegschauen lassen, um die Exposition zu erhöhen
- Verwenden Sie eine .12 Pinzette zum Zurückziehen der Konjunktiva
- Mit der Wescott-Schere einen kleinen Einschnitt bis zur Sklera vornehmen
- Die Wescott-Schere mit der Krümmung nach unten führen und stumpf durch den Quadranten schneiden
- Den Äquator durchtrennen (ähnlich wie bei der Verwendung der Stevens-Tenotomieschere bei Päd/Retina)
- Verwenden Sie .12 Pinzette für den Gegenzug
- Kanüle durch den Einschnitt führen und vor der Injektion am Äquator vorbeiführen
- Das Lokalanästhetikum sollte leicht fließen und wenig Chemose verursachen — Falls nicht, Mit der Wescott-Schere erneut schneiden, um mehr nach hinten zu gelangen
- 2-3 cm³ des Lokalanästhetikums verwenden
Die Zange hält den hinteren Lappen der Dissektion in den Subtenonsraum offen. Tränenkanüle mit sanfter Krümmung, die sich der Krümmung des Augapfels annähert, bereit zum Einbringen des Lokalanästhetikums.
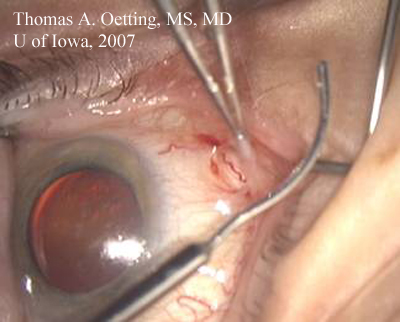
Umstellung der Wunde: Der wichtigste Schritt bei der Umstellung auf ECCE besteht darin, die bestehende Wunde entweder zu erweitern oder zu schließen und eine neue Wunde anzulegen. Die ECCE erfordert einen großen Einschnitt von 9-12 mm, der mit einer Naht verschlossen wird. Die Entscheidung, die bestehende Wunde zu erweitern oder eine neue Wunde anzulegen, hängt von mehreren Faktoren ab: der Lage der ursprünglichen Wunde, der Größe der Augenbraue, der bisherigen chirurgischen Vorgeschichte und der möglichen Notwendigkeit einer zukünftigen Operation.
| Ursprüngliche Wunde | Vorteile der Herstellung einer neuen Wunde für ECCE | Vorteile der Erweiterung der bestehenden Wunde für ECCE |
|---|---|---|
| Temporal |
|
|
| Supero-Schläfenbereich (linkes Auge) |
|
|
| Infero-temporal (rechtes Auge) |
|
|
| Superior |
|
|
Die Anfertigung einer neuen Inzision während der Konversion ist identisch mit der für eine geplante ECCE. Die ursprüngliche Inzision wird mit einer 10-O-Nylon-Naht verschlossen. Der Chirurg und das Mikroskop werden gedreht, da der Chirurg superior sitzen sollte. Die Schritte zum Anlegen einer neuen superioren Inzision sind:
- Konjunktivale Peritomie von etwa 170 Grad
- Verwenden Sie eine 64er- oder Halbmondklinge, um eine Limbusfurche mit einer Sehnenlänge von 11 mm herzustellen
- Bipolarer Kauter zur Hämostase
- Mit dem Keratom den ersten Einschnitt von der Rille in den AC vornehmen
- Den ersten Einschnitt auf die gesamte Länge der Rille ausdehnen (mit einer Schere oder einem Messer)
- Sicherheitsnähte vorlegen (normalerweise 7-0 Vicryl)
Das Erweitern einer bestehenden Inzision kann schwierig sein, und die Technik ist bei Skleratunneln anders als bei klaren Hornhautinzisionen. In beiden Fällen wird jedoch die ursprüngliche Verlängerung bis zum Limbus gebracht. Bei einem ursprünglichen Skleralschnitt wird die Inzision nach vorne gebracht, um den Limbus an beiden Enden zu erreichen, bevor sie sich entlang des Limbus über eine Sehnenlänge von etwa 11 mm erstreckt. Bei einem bestehenden Hornhautschnitt wird der Hornhautschnitt nach hinten zum Limbus geführt, bevor die Wunde entlang des Limbus um eine Sehnenlänge von etwa 11 mm verlängert wird. Wenn Iris-Haken in einer Diamantkonfiguration verwendet werden, kann die Wunde erweitert werden, um den subinzisionalen Haken und die große Pupille zu erhalten.2
- Konjunktivale Peritomie von etwa 170 Grad
- Mit der 64er- oder Halbmondklinge auf beiden Seiten der bestehenden Wunde eine Limbusfurche mit einer Sehnenlänge von 11 mm anlegen
- Bipolarer Kauter zur Hämostase
- Verwenden Halbmondklinge, um eine bestehende Sklerawunde nach vorne oder eine bestehende Hornhautwunde nach hinten zu bringen, um den Limbus zu verbinden
- Erweiterung der ursprünglichen Inzision auf die gesamte Länge der Rille (mit Schere oder Messer)
- Sicherheitsnähte werden vorher gelegt (normalerweise 7-0 Vicryl)
Entfernen der Linse: Bei der typischen Umstellung auf ECCE, die mit einem Glaskörperverlust einhergeht, muss man bei der Entfernung des Nukleus sehr viel vorsichtiger sein. Zunächst muss die vordere Kapsel groß genug sein, um den Kern zu entfernen, was in manchen Fällen entspannende Schnitte erfordert. Wenn die Zonula schwach oder die hintere Kapsel zerrissen ist, kann die Linse nicht mit Flüssigkeit oder externem Druck exprimiert werden, wie dies bei einer geplanten ECCE mit intakter Kapsel/Zonula häufig der Fall ist. Nach der Entfernung des Glaskörpers (siehe unten) muss die Linse vorsichtig und mit minimalem Druck auf den Augapfel aus der Vorderkammer herausgeschleust werden. Wenn die hintere Kapsel und die Zonlien intakt sind, kann die Linse wie beschrieben mit einer geplanten ECCE ausgedrückt werden.
Entfernen der Linse bei intaktem Kapselkomplex:
- Linse mobilisieren (physisch mit Zystotom oder mit Hydrodissektion – vorsichtig sein)
- Linse mit Linsenschlinge oder mit Gegen-Drucktechnik
- Wunde wird mit Sicherheitsnähten und zusätzlicher zentraler Vicryl-Naht verschlossen
- Kortikales Material wird mit dem I/A-Gerät entfernt (entweder automatisch oder manuell)
- Ophthalmoviskoelastische Vorrichtung (OVD)
- Linse wird in die Hinterkammer eingesetzt
- Wunde wird mit 10-O-Nylon verschlossen und Vicryl-Nähte werden entfernt.
- OVD wird entfernt
Entfernen der Linse bei vorhandenem Glaskörper:
- Linse mit Viscoat-Kanüle mobilisieren (Linse so kippen, dass die Wundseite nach vorne zeigt)
- Linsenschlaufe unter die Linse schieben, das Instrument „anheben“, Linse entfernen
- Wunde wird mit Sicherheitsnähten und zusätzlicher zentraler Vicryl-Naht verschlossen
- Anteriore Vitrektomie (siehe unten)
- Kortikales Material wird mit trockener Technik oder mit dem vorderen Vitrektor entfernt
- Stilles ophthalmisches viskoelastisches Gerät (OVD)
- Linse wird in den Sulcus oder in den vorderen Kanal eingesetzt
- Wunde wird mit 10-O-Nylon verschlossen und Vicryl-Nähte entfernt
- OVD wird entfernt
Einsetzen der IOL: Die Auswahl der IOL bei ECCE-Konversion hängt vom verbleibenden Kapselkomplex ab.3,4 Der Schlüssel zur IOL-Zentrierung liegt darin, beide Haptiken an der gleichen Stelle zu platzieren: entweder beide in der Tasche oder beide im Sulcus.
- Wenn die hintere Kapsel nach einer Umstellung auf ECCE intakt ist, ist die vordere Kapselöffnung normalerweise schlecht definiert, was die Platzierung des Beutels erschweren kann. Wenn die vordere Kapsel und damit der Beutel gut definiert ist, kann eine einteilige Acryl-IOL ohne Faltung direkt und vorsichtig mit einer Kelman-Pinzette in den Beutel eingesetzt werden.
- Wenn die hintere Kapsel intakt und die vordere Kapsel schlecht definiert ist, platzieren Sie eine dreiteilige IOL in den Sulcus, z. B. eine große Silikon-IOL oder die MA50-Acrylatlinse, indem Sie diese direkt und ungefaltet mit einer Kelman-Zange in den Sulcus setzen. Achten Sie darauf, dass sich beide Haptiken im Sulcus befinden.
- Wenn die hintere Kapsel beschädigt ist und noch genügend vordere und hintere Kapsel vorhanden ist, um die IOL zu tragen, definieren Sie den Sulcus mit Viscoat und platzieren Sie die IOL direkt im Sulcus. Achten Sie darauf, dass sich beide Haptiken im Sulcus befinden. Wenn die IOL nicht stabil erscheint, bringen Sie McCannel-Nähte an, um die IOL an der Iris zu befestigen, oder entfernen Sie sie und ersetzen Sie sie durch eine AC-IOL (vergessen Sie nicht, mit dem Vitrektor eine hintere Iridektomie vorzunehmen).
- Wenn die Kapsel stark geschädigt ist und eine IOL nicht tragen kann, dann platzieren Sie die IOL in der vorderen Augenkammer. Verwenden Sie eine Kelman-Zange, um die IOL zu platzieren, sichern Sie dann die Kammer und verwenden Sie einen Sinskey-Haken, um die AC-IOL in ihre endgültige Position zu bringen. (Vergessen Sie nicht, eine periphere Iridektomie mit dem Vitrektor durchzuführen).
Postoperative Probleme: Die postoperative Versorgung von Patienten nach der Umstellung von Phako auf ECCE ist etwas komplizierter und konzentriert sich auf die Vermeidung eines zystoiden Makulaödems (CME) und die Begrenzung des induzierten Astigmatismus. Häufig ähnelt die Versorgung der einer geplanten ECCE mit etwa drei postoperativen Besuchen (einer am selben oder nächsten Tag, einer eine Woche später und einer etwa 5-6 Wochen später). Je nach Ausmaß des Astigmatismus kann der Patient mehrere Besuche benötigen, um die Nähte nacheinander zu entfernen und gleichzeitig den induzierten Astigmatismus zu beseitigen.
Erster postoperativer Besuch: Diese Visite findet häufig am selben Nachmittag (4-6 Stunden nach der Operation) oder am nächsten Morgen statt, wobei der Schwerpunkt auf der Überprüfung des IOD, der Suche nach Wundlecks und der Suche nach Linsenresten oder Glaskörper in der Vorderkammer liegt. Sicherlich sollten die meisten Wundlecks genäht werden, aber wenn das AC nicht gebildet wird, ist der Verschluss dieser Lecks obligatorisch. Reste von Kernmaterial sollten in den nächsten Tagen entfernt werden, wenn sie vorhanden sind, aber Reste von Kortikalis lösen sich oft mit geringer Entzündung auf. Aufgrund von Astigmatismus und Ödemen ist mit einer Sehschwäche im Bereich von 20/200 zu rechnen. Die Vorderkammer sollte ausgebildet sein und weist in der Regel eine mäßige Zellzahl auf (10-20 Zellen/hpf mit 0,2 mm Strahl). Liegt der Augeninnendruck unter 10 mmHg, sollte mit Hilfe des Seidel-Tests vorsichtig nach einem Leck gesucht werden. Liegt der Augeninnendruck im Bereich von 10-29 mmHg, ist wahrscheinlich alles in Ordnung, es sei denn, der Patient ist vaskulopathisch, in diesem Fall sollte die Obergrenze der Augeninnendruck-Toleranz gesenkt werden. Liegt der Augeninnendruck im Bereich von 30-39, sollte eine wässrige Suppression in Betracht gezogen werden. Liegt der Augeninnendruck >40, sollten Sie eine Kammerwassersuppression und ein „Rülpsen“ oder „Ausbluten“ des Augeninnendrucks durch die Parazentese oder eine Vorderkammerpunktion in Betracht ziehen. Der Augeninnendruck sollte 60-90 Minuten später erneut kontrolliert werden, um den Erfolg der Behandlung sicherzustellen. Schauen Sie sich den Augenhintergrund an, um eine Netzhautablösung (RD) und Aderhautergüsse oder -blutungen auszuschließen. In der Regel erhalten die Patienten viermal täglich 1 Tropfen Prednisolonacetat (1 %), zweimal täglich 1 Tropfen Cyclogyl (1 %) und eine Woche lang 1 Tropfen eines Antibiotikums (1 %).
Woche 1 nach der Operation: Die Sehkraft und der Augeninnendruck sollten sich bei Patienten, die auf ECCE umgestellt wurden, in der nächsten Woche dramatisch verbessern. Die Sehschärfe sollte im Bereich von 20/100 liegen, mit einer punktuellen Verbesserung auf etwa 20/50. Das Sehvermögen wird in der Regel durch Restödeme und Astigmatismus eingeschränkt. In einer Studie über unsere ECCE-Fälle fanden wir bei der Nachuntersuchung nach einer Woche einen Zylinder von etwa 7,0 Dioptrien. Sie sollten eine sehr geringe Entzündung erwarten und dokumentieren, dass keine RD vorliegt. Suchen Sie nach Resten von Linsenmaterial im vorderen Segment und am hinteren Pol. Sie können das Cyclogyl und das Antibiotikum absetzen. Das Prednisolonacetat langsam ausschleichen (z. B. 1 gtt QID für weitere 7 Tage, dann 1 gtt dreimal täglich für 7 Tage, dann 1 gtt BID für 7 Tage, dann 1 gtt QD für 7 Tage), dann absetzen. Besteht bei dem Patienten das Risiko eines zystoiden Makulaödems (CME), wie es bei Glaskörperverlust möglich ist, sollten Sie Prednisolon in der höheren Frequenz (z. B. QID) beibehalten und ein nicht steroidales Mittel (wie topisches Ketorolac oder äquivalent 1 gtt QID) bis zum nächsten Besuch 4 – 6 Wochen später verabreichen.
Postoperativer Besuch in Woche 5: Das Sehvermögen sollte sich weiter verbessern, da sich der Astigmatismus ausgleicht und die Hornhaut sich weiter klärt. Das Auge sollte sich wohlfühlen. Die Sehschärfe sollte im Bereich von 20/80 liegen und sich mit Pinhole auf 20/40 verbessern. In unserer Studie betrug der durch ECCE-Nähte induzierte Astigmatismus etwa 5,0 Dioptrien an der Inzision. Der vordere Augenabschnitt sollte ruhig und der IOD normal sein (es sei denn, der Patient ist ein „Steroid-Responder“). Bei Patienten, bei denen eine Konversion erforderlich war, ist eine CME in Betracht zu ziehen, da diese Fälle oft langwierig sind und einen Glaskörperverlust zur Folge haben können. Je nach klinischer Indikation durch Untersuchung oder Anamnese mit optischer Kohärenztomographie (OCT) oder Flourescein-Angiographie (FFA) untersuchen.
Zu diesem Zeitpunkt der Genesung ist das Hauptproblem die Astigmatismuskontrolle mit Entfernung der Fäden. Verwenden Sie Keratometrie, Refraktion, Streak-Retinoskopie oder Topographie, um Ihre Fadenentfernung zu steuern. Wenn die Keratometrie bei 90 Grad 45,00 und bei 180 Grad 40,00 beträgt, suchen Sie nach engen Fäden bei etwa 90 Grad (12 Uhr), die einen Zylinder von 5 Dioptrien verursachen. Nach 5 Wochen kann nur eine Naht entfernt werden, aber bei der Bewertung nach 8 Wochen können Sie die Entfernung von 2 Nähten auf einmal in Betracht ziehen. Der Plan ist, eine Naht zu entfernen und zu sehen, wie sich die Hornhaut einstellt. Wenn der Astigmatismus weniger als 1,0 bis 1,5 Dioptrien beträgt, sollten Sie die Fadenentfernung beenden und den verbleibenden Astigmatismus durch Refraktion korrigieren. Verwenden Sie nach jeder Fadenentfernung einige Tage lang prophylaktisch antibiotische Tropfen. Nach diesem Besuch sollten Sie bei jedem Besuch die folgenden Möglichkeiten in Betracht ziehen (verschwenden Sie nicht zu viel Zeit damit, über andere Möglichkeiten nachzudenken, und denken Sie daran, dass nicht jeder Mensch 20/20 ist):
- Ziehen einer Naht (d.h.. Zylinder an der Achse der Naht ist größer als 1,0 bis 1,5 Dioptrien auf der manifesten Refraktion)
- Gläser geben (d.h. keine Naht zum Ziehen oder Zylinder ist kleiner als 1 auf der MR)
- FFA oder OCT machen, weil Sie CME vermuten
Anteriore Vitrektomie. Die Umstellung auf ECCE geht fast immer mit Glaskörper einher. Manchmal kommt es zur Konversion, wenn die Linse zu hart und die Kapsel intakt ist, aber am häufigsten scheint es zu einer Konversion zu kommen, wenn die Zonula oder die Kapsel den Glaskörper in die widerstrebenden Hände des Vorderabschnittschirurgen abgibt. Wir werden die Ursachen und Anzeichen eines Glaskörperprolapses und die Prinzipien der vorderen Vitrektomie in verschiedenen Situationen behandeln.
Ursachen des Glaskörperprolapses. Der Glaskörper kommt entweder um die Zonula herum oder durch einen Riss in der hinteren Kapsel. Hintere Kapselrisse werden häufig verursacht durch 1) einen anterioren Riss, der sich nach hinten ausdehnt (am häufigsten), 2) einen posterioren Riss – sekundär durch eine zu tiefe Phako-Nadel oder einen zu tiefen Chopper, 3) während der Manipulation mit dem I/A-Instrument oder 4) eine vorbestehende Verletzung (z. B. posteriorer polarer Katarakt, iatrogen durch PPVx oder durch ein penetrierendes Linsentrauma). Zonuläre Probleme sind häufig vorbestehend (z. B. durch Trauma, PXF oder Marfan-Syndrom), können aber auch iatrogen durch gewaltsame Rotation der Linse oder Ziehen an der Kapsel während der I/A entstehen.
Anzeichen eines Glaskörperprolapses. Das erste Anzeichen für einen Glaskörperprolaps ist Leugnen. Irgendetwas scheint nicht zu stimmen, aber Sie können das Problem nicht genau benennen. Zunächst leugnen Sie, dass ein Problem besteht, aber bald wird es klar. Weitere Anzeichen für einen Glaskörperprolaps sind: 1) Vertiefung der Augenkammer, 2) Erweiterung der Pupille, 3) die Linse ist nicht mehr zentriert, 4) die Linsenpartikel kommen nicht mehr zur Phako oder I/A und 5) die Linse dreht sich nicht mehr frei. Wenn Sie einen Glaskörperprolaps vermuten, sollten Sie vor dem Entfernen der Phako-Nadel oder des I/A ein dispersives OVD in das Auge einbringen und die Wunde mit einem Weck-Cel (oder einem ähnlichen Pfeilschwamm) auf Glaskörper untersuchen.
Grundprinzipien der anterioren Vitrektomie. Der Schlüssel zu einer erfolgreichen anterioren Vitrektomie ist die Kontrolle der Fluidik des Auges. Der erste Schritt besteht darin, die Kammer zu schließen. Dies ist oft schwierig, wenn Sie auf eine ECCE umgestellt haben, da die Wunde groß ist. Sie müssen die Wunde jedoch so verschließen, dass der einzige Flüssigkeitsaustritt die Absaug-/Schneidevorrichtung ist. Trennen Sie die Spüleinrichtung von der Absaug-/Schneidevorrichtung, damit Sie einen Druckunterschied erzeugen können, der den Glaskörper dazu veranlasst, zur Absaug-/Schneidevorrichtung zu gelangen. Der letzte wichtige Punkt ist, niedrig zu schneiden und hoch zu spülen. Wenn Sie die Spüleinrichtung in der Vorderkammer über dem Absaug-/Schneidegerät in der Nähe der Ebene der hinteren Kapsel platzieren können, wird der Glaskörper die Vorderkammer verlassen.
|
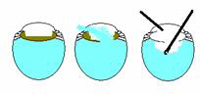 |
Im Allgemeinen sollte die Flaschenhöhe niedrig sein – gerade hoch genug, um das AC zu halten und nicht so hoch, dass Flüssigkeit und möglicherweise Glaskörper aus dem Auge gedrückt werden. Die Schnittgeschwindigkeit sollte beim Schneiden von Glaskörper so hoch wie möglich und beim Schneiden von kortikalem Linsenmaterial niedrig sein. Auf den Glaskörperverlust im Früh-, Mittel- und Spätstadium wird im Folgenden gesondert eingegangen.
Glaskörper zu Beginn des Falles – während sich der größte Teil der Linse im Auge befindet: Dies ist der ungünstigste Zeitpunkt für einen Glaskörperprolaps, und man sollte unbedingt eine Umstellung auf ECCE in Betracht ziehen. Die zu berücksichtigenden Schritte sind im Folgenden aufgeführt:1
- Wenn topisch, Injektion unter die Zehennägel (wie oben beschrieben)
- Verschließen Sie den temporalen Schnitt mit 10-0 und machen Sie einen separaten Schnitt mit Peritomie vor allem nach oben (wie oben beschrieben)
- Verwenden Sie dispergierendes Viskoelastikum, um die Linse in der Nähe der Wunde anzuheben und den Glaskörper weiter nach hinten zu verschieben.
- Möglicherweise ist eine Weck-Cel-Vitrektomie erforderlich, um den Glaskörper zu säubern, wenn er stark vorgefallen ist
- Linsenschlaufe verwenden, um die Linse zu entfernen (wie oben beschrieben)
- Wescott-Schere bereithalten, wenn die Schlaufe aus der Linse gezogen wird, um den Glaskörper zu schneiden
- Verschließen mit je 3 Sicherheitsnähten 7-0 Vicryl (eine in der Mitte und eine auf jeder Seite 3 mm entfernt, so dass die Naht in der Mitte entfernt werden kann, um eine 6 mm IOL zu platzieren)
- Eventuell muss etwas 10-0 Nylon an den Wundrändern hinzugefügt werden, um sicherzustellen, dass die Wunde wasserdicht ist
- Anteriore Vitrektomie (wie oben beschrieben, trennen Sie den Sauger/Schneider vom Irrigator)
- Trockene Entfernung des restlichen Rindenmaterials mit einer Spritze auf einer 27er Kanüle
- Benutzen Sie eine J-Kanüle oder Parazentese bei Bedarf für subinzisionales Material
- Färbung mit Kenalog in Betracht ziehen (siehe unten)
- IOL wenn möglich im Sulcus platzieren (Leistung anpassen) oder eine AC-IOL verwenden (periphere Iridotomie nicht vergessen)
- Miochol, um die Pupille zu verkleinern – setzt die Sulcus-IOL, spitze Pupille hilft bei der Erkennung des Glaskörpers
Glaskörper in der Mitte des Falles – während der Entfernung von Kortikalismaterial: Dies scheint der häufigste Zeitpunkt für einen Glaskörperverlust zu sein. Oft erhält man die hintere Kapsel, wenn das letzte Kernfragment entnommen wird. Natürlich gibt es in diesem Fall keinen Grund, auf ECCE umzustellen. Die folgenden Schritte sind nützlich:1
- Viscoat im Bereich des Risses oder der Dialyse platzieren, bevor die Instrumente entfernt werden
- Einen separaten 1 oder 1.5 mm Inzision für die anteriore Vitrektomie
- Separates Spülen (durch Parazentese) und Schneiden/Saugen (durch größere Parazentese)
- Möglicherweise muss die ursprüngliche Wunde genäht werden, damit die Kammer gebildet bleibt
- Hoch spülen und niedrig schneiden/saugen – erzeugt einen Druckgradienten, um den Glaskörper zurückzudrängen
- Einstellungen: niedriges Vakuum im Bereich 100, niedrige Flaschenhöhe im Bereich 50, maximale Schnittgeschwindigkeit
- Versuchen Sie, einen Teil des restlichen kortikalen Materials zu erhalten
- Trockene Entfernung des restlichen kortikalen Materials mit einer Spritze auf einer 27er Kanüle
- Verwenden Sie eine J-Kanüle oder Parazentese, falls für subinzisionales Material erforderlich
- Färbung mit Kenalog in Betracht ziehen (siehe unten)
- IOL wenn möglich in Sulcus oder AC platzieren (bei AC periphere Iridotomie nicht vergessen)
- Miochol, um die Pupille zu verkleinern
Umgang mit Glaskörper, der spät im Fall auftritt – während der Platzierung der IOL: Dies ist der unproblematischste und am wenigsten häufige Zeitpunkt für den Verlust von Glaskörper. Das Hauptproblem besteht darin, sicherzustellen, dass die IOL stabil ist, während man sich um den Glaskörper kümmert, und dann eine geeignete IOL entweder im AC, im Sulcus oder im Sack zu befestigen:1
- Viscoat im Bereich des Risses oder der Dialyse platzieren, bevor die Instrumente entfernt werden
- Einen separaten 1 oder 1.5 mm Einschnitt für anteriore Vitrektomie
- Spülen (durch Parazentese) und Schneiden/Saugen (durch größere Parazentese) trennen
- Originalwunde ggf. nähen, damit die Kammer geformt bleibt
- Hoch spülen und niedrig schneiden/saugen – erzeugt einen Druckgradienten, um das V zurückzudrücken
- Einstellungen Niedrigvakuum 100 Bereich, niedrige Flaschenhöhe 50 Bereich, maximale Schnittrate
- Wenn der Sulcus eine IOL tragen kann,
- Vorhandene dreiteilige IOL in den Sulcus verschieben
- Eine vorhandene einteilige IOL durch eine-Stück Linse im Beutel)
- Miochol, um die Pupille zu verkleinern
Färben des Glaskörpers mit Kenalog: Scott Burk von Cincinatti Eye beschrieb die Verwendung von Kenalog ohne Zulassung, um Glaskörper zu färben, der in die vordere Augenkammer vorgestoßen war5 (folgen Sie dem Link zum Facebook-Video). Da Kenalog von der FDA für diese Indikation nicht zugelassen ist und einige Netzhautchirurgen bei der Verwendung von Kenalog sterile (und sogar infektiöse) Endophthalmitis erlitten haben, ist seine Verwendung umstritten. Es ist jedoch eine sehr nützliche Ergänzung zur anterioren Vitrektomie. Die Methode zum Mischen von Triamcinolon (Kenalog) bis zu einer Verdünnung von 10:1 und zum Abwaschen des Konservierungsmittels ist wie folgt:
- TB-Spritze zum Aufziehen von 0.2 ml gut geschütteltes Triamcinolon (40mg/ml)
- Die Nadel entfernen und durch einen 5 (oder 22) Mikron Spritzenfilter (Sherwood Medical)
- Die Suspension durch den Filter drücken und das mit dem Konservierungsmittel gefüllte Vehikel verwerfen
- Das Kenalog wird auf der Spritzenseite des Filters eingeschlossen
- Den Filter in eine 5 ml Spritze, gefüllt mit Salzlösung (BSS)
- Die BSS vorsichtig durch den Filter drücken, um das Konservierungsmittel weiter auszuspülen
- Die Spülung ein paar Mal wiederholen
- Eine 22er Nadel auf das distale Ende des Filters aufsetzen
- 2 ml BSS durch den Filter in die Spritze ziehen, um das Kenalog zu resuspendieren
- Das Kenalog (jetzt ohne Konservierungsmittel und 10:1) färbt Glaskörperstränge weiß
- Oetting, TA, Cataract Surgery for Greenhorns, Erhältlich bei http://medrounds.org/cataract-surgery-greenhorns. Zugriff am 9. September 2007
- Dupps WJ Oetting TA, Diamond iris retractor configuration for small-pupil extracapsular or intracapsular cataract surgery. J Cataract Refract Surg Vol 30(12):2473-2475.
- Chang DF, Oetting TA, Kim T, Curbside Consultations in Anterior Segment Surgery, Slack Inc, Thorofare NJ, 2007.
- Henderson BA, Essentials of Cataract Surgery, Slack Inc, Thorofare NJ, 2007.
- Burk SE, Da Mata AP, Snyder ME, Schneider S, Osher RH, Cionni RJ. Visualizing vitreous using Kenalog suspension J Cataract Refract Surg. 2003 Apr;29(4):645-51.