- Introduction
- Methoden
- Probanden und Design
- MRT-Akquisition und Standardvolumenbewertung
- Bildvorverarbeitung
- Diskriminierende Clustering-Gewebesegmentierung
- Partial Volume Estimation
- Neuropsychologische Bewertung
- Statistische Analyse
- Ergebnisse
- Charakteristika der Probanden
- Partielle WML-Volumina und andere MRT-Befunde
- Partielle WML-Volumina als Prädiktoren der kognitiven Leistung
- Diskussion
- Beiträge der Autoren
- Erklärung zu Interessenkonflikten
- Danksagungen
- Ergänzendes Material
- Abkürzungen
- Fußnoten
Introduction
Die zerebrale Kleingefäßerkrankung (SVD) ist die häufigste Ursache für vaskuläre kognitive Beeinträchtigungen und Demenz. Läsionen der weißen Substanz (WML) sind zusammen mit lakunären Infarkten, Mikroblutungen und Hirnatrophie der wichtigste Marker für SVD in der Bildgebung des Gehirns. Alle diese Befunde beeinflussen nachweislich das klinische und kognitive Ergebnis (Jokinen et al., 2011, 2012; Muller et al., 2011; Poels et al., 2012). Die LADIS-Studie (Leukoaraiosis and Disability) hat neben anderen Studien gezeigt, dass WML mit kognitivem Verfall, eingeschränkten funktionellen Fähigkeiten, Depressionen sowie Gang- und Gleichgewichtsstörungen zusammenhängen (LADIS Study Group, 2011).
Die Magnetresonanztomographie (MRT) ist die Standardmethode zur Bewertung von WML. Trotz erheblicher Verbesserungen bei den quantitativen Bildanalysetechniken in jüngster Zeit ist eines der größten Hindernisse der MRT nach wie vor ihre begrenzte räumliche Auflösung, die zu partiellen Volumeneffekten führt. Zusammen mit Rauschen und Inhomogenität stellt dies ein Problem für die Segmentierung des Gehirns dar. Häufig ist eine sorgfältige Analyse der Grenzen zwischen gesundem und pathologischem Gewebe erforderlich, um das Ausmaß und den Schweregrad von Läsionen abzugrenzen, wobei eine implizite „Entscheidungsschwelle“ für die Segmentierung von Läsionen gilt. Außerdem scheinen Hyperintensitäten im MRT nur das Endstadium des Krankheitsprozesses darzustellen. Mit der WML können weiter verbreitete Gewebeschäden verbunden sein, die in der Routine-MRT nicht sichtbar sind (Schmidt et al., 2011). Es gibt keinen Standard, um solche frühen Stadien der Gewebeschädigung zu bewerten, da sich ihre Intensitätswerte nicht hinreichend von denen normaler Gewebe unterscheiden.
Die meisten modernen Segmentierungsmethoden stützen sich auf Vorabinformationen, wie z. B. durchschnittliche Gehirnatlanten (Smith et al., 2004; Ashburner und Friston, 2005; Goebel et al., 2006) oder manuelle Beschriftung (Wismüller et al., 2004; Lee et al., 2009; Cruz-Barbosa und Vellido, 2011). Kürzlich wurde eine neue datengesteuerte Methode für die Gewebesegmentierung vorgeschlagen, die auf einer diskriminativen Clustering-Strategie (DC) in einem selbstüberwachten maschinellen Lernansatz basiert (Gonçalves et al., 2014). Diese Methode reduziert die Verwendung von Vorabinformationen auf ein Minimum und nutzt multispektrale MRT-Daten. Im Gegensatz zu anderen Methoden, die nur auf gesundes Gewebe (Pham und Prince, 1998; Van Leemput et al., 1999; Zhang et al., 2001; Manjón et al., 2010) oder bestimmte Arten von Läsionen (Van Leemput et al., 2001; Zijdenbos et al., 2002; Styner et al., 2008; Cruz-Barbosa und Vellido, 2011) abzielen, ermöglicht DC die Untersuchung eines breiten Spektrums normaler und abnormaler Gewebetypen. Ein weiterer großer Vorteil der vorgeschlagenen Methode ist ihre Fähigkeit, Gewebewahrscheinlichkeiten für jedes Voxel zu schätzen, die für eine geeignete Charakterisierung der WML-Entwicklung erforderlich sind. Voxel können in Kategorien eingeteilt werden, die einen geringen (noch zu schwach, um deutlich sichtbar zu sein), mittleren oder hohen Anteil an WML enthalten. Diejenigen, die einen geringen Anteil an Läsionen enthalten, liegen in der Regel außerhalb der „Entscheidungsschwelle“ der konventionellen Segmentierung und deuten auf ein frühes Stadium der WML hin.
In der vorliegenden Studie wurde untersucht, wie die verschiedenen Stadien der Läsionen mit der kognitiven Leistung einer Stichprobe älterer Personen mit leichter bis mittelschwerer WML zusammenhängen. Die verwendeten Daten bestanden aus MRT-Messungen, die in einem dreijährigen Nachbeobachtungszeitraum erhoben wurden, sowie aus jährlichen neuropsychologischen Beurteilungen innerhalb dieses Zeitraums. Insbesondere wollten wir herausfinden, ob selbst die frühesten kleinen partiellen WML-Volumina in normal aussehendem Hirngewebe in der Lage sind, unabhängig von der konventionell bewerteten WML-Belastung einen zukünftigen kognitiven Rückgang vorherzusagen.
Methoden
Probanden und Design
Bei den Probanden handelte es sich um eine Untergruppe von Teilnehmern (n = 78) aus drei Zentren (Amsterdam n = 21, Graz n = 18, Helsinki n = 39) der LADIS-Studie, einer europäischen Multicenterstudie, die die Auswirkungen altersbedingter WML beim Übergang von funktioneller Unabhängigkeit zu Behinderung untersucht. Über das LADIS-Protokoll und die Merkmale der Stichprobe wurde an anderer Stelle ausführlich berichtet (Pantoni et al., 2005). Kurz gesagt, wurden 639 Probanden in 11 Zentren gemäß den folgenden Einschlusskriterien aufgenommen: (a) Alter 65-84 Jahre, (b) leichte bis schwere WML gemäß der überarbeiteten Fazekas-Skala (Pantoni et al., 2005), (c) keine oder minimale Beeinträchtigung in der Skala der instrumentellen Aktivitäten des täglichen Lebens (≤ 1 von 8 Items beeinträchtigt) (Lawton und Brody, 1969) und (d) Vorhandensein eines regelmäßig erreichbaren Informanten. Ausschlusskriterien waren: (a) schwere Erkrankungen, die zu einem Abbruch der Nachbeobachtung führen könnten (Herz-, Leber- oder Nierenversagen, neoplastische oder andere relevante systemische Erkrankungen), (b) schwere nicht verwandte neurologische oder psychiatrische Erkrankungen, (c) Leukoenzephalopathien nicht vaskulären Ursprungs (immunologisch-demyelinisierend, metabolisch, toxisch, infektiös) und (d) Unfähigkeit oder Weigerung, sich einer MRT-Untersuchung zu unterziehen.
Die Ausgangsuntersuchung umfasste eine MRT des Gehirns sowie eine gründliche medizinische, funktionelle und neuropsychologische Beurteilung. Die klinischen Beurteilungen wurden in 12-monatigen Abständen bei drei Folgeuntersuchungen wiederholt.
Um einen gültigen Vergleich zwischen den Probanden/Zentren zu ermöglichen, mussten die in jedem Zentrum gewonnenen MRT-Sequenzen identisch sein, und jeder Patient musste über drei Sequenzen verfügen, die keine größeren Artefakte aufwiesen. Die 78 Probanden, die in diese Studie aufgenommen wurden, unterschieden sich nicht von der gesamten LADIS-Kohorte in Bezug auf Alter, Geschlecht, Ausgangswert der Mini-Mental State Examination (MMSE) oder WML-Volumen, hatten jedoch einen signifikant höheren Bildungsgrad (9,3 vs. 11,7 Jahre; t = -4,6, p < 0,001).
Die Studie wurde von den Ethikkommissionen aller an der LADIS-Studie beteiligten Zentren genehmigt (LADIS Study Group, 2011). Alle Probanden haben eine schriftliche Einverständniserklärung erhalten und unterschrieben. Die Mitarbeiter der LADIS-Studie sind in Anhang II aufgeführt.
MRT-Akquisition und Standardvolumenbewertung
Alle verwendeten axialen MRT-Scans wurden mit einem 1.5T-Geräten nach demselben Protokoll in jedem Zentrum aufgenommen, einschließlich Magnetisierungstransferbildern (TE = 10-14 ms, TR = 740-780 ms), T2-gewichteten schnellen Spinechobildern (TE = 100-120 ms, TR = 4000-6000 ms) und flüssigkeitsgedämpften Inversionsbildern (FLAIR) (TE = 100-140 ms, TR = 6000-10000 ms, TI = 2000-2400 ms). Alle Sequenzen hatten eine Voxelgröße von 1 × 1 × 5-7,5 mm3, FOV = 250 und einen Zwischenschichtabstand von 0,5 mm.
Das Ausmaß der Hyperintensitäten in den Regionen der weißen Substanz einschließlich der infratentoriellen Region wurde auf axialen FLAIR-Bildern mit einer halbautomatischen volumetrischen Analyse (VFLAIR) unter Verwendung einer Sparc 5-Workstation (SUN) ausgewertet (van Straaten et al., 2006). Die Läsionen wurden markiert und die Grenzen wurden auf jeder Schicht mit Hilfe eines lokalen Schwellenwerts festgelegt (selbst entwickelte Software Show_Images, Version 3.6.1). Es wurde nicht zwischen subkortikalen und periventrikulären Hyperintensitäten unterschieden. Bereiche mit Hyperintensität auf T2-gewichteten Bildern um Infarkte und Lakunen wurden nicht berücksichtigt. Die Anzahl der Lakunen wurde in der weißen Substanz und in der tiefen grauen Substanz mit einer Kombination aus FLAIR-, magnetisierungsvorbereiteten Rapid-Acquisition-Gradient-Echo und T2-Bildern erfasst, um Lakunen von perivaskulären Räumen und Mikroblutungen zu unterscheiden (Gouw et al., 2008). Darüber hinaus wurde die Hirnatrophie anhand einer schablonenbasierten Bewertungsskala auf FLAIR-Bildern getrennt für kortikale und subkortikale Regionen bewertet (Jokinen et al., 2012).
Bildvorverarbeitung
Um zu gewährleisten, dass die in jedem Voxel enthaltene multispektrale Information von der exakt gleichen Stelle in jedem Probanden stammt, wurde für alle verfügbaren Sequenzen eine Intra-Patienten-Registrierung durchgeführt, wobei die SPM5-Toolbox (Friston, 2003) verwendet und eine affine Transformation mit dem Bild mit der niedrigsten Auflösung, typischerweise FLAIR, als Vorlage angewendet wurde. Darüber hinaus wurden extra-meningeale Gewebevoxel mit Hilfe einer automatischen Standardmethode (BET2) maskiert (Smith et al., 2004).
Diskriminierende Clustering-Gewebesegmentierung
Neue Fortschritte bei maschinellen Lerntechniken haben konkurrenzfähige Ergebnisse bei der Gewebesegmentierung gezeigt, die oft die mit klassischen regions- oder schwellenwertbasierten Methoden erzielten Genauigkeiten übertreffen (Styner et al., 2008). Vor allem sind sie im Vergleich zur manuellen Abgrenzung robuster und weniger subjektiv. Bei der in dieser Studie verwendeten Gewebesegmentierungsmethode handelt es sich um eine solche maschinelle Lerntechnik, die auf einer datengesteuerten, selbstüberwachten Methodik basiert, die auf einer DC-Strategie beruht (Gonçalves et al., 2014). Ähnlich wie bei unüberwachten Clustering-Algorithmen, wie z. B. k-nearest neighbors, gruppiert DC die Eingabedaten entsprechend ihrer mehrdimensionalen Graustufenverteilungsinformationen. In der vorliegenden Studie waren diese Verteilungen dreidimensional, was der Gesamtzahl der verwendeten Sequenzen entspricht. Der Hauptvorteil von DC ist seine Fähigkeit, eine kleine Menge an markierten Informationen zur Unterstützung der Clusterzuweisung zu verwenden. Diese Eigenschaft führt zu einer deutlichen Verbesserung der Segmentierungsergebnisse, die über die traditionellen Clustering-Techniken hinausgeht (Gonçalves et al., 2014).
Das Gesamtziel von DC lässt sich dann wie folgt zusammenfassen: Partitionierung des Datenraums in geclusterte Regionen mit relativ gleichmäßigen Verteilungen und konsistenten Beschriftungsinformationen für alle zu jedem Cluster gehörenden Voxel. Eine detailliertere Erläuterung findet sich in Anhang I, die vollständige mathematische Beschreibung in Gonçalves et al. (2014).
Partial Volume Estimation
DC gibt die Wahrscheinlichkeit der Zugehörigkeit jedes Voxels zu allen Gewebeklassen an und ermöglicht so die Schätzung von partiellen Volumeninformationen. Da wir uns in unserer Studie auf läsionierte Voxel konzentrieren wollten, haben wir nur solche analysiert, bei denen der Anteil des vorhandenen Läsionsgewebes relevant ist.
In dieser Studie wurden drei verschiedene Läsionskategorien identifiziert, was zu einer entsprechenden Volumenschätzung führte: das Volumen der Voxel, die eine HOHE (VDC100), MITTLERE (VDC66) oder KLEINE (VDC33) Wahrscheinlichkeit für eine Läsion haben. VDC100 und VDC66 sind die Volumina, bei denen das Hauptgewebe in den darin enthaltenen Voxeln eine Wahrscheinlichkeit von >66% bzw. < 66% hat, eine Läsion zu sein. Da die beiden Volumina VDC100 und VDC66 einen Großteil des Läsionsgewebes enthalten, kann VFLAIR1 durch die Summe angenähert werden: VFLAIR≈VDCHARD2 ≥ VDC100 + VDC66. Die bestmögliche Schätzung des Volumens der sichtbaren Läsion unter Verwendung von DC wird also durch VDCHARD erreicht. Die letzte Kategorie, VDC33, entspricht dem Volumen der Voxel, bei denen eine Läsion der zweitwahrscheinlichste Gewebetyp ist, mit Wahrscheinlichkeiten ≥ 33 %. Es ist zu beachten, dass dieses Volumen bei normalen Segmentierungsmethoden, wie z. B. der VFLAIR-Schätzung, nicht als Läsion betrachtet wird, da die Läsion dort nie der Hauptgewebetyp ist.
Die Fähigkeit der vorliegenden Segmentierungsmethode, Läsionen im Frühstadium zu erkennen, wurde an einer Untergruppe von Patienten (n = 19) mit MRT-Follow-up-Daten überprüft (siehe ergänzende Materialien: Anhang I). Dort zeigen wir, dass kleine partielle WML-Volumina auf mögliche zukünftige Standorte voll entwickelter Läsionen hinweisen.
Neuropsychologische Bewertung
Die kognitive Testbatterie der LADIS-Studie umfasste den MMSE (Folstein et al., 1975), die Vascular Dementia Assessment Scale-Cognitive Subscale (VADAS) (Ferris, 2003), den Stroop-Test (MacLeod, 1991) und den Trail making test (Reitan, 1958). Für den vorliegenden Zweck wurden die MMSE- und VADAS-Gesamtergebnisse als globale Messwerte der kognitiven Funktion verwendet. Darüber hinaus wurden drei psychometrisch robuste zusammengesetzte Maße für die Bewertung spezifischer kognitiver Bereiche unter Verwendung gemittelter Standardscores der einzelnen Untertests gebildet, wie zuvor beschrieben (Moleiro et al., 2013): (1) Geschwindigkeit und motorische Kontrolle = z-Scores (Trail making A + Labyrinth + Digit Cancellation)/3; (2) Exekutivfunktionen = z-Scores von /4; und (3) Gedächtnis = z-Scores (immediate word recall + delayed recall + word recognition + digit span)/4.
Der Anteil der fehlenden Werte in den neuropsychologischen Testvariablen schwankte zwischen 0 und 6,4 % zu Beginn der Studie und zwischen 24,4 und 32,1 % bei der letzten Nachuntersuchung. Dieser Datenverlust war auf den Tod der Probanden (n = 2), den Abbruch der neuropsychologischen Nachuntersuchungen (Besuch im letzten Jahr, n = 17) oder die Unfähigkeit, die gesamte Testbatterie zu vervollständigen (n = 6) zurückzuführen.
Statistische Analyse
Die Prädiktoren der kognitiven Leistung im Längsschnitt wurden mit linearen gemischten Modellen (eingeschränkte Maximum-Likelihood-Schätzung) analysiert, die in der Lage sind, mit fehlenden Werten und komplexen Kovarianzstrukturen umzugehen. Das Beurteilungsjahr (Baseline, 1., 2. und 3.) wurde als Variable innerhalb der Probanden verwendet, und es wurde eine unstrukturierte Kovarianzstruktur angenommen. Die Ergebnisse der kognitiven Tests wurden als abhängige Variablen festgelegt. Die partiellen Läsionsvolumina (VDC33, VDC66 und VDC100) wurden nacheinander als Prädiktoren getestet. In allen Modellen wurden Alter, Geschlecht und Ausbildungsjahre als Kovariaten verwendet. Die Modelle wurden durch Hinzufügen von VFLAIR als weitere Kovariate wiederholt, um den prädiktiven Wert der partiellen Volumenmessungen zusätzlich zu dem des konventionell ausgewerteten WML-Volumens zu ermitteln. In ähnlicher Weise wurde das Studienzentrum als potenzieller Störfaktor hinzugefügt, aber da es keinen wesentlichen Einfluss auf die Ergebnisse hatte, wurde es in den endgültigen Analysen nicht berücksichtigt. Aufgrund der schiefen Verteilungen, die möglicherweise die Linearitätsannahme der Mischungsmodelle beeinträchtigen, wurden alle drei partiellen Volumenmessungen und das VFLAIR logarithmisch transformiert. Die Ergebnisse wurden mit dem gemischten Modul von IBM SPSS Statistics 22 ausgewertet. Die statistische Signifikanz wurde für alle Analysen auf p < 0,05 festgelegt.
Ergebnisse
Charakteristika der Probanden
Die Charakteristika der Probanden bei Studienbeginn sind in Tabelle 1 aufgeführt. Nach der revidierten Fazekas-Skala hatten 28 (35,9 %) der Probanden eine leichte, 26 (33,3 %) eine mittelschwere und 24 (30,8 %) eine schwere WML.

Tabelle 1. Ausgangscharakteristika der Probanden, n = 78.
Partielle WML-Volumina und andere MRT-Befunde
Tabelle 1 zeigt die Volumina, die durch die konventionelle Segmentierungsmethode erhalten wurden, die durch DC geschätzten partiellen Läsionsvolumina und den Dice-Ähnlichkeitskoeffizienten, der beide Segmentierungsmethoden vergleicht. Abbildung 1 zeigt einen Vergleich zwischen dem ursprünglichen FLAIR-Bild (1A), dem konventionell geschätzten Hyperintensitätsvolumen VFLAIR (1B) und den Ergebnissen für die partiellen WML-Volumen VDC100 (1C), VDC66 (1D) und VDC33 (1E). Die Bilder 1F-1J zeigen die entsprechenden Bilder in dem gezoomten Bereich, der durch das weiße Rechteck in Bild 1A gekennzeichnet ist. Die Entwicklung um die Läsionsherde herum, von der vollständigen Blasenbildung in der Mitte bis zum Zwischenstadium und einem geringen Anteil an Läsion an den Rändern, ist in den Bildern 1H-J zu sehen. Man beachte, dass die als VDC33 klassifizierten Voxel nicht im VFLAIR enthalten sind, aber auf mögliche Stellen zukünftiger Läsionen hinweisen. Abbildung 2 zeigt ähnliche Befunde auf einer höheren Ebene, dem Centrum semiovale. Das DC-Segmentierungsverfahren verwendete drei verschiedene Sequenzen (FLAIR, T2, T1). Zur Veranschaulichung wird hier nur FLAIR gezeigt.
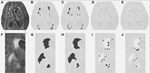
Abbildung 1. Läsionen der weißen Substanz (WML) auf mittlerer Höhe. (A) FLAIR-Bild für eine bestimmte Person. (B) Konventionell geschätzte WML. (C-E) Geschätzte WML unter Verwendung des vorgeschlagenen Segmentierungsalgorithmus für die gesamte, mittlere und kleine Läsion. (F-J) Ähnliche Bilder für den gezoomten Teil, der durch den weißen Kasten in (A) dargestellt ist.
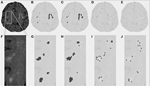
Abbildung 2. Läsionen der weißen Substanz (WML) im Centrum semiovale. (A) FLAIR-Bild für eine bestimmte Person. (B) Konventionell geschätzte WML. (C-E) Geschätzte WML unter Verwendung des vorgeschlagenen Segmentierungsalgorithmus für die gesamte, mittlere und kleine Läsion. (F-J) Ähnliche Bilder für den gezoomten Teil, der durch den weißen Kasten in (A) dargestellt ist.
Für den gesamten verwendeten Datensatz korrelierten die drei partiellen WML-Volumenmaße signifikant miteinander: VDC33*VDC66 r = 0,87; VDC33*VDC100 r = 0,47; VDC66*VDC100 r = 0,47 (p < 0,001). Sie korrelierten auch signifikant mit dem VFLAIR: VDC33 r = 0,26 (p = 0,024), VDC66 r = 0,26 (p = 0,023) und VDC100 r = 0,87 (p < 0,001), jeweils. Die Maße waren jedoch nicht signifikant mit dem Vorhandensein von lakunären Infarkten (keine/wenige/viele) oder dem globalen Hirnatrophiescore (kortikal und subkortikal) assoziiert (p > 0,05).
Abbildung 3 zeigt die gemeinsamen und unterschiedlichen Segmentierungen zwischen der konventionellen Segmentierung (VFLAIR) und der DC (VDCHARD) für die Person aus Abbildung 1. Es gibt eine deutliche Überschneidung zwischen den beiden Segmentierungen, wie die große Anzahl grüner Pixel zeigt. Bei der in dieser Abbildung gezeigten Person gibt es einen kleinen Unterschied zwischen VFLAIR und VDCHARD.
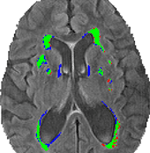
Abbildung 3. Vergleich der Segmentierungsmethoden. Dieses Bild zeigt die Segmentierung, die mit der halbautomatischen volumetrischen Analyse (VFLAIR) und dem diskriminativen Clustering (VDCHARD) für die Person aus Abbildung 1 erhalten wurde. Die grün dargestellten Regionen entsprechen der sich überschneidenden Segmentierung zwischen beiden Ansätzen. In Rot sind die Regionen dargestellt, die nur durch die konventionelle Methode als Läsion klassifiziert wurden, während Blau den Voxeln entspricht, die nur durch DC als Läsion klassifiziert wurden.
Die Schätzung der vollständigen Gewebeklassifikation eines Probanden mit DC auf einem PC mit Intel® Core™ i5-4590 CPU@ 3,30 GHz mit 16 GB RAM dauerte etwa 25 Minuten. Die Schätzung der Etiketten auf diesem Computer dauerte etwa 70 Minuten. Eine Verbesserung der letztgenannten Schätzung dürfte das Verfahren erheblich rationalisieren.
Partielle WML-Volumina als Prädiktoren der kognitiven Leistung
Die Beziehungen zwischen partiellen WML-Volumina und longitudinaler kognitiver Leistung sind in Tabelle 2 zusammengefasst. Lineare gemischte Modelle, die für Alter, Geschlecht und Bildung bereinigt wurden, zeigten signifikante negative Assoziationen zwischen VDC33 und dem Compound Score für exekutive Funktionen. Erstens war VDC33 mit einem signifikanten Haupteffekt auf das Gesamtniveau der exekutiven Leistung verbunden (Durchschnittswerte über alle vier zeitlichen Beurteilungen). Zweitens zeigte die Interaktion zwischen VDC33 und Zeit (Beurteilungsjahr) einen signifikanten prädiktiven Wert des VDC33 für die Veränderung der exekutiven Leistung während der dreijährigen Nachbeobachtungszeit. Insbesondere stand eine höhere VDC33-Belastung im Zusammenhang mit einer schlechteren Leistung bei Studienbeginn und einem steileren Rückgang der exekutiven Funktionen in jedem nachfolgenden Untersuchungsjahr. Nach zusätzlicher Anpassung für VFLAIR blieben diese Ergebnisse unverändert. Darüber hinaus gab es einen schwachen Zusammenhang zwischen der VDC33 und dem VADAS-Gesamtscore bei Studienbeginn, aber dieses Ergebnis war nach der Kontrolle für VFLAIR nicht mehr signifikant.
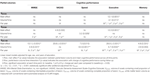
Tabelle 2. Beziehung zwischen den Volumina der partiellen Läsionen der weißen Substanz und der kognitiven Leistung im 3-Jahres-Follow-up.
VDC66 war mit signifikanten Haupteffekten verbunden, die auf ein schlechteres Gesamtleistungsniveau bei VADAS und exekutiven Funktionen hinwiesen. Die Interaktion zwischen VDC66 und Zeit war nur für die Verarbeitungsgeschwindigkeit signifikant. Die Untersuchung der Ergebnisse zu den einzelnen Zeitpunkten zeigte eine signifikante Assoziation zu den Ausgangswerten (VADAS, exekutive Funktionen) sowie longitudinale Veränderungen im ersten (VADAS, exekutive Funktionen), zweiten (MMSE, exekutive Funktionen) und dritten (exekutive Funktionen) Folgejahr. Die Kontrolle für VFLAIR hatte minimale Auswirkungen auf diese Ergebnisse (Tabelle 2).
Schließlich war VDC100 mit signifikanten Haupteffekten in allen neuropsychologischen Scores verbunden. VDC100*-Zeit-Interaktionen zeigten einen signifikanten Zusammenhang mit der Veränderung während der Nachbeobachtung bei vier von fünf kognitiven Messwerten. Zu diesem Zeitpunkt waren die Läsionen systematisch mit der kognitiven Leistung bereits zu Beginn der Studie verbunden. Darüber hinaus zeigte sich ein steilerer Leistungsabfall von der ersten bis zur letzten Nachuntersuchung, wobei es bei den verschiedenen kognitiven Messgrößen gewisse Unterschiede gab. Die meisten dieser Ergebnisse blieben auch nach zusätzlicher Kontrolle für die VFLAIR bestehen, trotz ihrer hohen Korrelation mit der VDC100 (Tabelle 2).
Trotz VDC33 und VDC66 blieb die VFLAIR ein signifikanter Prädiktor für die Gesamtleistung während des Nachbeobachtungszeitraums bei der VADAS und den exekutiven Funktionen. Allerdings hatte die VFLAIR keinen unabhängigen Vorhersagewert, der zu dem der VDC100 für irgendeinen der kognitiven Messwerte hinzukam.
Diskussion
In dieser Studie wurden die longitudinalen kognitiven Auswirkungen partieller WML untersucht, von den schwächsten Veränderungen in der normal erscheinenden weißen Substanz bis hin zu den voll entwickelten Läsionen. Die Untersuchung verwendete eine neuartige, selbstüberwachte, multispektrale MRT-Gewebesegmentierungsmethode auf der Grundlage von DC (Gonçalves et al., 2014) und jährlich wiederholte neuropsychologische Bewertungen im Rahmen einer dreijährigen Nachbeobachtung. Verschiedene Gewebetypen wurden unter gleichzeitiger Verwendung aller verfügbaren MRT-Sequenzen identifiziert. Die WML wurde dann nach Teilvolumina als kleine, intermediäre und vollständige Läsion kategorisiert.
Im Gegensatz zur konventionellen manuellen Gewebesegmentierung, bei der die Entscheidung auf einem impliziten Schwellenwert für die Graustufe basiert, bietet die vorgeschlagene Methode Zugang zu Informationen über Läsionen „unter dem Schwellenwert“. Dies ermöglicht eine bessere Beurteilung des Läsionsverlaufs (qualitative Informationen) sowie eine Sub-Voxel-Volumetrie (quantitative Informationen). Es gibt auch andere Methoden, die Informationen über Gewebeproportionen liefern (Van Leemput et al., 2003; Manjón et al., 2010). Sie verwenden jedoch bestimmte Prioritäten, die sie für die Erkennung von WML ungeeignet machen, wie z. B. die Annahme, dass ein Voxel nicht mehr als zwei Gewebetypen enthalten darf.
Das Hauptergebnis der vorliegenden Studie war, dass selbst das kleinste partielle WML-Volumen, VDC33, bereits bei Studienbeginn signifikant mit einer schlechteren exekutiven Leistung assoziiert war und eine zukünftige Verschlechterung der exekutiven Funktionen über die dreijährige Nachbeobachtungszeit vorhersagte. Dieser Effekt war unabhängig von demographischen Faktoren und insbesondere auch von dem konventionell bewerteten Hyperintensitätsvolumen auf FLAIR-Bildern. In einer Untergruppe von Probanden konnten wir außerdem zeigen, dass VDC33 wahrscheinlich die frühesten Veränderungen in der normal erscheinenden weißen Substanz darstellen, da ihre Entdeckung zu Beginn der Studie auf die zukünftige Lage der voll entwickelten Läsionen nach der Nachbeobachtung hinwies (Anhang I).
Die Läsionen im mittleren Stadium, VDC66, waren unabhängig voneinander mit einem umfassenderen kognitiven Abbau verbunden, einschließlich Veränderungen der Verarbeitungsgeschwindigkeit und der exekutiven Funktionen sowie der globalen kognitiven Funktionen. Darüber hinaus waren die voll ausgeprägten Läsionen, VDC100, mit noch ausgeprägteren Auswirkungen verbunden, die sich auf alle bewerteten kognitiven Bereiche erstreckten, sowohl bei Studienbeginn als auch bei der Nachuntersuchung. Es ist nicht überraschend, dass die VDC100 ein starker Prädiktor für den kognitiven Abbau ist. Da die VDC100 hoch mit der VFLAIR korreliert war, die zuvor eine starke Assoziation mit kognitiven Veränderungen gezeigt hat (Jokinen et al., 2011; Kooistra et al., 2014), sollte sie eine ähnliche Vorhersagekraft besitzen.
Das neue und wichtigste Ergebnis der vorliegenden Untersuchung ist, dass das Volumen der Läsionen, die unterhalb der Entscheidungsschwelle entdeckt wurden, bereits die Vorhersage bestimmter kognitiver Werte ermöglicht. Die ersten Anzeichen einer kognitiven Verschlechterung wurden insbesondere bei den exekutiven Funktionen festgestellt, von denen man annimmt, dass sie im Wesentlichen von der Integrität der präfrontal-subkortikalen Verbindungen der weißen Substanz abhängen (O’sullivan et al., 2001). Zu den exekutiven Funktionen gehören kognitive Kontrollprozesse wie geistige Flexibilität, Inhibition und Planung im Zusammenhang mit komplexem zielgerichtetem Verhalten. Diese Funktionen sind für die funktionellen Fähigkeiten einer Person im Alltag von entscheidender Bedeutung (Tomaszewski Farias et al., 2009).
Die in diesem Artikel vorgestellten Ergebnisse unterstützen die Hypothese, dass WML-Hyperintensitäten nur „die Spitze des Eisbergs“ darstellen, während sich die Schädigung der weißen Substanz bei SVD tatsächlich als allmählicher Prozess entwickelt, der weitere Bereiche des Gehirns betrifft (Schmidt et al., 2011; Maillard et al., 2013). Studien zur Diffusionsbildgebung haben gezeigt, dass subtile mikrostrukturelle Veränderungen, selbst im normal erscheinenden Hirngewebe, mit kognitiven Beeinträchtigungen zusammenhängen und schlechte kognitive und klinische Ergebnisse in der Nachsorge vorhersagen (Schmidt et al., 2010; Jokinen et al., 2013). Die mikrostrukturelle Integrität ist besonders in der Nähe von WML reduziert, wie die fraktionelle Anisotropie zeigt (Maillard et al., 2011). Dieses als „WMH Penumbra“ bezeichnete Phänomen könnte mit den in unserer Studie beobachteten partiellen WML-Volumina im Frühstadium zusammenhängen. Allerdings können frühe Läsionsausbrüche auch in einiger Entfernung von der voll entwickelten WML auftreten, wie in Anhang I ausführlich dargestellt. Unseres Wissens wurde der Zusammenhang zwischen diesen unterschwelligen fokalen Veränderungen und dem kognitiven Ergebnis bisher noch nicht aufgezeigt.
Die vorliegende Stichprobe besteht aus einer gemischten Gruppe älterer Probanden, die gleichmäßig nach allen WML-Schweregraden, von leicht bis schwer, geschichtet sind. Die Teilnehmer wurden in verschiedenen Einrichtungen rekrutiert, und zwar auf der Grundlage unterschiedlicher Überweisungsgründe, die die Vielfalt der in der klinischen Praxis anzutreffenden Patienten mit WML repräsentieren (LADIS Study Group, 2011). Diese Heterogenität der Probanden kann jedoch die subtilsten Effekte zwischen bildgebenden Befunden und kognitivem Abbau verschleiern. Wie bei Längsschnittstudien zu Alterung und zerebrovaskulären Erkrankungen üblich, gingen einige Daten verloren, weil die Probanden die Nachbeobachtung abbrachen oder nicht in der Lage waren, die Auswertungen vollständig abzuschließen.
Eine Einschränkung besteht darin, dass das LADIS-Bildgebungsprotokoll ursprünglich nicht für die vorliegende quantitative Segmentierungsmethode konzipiert war, so dass nur ein Teil der ursprünglichen Bildgebungsdaten verwendet werden konnte. Darüber hinaus sind Bildrauschen, Auflösung und Bewegungsartefakte alles Faktoren, die das Ergebnis einer multizentrischen Studie wie der hier vorgestellten beeinflussen können. Dies gilt insbesondere, wenn es um partielle Volumeneffekte geht. Trotz dieser Einschränkungen und nach Korrektur einiger der oben genannten Störfaktoren konnten wir subtile Hinweise auf ein Fortschreiten der Läsion erkennen, basierend auf Voxeln mit einer geringen Wahrscheinlichkeit, dass es sich um eine Läsion handelt.
Um die Zuverlässigkeit der in diesem Manuskript gezeigten Ergebnisse zu verbessern, hätte eine größere Kohorte in Betracht gezogen werden können. Aufgrund von Bedenken hinsichtlich der Konsistenz zwischen den Zentren und Änderungen der Bildgebungseinrichtungen zu verschiedenen Zeiten sollte eine strengere Richtlinie hinsichtlich der verwendeten MRT-Sequenzen angewandt werden.
Zu den Stärken dieser Studie gehört eine neuartige, robuste, selbstüberwachte und datengesteuerte Bildanalysemethode, die die Identifizierung von Gewebetypen und die Quantifizierung von pathologischen Hirnveränderungen in einem sehr frühen Stadium ermöglicht, in dem eine herkömmliche MRT-Auswertung nicht sinnvoll wäre. Die Studie profitiert auch von detaillierten neuropsychologischen Auswertungen, die im Rahmen einer dreijährigen Nachbeobachtung in jährlichen Abständen durchgeführt werden.
Zusammenfassend lässt sich sagen, dass frühe Veränderungen in der normal erscheinenden weißen Substanz bereits einen Hinweis auf eine fortschreitende Verschlechterung und schlechte kognitive Ergebnisse geben. In diesem Stadium sind in erster Linie die exekutiven Funktionen betroffen, aber die nachteiligen Auswirkungen auf die Kognition werden globaler, wenn sich die Veränderungen allmählich zu einer ausgewachsenen WML entwickeln, die schließlich auch durch konventionelle MRT-Gewebesegmentierung nachweisbar ist. Diese Ergebnisse bestätigen die vorgeschlagene multispektrale MRT-Gewebesegmentierungsmethode als ein vielversprechendes Instrument, das einen zusätzlichen Wert bei der Erkennung des Risikos einer SVD und eines klinisch bedeutsamen fortschreitenden kognitiven Verfalls hat.
Beiträge der Autoren
Alle Autoren haben das Manuskript auf wichtige intellektuelle Inhalte hin kritisch überarbeitet. Darüber hinaus waren die wichtigsten Arbeiten der einzelnen Autoren für die Studie wie folgt: HJ; Verantwortlicher Prüfer und korrespondierender Autor, Design und Konzeption der Studie, neuropsychologische und klinische Datenerhebung, statistische Analyse und Interpretation, Entwurf und Fertigstellung des Manuskripts. NG; Verantwortlicher Prüfarzt, Planung und Konzeption der Studie, Entwicklung der MRT-Segmentierungsmethode, MRT-Datenanalyse, Entwurf und Fertigstellung des Manuskripts. RV; Entwicklung der MRT-Segmentierungsmethode, MRT-Datenanalyse, Design und Konzeptualisierung der Studie. JL; Fachkenntnisse in statistischer Analyse und Interpretation. FF; Design der LADIS-Studie, verantwortlich für die MRT-Methoden. RS; Design der LADIS-Studie, verantwortlich für die MRT-Methoden. FB; Design der LADIS-Studie, verantwortlich für die MRT-Methoden. SM; Konstruktion der neuropsychologischen Testbatterie, neuropsychologische und klinische Datenerfassung. AV; Neuropsychologische und klinische Datenerfassung. DI; Studienkoordinator, Mitglied des LADIS-Lenkungsausschusses, Design der LADIS-Studie. LP; Koordinierung und Design der LADIS-Studie. TE; Mitglied des LADIS-Lenkungsausschusses, Design der LADIS-Studie, Studienkonzeption und -design. HJ und NG haben zu gleichen Teilen zu dieser Arbeit beigetragen.
Erklärung zu Interessenkonflikten
Die Autoren erklären, dass die Forschung in Abwesenheit jeglicher kommerzieller oder finanzieller Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Danksagungen
Die Leukoaraiose- und Behinderungsstudie wurde von der Europäischen Union unterstützt (Zuschuss QLRT-2000-00446). Die Arbeit von HJ wurde durch Zuschüsse des Klinischen Forschungsinstituts und des Medizinischen Forschungsfonds des Zentralkrankenhauses der Universität Helsinki sowie der Ella und Georg Ehrnrooth-Stiftung unterstützt. NG wurde durch das Stipendium Nr. SFRH/BD/36178/2007 der Fundação para a Ciência e Tecnologia gefördert.
Ergänzendes Material
Das ergänzende Material zu diesem Artikel finden Sie online unter: https://www.frontiersin.org/article/10.3389/fnins.2015.00455
Abkürzungen
DC, discriminative clustering; FLAIR, fluid-attenuated inversion recovery; LADIS, Leukoaraiosis and Disability Study; MMSE, Mini-Mental State Examination; MRI, magnetic resonance imaging; SVD, small vessel disease; VADAS, Vascular Dementia Assessment Scale-Cognitive Subscale; VDC33, Volumen der Voxel, die einen kleinen Anteil der Läsion enthalten; VDC66, Volumen der Voxel, die einen mittleren Anteil der Läsion enthalten; VDC100, Volumen der Voxel, die einen vollständigen Anteil der Läsion enthalten; VDCHARD = VDC100 + VDC66; VFLAIR, WML-Volumen, gemessen mit konventioneller halbautomatischer Analyse von FLAIR-Bildern; WML, Läsion der weißen Substanz.
Fußnoten
1. ^VFLAIR, WML-Volumen, gemessen mit konventioneller halbautomatischer Analyse auf FLAIR-Bildern.
2. ^VDCHARD, Volumen, das den Voxeln entspricht, bei denen die Mehrheit des Gewebes eine Läsion ist.
Ashburner, J., und Friston, K. J. (2005). Unified segmentation. Neuroimage 26, 839-851. doi: 10.1016/j.neuroimage.2005.02.018
PubMed Abstract | CrossRef Full Text | Google Scholar
Cruz-Barbosa, R., and Vellido, A. (2011). Semi-supervised analysis of human brain tumour from partially labeled MRS information using manifold learning models. Int. J. Neural Syst. 21, 17-29. doi: 10.1142/S0129065711002626
PubMed Abstract | CrossRef Full Text | Google Scholar
Ferris, S. H. (2003). General measures of cognition. Int. Psychogeriatr. 15(Suppl. 1), 215-217. doi: 10.1017/S1041610203009220
PubMed Abstract | CrossRef Full Text | Google Scholar
Folstein, M. F., Folstein, S. E., and McHugh, P. R. (1975). Mini-mental state. a practical method for grading the cognitive state of patients for the clinician. J. Psychiatr. Res. 12, 189-198. doi: 10.1016/0022-3956(75)90026-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Friston, K. (2003). „Statistical parameter mapping. a practical guide“, in Neuroscience Databases, ed R. Kötter (New York, NY: Springer), 237-250. Online verfügbar unter: http://www.springer.com/us/book/9781402071652
Goebel, R., Esposito, F., and Formisano, E. (2006). Analyse funktioneller Bildanalyse-Wettbewerbsdaten mit brainvoyager QX: von der Einzelsubjekt- zur kortikal ausgerichteten Gruppenanalyse mit allgemeinen linearen Modellen und selbstorganisierender Gruppenanalyse mit unabhängigen Komponenten. Hum. Brain Mapp. 27, 392-401. doi: 10.1002/hbm.20249
PubMed Abstract | CrossRef Full Text | Google Scholar
Gonçalves, N., Nikkilä, J., and Vigário, R. (2014). Self-supervised MRI tissue segmentation by discriminative clustering. Int. J. Neural Syst. 24:1450004. doi: 10.1142/S012906571450004X
PubMed Abstract | CrossRef Full Text | Google Scholar
Gouw, A. A., van der Flier, W. M., Fazekas, F., van Straaten, E. C., Pantoni, L., Poggesi, A., et al. (2008). Progression von Hyperintensitäten der weißen Substanz und Auftreten neuer Lakunen über einen Zeitraum von 3 Jahren: die Leukoaraiose- und Behinderungsstudie. Stroke 39, 1414-1420. doi: 10.1161/STROKEAHA.107.498535
PubMed Abstract | CrossRef Full Text
Jokinen, H., Gouw, A. A., Madureira, S., Ylikoski, R., van Straaten, E. C., van der Flier, W. M., et al. (2011). Auftretende Lakunen beeinflussen den kognitiven Verfall: die LADIS-Studie. Neurology 76, 1872-1878. doi: 10.1212/WNL.0b013e31821d752f
PubMed Abstract | CrossRef Full Text | Google Scholar
Jokinen, H., Lipsanen, J., Schmidt, R., Fazekas, F., Gouw, A. A., van der Flier, W. M., et al. (2012). Hirnatrophie beschleunigt den kognitiven Verfall bei zerebraler Kleingefäßerkrankung: die LADIS-Studie. Neurology 78, 1785-1792. doi: 10.1212/WNL.0b013e3182583070
PubMed Abstract | CrossRef Full Text | Google Scholar
Jokinen, H., Schmidt, R., Ropele, S., Fazekas, F., Gouw, A. A., Barkhof, F., et al. (2013). Diffusionsveränderungen sagen kognitive und funktionelle Ergebnisse voraus: die LADIS-Studie. Ann. Neurol. 73, 576-583. doi: 10.1002/ana.23802
PubMed Abstract | CrossRef Full Text | Google Scholar
Kooistra, M., Geerlings, M. I., van der Graaf, Y., Mali, W. P., Vincken, K. L., Kappelle, L. J., et al. (2014). Vaskuläre Hirnläsionen, Hirnatrophie und kognitiver Verfall. Die zweite Manifestations of Arterial Disease-Magnetic Resonance (SMART-MR) Studie. Neurobiol. Aging 35, 35-41. doi: 10.1016/j.neurobiolaging.2013.07.004
PubMed Abstract | CrossRef Full Text | Google Scholar
LADIS Study Group (2011). 2001-2011: ein Jahrzehnt LADIS-Studie (Leukoaraiose und Behinderung): Was haben wir über Veränderungen der weißen Substanz und die Erkrankung der kleinen Gefäße gelernt? Cerebrovasc. Dis. 32, 577-588. doi: 10.1159/000334498
PubMed Abstract | CrossRef Full Text
Lawton, M. P., and Brody, E. M. (1969). Assessment of older people: self-maintaining and instrumental activities of daily living. Gerontologist 9, 179-186. doi: 10.1093/geront/9.3_Part_1.179
PubMed Abstract | CrossRef Full Text | Google Scholar
Lee, J. D., Su, H. R., Cheng, P. E., Liou, M., Aston, J. A. D., Tsai, A. C., et al. (2009). Segmentierung von MR-Bildern mithilfe einer Leistungstransformation. IEEE Trans. Med. Imaging 28, 894-905. doi: 10.1109/TMI.2009.2012896
PubMed Abstract | CrossRef Full Text | Google Scholar
MacLeod, C. M. (1991). Ein halbes Jahrhundert Forschung über den Stroop-Effekt: ein integrativer Überblick. Psychol. Bull. 109, 163-203. doi: 10.1037/0033-2909.109.2.163
PubMed Abstract | CrossRef Full Text | Google Scholar
Maillard, P., Carmichael, O., Harvey, D., Fletcher, E., Reed, B., Mungas, D., et al. (2013). FLAIR- und Diffusions-MRT-Signale sind unabhängige Prädiktoren für Hyperintensitäten der weißen Substanz. Am. J. Neuroradiol. 34, 54-61. doi: 10.3174/ajnr.A3146
PubMed Abstract | CrossRef Full Text | Google Scholar
Maillard, P., Fletcher, E., Harvey, D., Carmichael, O., Reed, B., Mungas, D., et al. (2011). Hyperintensität der weißen Substanz Penumbra. Stroke 42, 1917-1922. doi: 10.1161/STROKEAHA.110.609768
PubMed Abstract | CrossRef Full Text | Google Scholar
Manjón, J. V., Tohka, J., and Robles, M. (2010). Verbesserte Schätzungen von partiellen Volumenkoeffizienten aus verrauschten Gehirn-MRT unter Verwendung von räumlichem Kontext. Neuroimage 53, 480. doi: 10.1016/j.neuroimage.2010.06.046
PubMed Abstract | CrossRef Full Text | Google Scholar
Moleiro, C., Madureira, S., Verdelho, A., Ferro, J. M., Poggesi, A., Chabriat, H., et al. (2013). Bestätigende Faktorenanalyse der neuropsychologischen Bewertungsbatterie der LADIS-Studie: eine Längsschnittanalyse. J. Clin. Exp. Neuropsychol. 35, 269-278. doi: 10.1080/13803395.2013.770822
PubMed Abstract | CrossRef Full Text | Google Scholar
Muller, M., Appelman, A. P., van der Graaf, Y., Vincken, K. L., Mali, W. P., and Geerlings, M. I. (2011). Hirnatrophie und Kognition: Interaktion mit zerebrovaskulärer Pathologie? Neurobiol. Aging 32, 885-893. doi: 10.1016/j.neurobiolaging.2009.05.005
PubMed Abstract | CrossRef Full Text | Google Scholar
O’sullivan, M., Jones, D. K., Summers, P. E., Morris, R. G., Williams, S. C., and Markus, H. S. (2001). Beweise für eine kortikale „Abschaltung“ als Mechanismus des altersbedingten kognitiven Verfalls. Neurology 57, 632-638. doi: 10.1212/WNL.57.4.632
PubMed Abstract | CrossRef Full Text | Google Scholar
Pantoni, L., Basile, A. M., Pracucci, G., Asplund, K., Bogousslavsky, J., Chabriat, H., et al. (2005). Auswirkungen altersbedingter Veränderungen der weißen Substanz des Gehirns auf den Übergang zur Behinderung – die LADIS-Studie: Grundprinzip, Design und Methodik. Neuroepidemiology 24, 51-62. doi: 10.1159/000081050
PubMed Abstract | CrossRef Full Text | Google Scholar
Pham, D. L., and Prince, J. L. (1998). Partial volume estimation and the fuzzy C-means algorithm. Int. Conf. Image Process. 3, 819-822.
Google Scholar
Poels, M. M., Ikram, M. A., van der Lugt, A., Hofman, A., Niessen, W. J., Krestin, G. P., et al. (2012). Zerebrale Mikroblutungen sind mit einer schlechteren kognitiven Funktion verbunden: die Rotterdam-Scan-Studie. Neurology 78, 326-333. doi: 10.1212/WNL.0b013e3182452928
PubMed Abstract | CrossRef Full Text | Google Scholar
Reitan, R. M. (1958). Validität des Trail Making Test als Indikator für organische Hirnschäden. Percept. Mot. Skills 8, 271-276. doi: 10.2466/pms.1958.8.3.271
CrossRef Full Text | Google Scholar
Schmidt, R., Ropele, S., Ferro, J., Madureira, S., Verdelho, A., Petrovic, K., et al. (2010). Diffusionsgewichtete Bildgebung und Kognition in der Leukoariose- und Behinderungsstudie bei älteren Menschen. Stroke 41, e402-e408. doi: 10.1161/STROKEAHA.109.576629
PubMed Abstract | CrossRef Full Text
Schmidt, R., Schmidt, H., Haybaeck, J., Loitfelder, M., Weis, S., Cavalieri, M., et al. (2011). Heterogenität bei altersbedingten Veränderungen der weißen Substanz. Acta Neuropathol. 122, 171-185. doi: 10.1007/s00401-011-0851-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Smith, S. M., Jenkinson, M., Woolrich, M. W., Beckmann, C. F., Behrens, T. E. J., Johansen-Berg, H., et al. (2004). Fortschritte in der funktionellen und strukturellen MR-Bildanalyse und Implementierung als FSL. Neuroimage 23(Suppl. 1), S208-S219. doi: 10.1016/j.neuroimage.2004.07.051
PubMed Abstract | CrossRef Full Text | Google Scholar
Styner, M., Lee, J., Chin, B., Chin, M. S., Commowick, O., Tran, H., et al. (2008). „3D-Segmentierung in der Klinik: eine große Herausforderung II: Segmentierung von MS-Läsionen,“ MIDAS Journal, MICCAI 2008 Workshop. Online verfügbar unter: http://hdl.handle.net/10380/1509
Tomaszewski Farias, S., Cahn-Weiner, D. A., Harvey, D. J., Reed, B. R., Mungas, D., Kramer, J. H., et al. (2009). Längsschnittliche Veränderungen des Gedächtnisses und der exekutiven Funktionen sind mit Längsschnittveränderungen bei instrumentellen Aktivitäten des täglichen Lebens bei älteren Erwachsenen verbunden. Clin. Neuropsychol. 23, 446-461. doi: 10.1080/13854040802360558
PubMed Abstract | CrossRef Full Text | Google Scholar
Van Leemput, K., Maes, F., Vandermeulen, D., and Suetens, P. (1999). Automatisierte modellbasierte Gewebeklassifikation von MR-Bildern des Gehirns. IEEE Trans. Med. Imaging 18, 897-908. doi: 10.1109/42.811270
PubMed Abstract | CrossRef Full Text | Google Scholar
Van Leemput, K., Maes, F., Vandermeulen, D., Colchester, A., and Suetens, P. (2001). Automatisierte Segmentierung von Läsionen bei Multipler Sklerose durch Erkennung von Ausreißern. IEEE Trans. Med. Imaging 20, 677-688. doi: 10.1109/42.938237
PubMed Abstract | CrossRef Full Text | Google Scholar
Van Leemput, K., Maes, F., Vandermeulen, D., and Suetens, P. (2003). A unifying framework for partial volume segmentation of brain MR images. IEEE Trans. Med. Imaging 22, 105-119. doi: 10.1109/TMI.2002.806587
PubMed Abstract | CrossRef Full Text | Google Scholar
van Straaten, E. C., Fazekas, F., Rostrup, E., Scheltens, P., Schmidt, R., Pantoni, L., et al. (2006). Auswirkungen der Bewertungsmethode für Hyperintensitäten der weißen Substanz auf die Korrelationen mit klinischen Daten: die LADIS-Studie. Stroke 37, 836-840. doi: 10.1161/01.STR.0000202585.26325.74
PubMed Abstract | CrossRef Full Text | Google Scholar
Wismüller, A., Vietze, F., Behrends, J., Meyer-Baese, A., Reiser, M., and Ritter, H. (2004). Vollautomatische biomedizinische Bildsegmentierung durch selbstorganisierte Modellanpassung. Neural Netw. 17, 1327. doi: 10.1016/j.neunet.2004.06.015
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhang, Y., Brady, M., and Smith, S. (2001). Segmentierung von MR-Bildern des Gehirns durch ein verstecktes Markov-Zufallsfeldmodell und den Erwartungsmaximierungsalgorithmus. IEEE Trans. Med. Imaging 20, 45-57. doi: 10.1109/42.906424
PubMed Abstract | CrossRef Full Text | Google Scholar
Zijdenbos, A. P., Forghani, R., and Evans, A. C. (2002). Automatische Pipeline-Analyse von 3-D-MRT-Daten für klinische Studien: Anwendung auf Multiple Sklerose. IEEE Trans. Med. Imaging 21, 1280-1291. doi: 10.1109/TMI.2002.806283
PubMed Abstract | CrossRef Full Text | Google Scholar