- Introduction
- Materialien und Methoden
- Teilnehmer
- Studienverfahren, EEG-Datenerfassung und -Analyse
- Ergebnisse
- Teilnehmer
- Resting State EEG
- Vergleich der spektralen Leistungsdichten (PSDs) des Fp1-Kanals
- Fp1-Kanal Ruhe-EEG Test/Wiederholungs-Vergleich
- Diskussion
- Beiträge der Autoren
- Finanzierung
- Erklärung zu Interessenkonflikten
- Dankesworte
Introduction
Neurodegenerative Erkrankungen stellen weltweit einen großen ungedeckten medizinischen Bedarf dar und erfordern die Entwicklung neuer krankheitsmodifizierender Therapien. Angesichts der heimtückischen Natur dieser Erkrankungen und der hohen Kosten vieler diagnostischer Tests besteht ein erheblicher Bedarf an allgemein verfügbaren, zuverlässigen und kostengünstigen Biomarkern, um das Fortschreiten neurodegenerativer Prozesse in einem für die Arzneimittelentwicklung geeigneten Zeitrahmen zu verfolgen. In diesem Zusammenhang könnte das EEG ein bemerkenswertes Potenzial besitzen. Obwohl das EEG anfällig für bekannte Lebensstilfaktoren und Medikamente ist, hat es viele erhebliche Vorteile. Das EEG spiegelt die synaptische Aktivität wider, die ein gemeinsamer Nenner für die funktionellen Auswirkungen neurodegenerativer Prozesse ist. Das EEG ist eine nicht-invasive, tragbare, sichere und kostengünstige Technologie, die weithin akzeptiert ist und eine relativ kurze Aufnahmezeit erfordert. Qualitatives EEG wird in der klinischen Praxis routinemäßig zur Diagnose von Epilepsie eingesetzt. In jüngerer Zeit wurde eine Integration eines quantitativen EEG-Biomarkers (qEEG) und einer klinischen Bewertung für die Bewertung der Aufmerksamkeitsdefizit-/Hyperaktivitätsstörung (ADHS) vorgeschlagen und von der FDA (Food and Drug Administration) als Klasse II zur Unterstützung der klinischen Bewertung von ADHS eingestuft (Lenartowicz und Loo, 2014; Snyder et al., 2015). qEEG befindet sich in der Erprobungsphase für den Einsatz als Endpunkt bei neurodegenerativen Erkrankungen in klinischen Studien. Jüngste Fortschritte bei der Datenanalyse und -interpretation sowie eine verbesserte räumliche Auflösung haben jedoch das Potenzial des EEG als zuverlässiger, genauer Biomarker für das Fortschreiten neurodegenerativer Erkrankungen erhöht. Zahlreiche Berichte über qEEG-Analysen im Ruhezustand unterstützen seinen potenziellen Wert als Biomarker für die Erkennung von neuronalen Signaturen der Neurodegeneration bei der Alzheimer-Krankheit (Babiloni et al., 2011; Moretti et al., 2011; Berka et al., 2014; Chen et al., 2015; Garn et al., 2015; Ruffini et al., 2016; Waninger et al., 2016), der Parkinson-Krankheit (Sarnthein und Jeanmonod, 2007; Babiloni et al., 2011; Soria-Frisch et al, 2014; Shani Waninger et al., 2015; Kroupi et al., 2017) und frontotemporale Demenz (Pijnenburg et al., 2008; Nishida et al., 2011; Caso et al., 2012; Goossens et al., 2016).
Im Laufe der Jahre hat sich auch die EEG-Hardwaretechnologie weiterentwickelt, und es sind mehrere drahtlose Mehrkanalsysteme entstanden, die hochwertige EEG- und physiologische Signale in einem einfacheren, bequemeren und komfortableren Design als die traditionellen, schwerfälligen Systeme liefern. Herkömmliche EEG-Systeme erfordern einen langwierigen Zusammenbau und eine lange Anwendungszeit, die in der Regel mit einem Abschleifen der Kopfhaut des Patienten verbunden ist. Der Zeitaufwand für die Anwendung und die Unannehmlichkeiten machen den Einsatz dieser herkömmlichen Systeme in Bevölkerungsgruppen, die an Demenz erkrankt sind und bei denen die Zusammenarbeit mit langwierigen klinischen Verfahren oft schwierig ist, schwierig. Mehrere derzeit verfügbare kabellose Systeme können jedoch in 20 Minuten oder weniger angewendet werden, ohne dass die Anwendung unangenehm ist und mit einem bequemen Sitz während der Erfassung. In Verbindung mit den Fortschritten bei der Signaldetektion und den quantitativen Analysetechniken sind die drahtlosen Systeme ideale Kandidaten für eine relativ schnelle, erträgliche klinische Bewertung von potenziell schwierigen Demenzpopulationen, wie z. B. der verhaltensbedingten Variante der frontotemporalen Demenz, die durch auffällige Verhaltens- und Persönlichkeitsveränderungen gekennzeichnet ist.
In jüngster Zeit ist auch ein wachsender Markt für tragbare Technologien für Verbraucher entstanden, der zu Systemen mit begrenzten Kanälen für den persönlichen Gebrauch führt, z. B. für Meditations- und Entspannungstraining. Es ist denkbar, dass diese Systeme, auch wenn sie nur eine begrenzte Reichweite haben, auch in ausgewählten klinischen Studien eingesetzt werden können. Die Anwendung dieser Verbrauchersysteme in der klinischen Forschung ist jedoch noch nicht umfassend erforscht worden, und die Genauigkeit und Zuverlässigkeit dieser Systeme bei wiederholten Messungen ist noch nicht hinreichend geklärt. Außerdem ist nicht klar, ob die Erfassung mit begrenzten Kanälen ausreichende Daten und eine ausreichende anatomische Abdeckung bietet, um die neuronalen Signaturen bei Patienten mit neurodegenerativen Erkrankungen zu bewerten.
Die aktuelle Studie sollte eine erste Bewertung des Potenzials von EEG-Systemen für Verbraucher für klinische Studien liefern, indem die Benutzerfreundlichkeit, Genauigkeit und Zuverlässigkeit von zwei drahtlosen Mehrkanal-EEG-Systemen medizinischer Qualität, B-Alert X24 und Enobio 20, mit zwei Verbrauchersystemen mit begrenztem Kanal, Muse und Mindwave, verglichen wurden.
Materialien und Methoden
Teilnehmer
Die Studienpopulation umfasste fünf gesunde Teilnehmer, die für die Studie in Frage kamen (Tabelle 1). Die Probanden wurden ausgeschlossen, wenn sie nach Überprüfung ihrer Krankengeschichte, der Begleitmedikation und ihres Lebensstils (Alkohol- und Koffeinkonsum sowie Raucherstatus) als nicht gesund eingestuft wurden. Insbesondere wurden sie von der Studie ausgeschlossen, wenn sie eine Vorgeschichte von Epilepsie oder anderen Schlaf-, neurologischen oder psychiatrischen Störungen hatten oder Medikamente einnahmen oder einen Lebensstil führten, von dem bekannt ist, dass er das EEG-Signal beeinflusst, wie z. B. Rauchen und erheblicher Alkohol- und Koffeinkonsum.

Table 1. Demografische Daten der Studienpopulation und Ausgangscharakteristika.
Von allen Studienteilnehmern wurde eine schriftliche Einverständniserklärung gemäß den vom Chesapeake Institutional Review Board vorgeschriebenen Richtlinien für experimentelle Untersuchungen am Menschen eingeholt.
Studienverfahren, EEG-Datenerfassung und -Analyse
Um mögliche EEG-Signalschwankungen im Zusammenhang mit der Nahrungsaufnahme und zirkadianen Schwankungen zu vermeiden, fanden alle Besuche am Morgen nach einem kohlenhydratarmen, proteinreichen Standardfrühstück (um die postprandiale Schläfrigkeit zu minimieren) am Studienort des Advanced Brain Monitoring (ABM) Forschungslabors statt. Darüber hinaus wurden die Teilnehmer gebeten, am Abend vor dem Besuch der Studie keine alkoholischen Getränke zu sich zu nehmen und am Morgen des Besuchs zu fasten und auf Koffein zu verzichten.
EEG-Daten wurden bei zwei separaten Besuchen im Abstand von etwa einer Woche mit zwei mehrkanaligen (20 Kanäle) medizinischen EEG-Systemen, B-Alert (Advanced Brain Monitoring, ABM) und Enobio (Neuroelectrics) (Abbildung 1, Tabelle 2) und zwei Verbrauchersystemen mit begrenztem Kanal, Muse (Interaxon, 2 Kanäle) und Mindwave (Neurosky, ein Kanal) (Abbildung 1, Tabelle 2) in folgender Reihenfolge erfasst: Muse, Mindwave, B-Alert, Enobio. Das B-Alert X24 EEG-System und Enobio sind beide CE-zertifizierte, drahtlose 20-Kanal-Systeme, die in der international üblichen 10-20-Montage eingesetzt werden und EEG-Signale mit einer Abtastrate von 256 Hz erfassen. Darüber hinaus wurde B-Alert von der FDA als Medizinprodukt zugelassen.
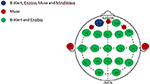
Abbildung 1. Anatomische Kanalverteilung der Mehr- und Grenzkanal-EEG-Systeme. Darstellung der gemeinsamen und einzigartigen Kanäle der vier untersuchten EEG-Systeme. Der gemeinsame Kanal aller vier EEG-Systeme, Fp1 (blau); Kanäle, die nur im Muse-System vorhanden sind (rot); Kanäle, die von den Mehrkanalsystemen B-Alert und Enobio gemeinsam genutzt werden (grün).

Tabelle 2. EEG-Systeme im Vergleich.
B-Alert verwendet Mastoide als Referenzkanal. Enobio kann mit einer Mastoid-Referenz, einem Ohr-Clip oder mit anderen Kopfhautpositionen verwendet werden. Mindwave hat ebenfalls eine Referenz am Ohrclip und Muse hat drei Referenzkanäle an der Stirn. Im Gegensatz zu den medizinischen EEG-Systemen haben beide Verbrauchersysteme jedoch trockene Elektroden und keine Impedanzprüfung.
Diese Technologien wurden aufgrund ihrer Fähigkeit ausgewählt, den Endnutzern Roh-EEG-Ergebnisse durch einen praktischen und nicht kostspieligen Zugang zur Verfügung zu stellen.
Zehn Minuten EEG im Ruhezustand wurden bei geöffneten Augen (EO) mit visueller Fixierung auf ein auf einem Computerbildschirm dargestelltes Kreuzsymbol (5 min) sowie bei geschlossenen Augen (EC) für 5 min erfasst.
Da alle vier Systeme nur den FP1-Kanal gemeinsam nutzen (Abbildung 1), wurden EEG-Muster (roh und dekontaminiert), Leistungsspektraldichten (PSDs) und Vergleiche der Test-/Retest-Zuverlässigkeit zwischen den vier in der Studie untersuchten EEG-Systemen durchgeführt, wobei der Schwerpunkt auf der Fp1-Elektrode sowohl unter EO- als auch unter EC-Bedingungen lag.
Die EEG-Daten von jedem System wurden mit Hilfe speziell entwickelter Funktionen in MATLAB (Mathworks) geladen. Die während der Pausen und Anweisungen aufgezeichneten EEG-Daten wurden vor der Analyse verworfen. Die Leistungsspektraldichte des EEG für jede 1-Sekunden-Epoche wurde mit der modifizierten Periodogramm-Methode von Welch mit einem Hamming-Fenster von 1 Sekunde Länge berechnet. Die PSDs wurden für das EEG in Ruhe sowohl bei offenen als auch bei geschlossenen Augen berechnet. Um gleiche Einheiten (μV) zu ermöglichen, wurde ein Korrekturfaktor von 1,25 (Muse), 0,25 (MindWave) oder 1.000 (Enobio 20) angewendet. Alle PSD-Daten des Fp1-Kanals wurden für die fünf Probanden bei jedem Besuch gemittelt. Der Test-Retest wurde durch Berechnung und Darstellung von Vist1/Besuch2 durchgeführt.
Ergebnisse
Teilnehmer
Die Teilnehmer waren alle gesunde Freiwillige mit einem Durchschnittsalter von 27 Jahren, sie waren alle Rechtshänder, Nichtraucher und überwiegend männlich (60 %). Ihre demographischen Daten und Ausgangscharakteristika sind in Tabelle 1 zusammengefasst.
Resting State EEG
EEG-Daten wurden erfolgreich von allen vier getesteten Systemen gesammelt. Wie erwartet, war die Einrichtungszeit aufgrund der trockenen Elektroden und der begrenzten Anzahl von Kanälen bei den Consumer-EEG-Systemen deutlich geringer. Es wurde jedoch kein Unterschied in der Toleranz und Akzeptanz der Probanden zwischen den vier Systemen festgestellt.
Muster von EEG-Rohdaten unter EO- (Abbildung 2) und EC-Bedingungen (Abbildung 3) wurden von jedem System erfasst und ausgewertet. Muse und Mindwave waren anfälliger für Artefakte aufgrund von Augenblinzeln und Muskelbewegungen im frontalen Bereich beim Öffnen der Augen (Abbildung 2).
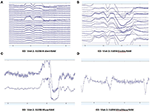
Abbildung 2. Auszüge der EO-Rohdaten von B-Alert (A) und Enobio (B) Muse (C) und MindWave (D) innerhalb desselben Teilnehmers während desselben Besuchs.
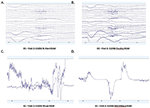
Abbildung 3. Auszüge der EC-Rohdaten von B-Alert (A) und Enobio (B) Muse (C) und MindWave (D) innerhalb desselben Teilnehmers während desselben Besuchs.
Vergleich der spektralen Leistungsdichten (PSDs) des Fp1-Kanals
Die durchschnittlichen PSDs im Fp1-Kanal, die allen vier EEG-Systemen für Besuch 1 und Besuch 2 gemeinsam sind, wurden berechnet und sowohl für die EO- (Abbildungen 4A und B) als auch für die EC-Bedingungen (Abbildungen 4C und D) aufgetragen. Unter der EO-Bedingung waren die Spektren von B-Alert und Enobio ungefähr gleich, während Mindwave leicht erhöht war, aber einer ähnlichen Kurve folgte. Bei den mit dem Muse-System erfassten PSDs wurde ein breitbandiger Anstieg der Leistung beobachtet. In ähnlicher Weise waren in der EC-Bedingung (Abbildungen 4C und D) die PSDs von B-Alert, Enobio und Mindwave ähnlich, jedoch wurde bei den Muse-Spektren eine erhöhte Breitbandleistung beobachtet, die auch eine höhere Variation als bei den anderen Systemen aufzuweisen schien. In den Spektren, die mit den Systemen B-Alert, Enobio und Mindwave bei jedem Besuch erfasst wurden, waren Spitzen bei 8-12 Hz (Alpha-Band) sichtbar. Während es bei den Muse-Leistungsspektren bei Besuch 2 einen deutlichen Alpha-Peak gab, wurde bei den Spektren von Besuch 1 kein Peak beobachtet.
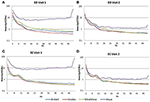
Abbildung 4. Fp1-Leistungsspektraldichten (PSDs) von allen vier EEG-Systemen in der EO-Bedingung bei Besuch 1 (A) und Besuch 2 (B) und der EC-Bedingung bei Besuch 1 (C) und Besuch 2 (D).
Fp1-Kanal Ruhe-EEG Test/Wiederholungs-Vergleich
In der EC-Bedingung lag das Leistungsspektralverhältnis zwischen 0,975 und 1,025 für B-Alert, Enobio und Mindwave (Abbildung 5A). Die PSD-Verhältnisse des Muse-Systems variierten stärker als die der anderen drei Systeme, mit Verhältnissen zwischen 1,125 und 1,225. In der EO-Bedingung schien es eine etwas größere Variation für Enobio bei den langsamen Wellen Delta (1-3 Hz), Theta (3-7 Hz) und langsames Alpha (8-10) und für B-Alert und Mindwave bei den schnelleren Wellen Beta (13-30 Hz) und Gamma (25-40 Hz) zu geben. Die Verhältnisse lagen jedoch immer noch zwischen 0,975 und 1,05. Ähnlich wie bei der EC-Bedingung wies der Test/Retest für Muse eine höhere Variation auf, mit Verhältnissen bis zu 1,2 (Abbildung 5B).
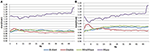
Abbildung 5. Test-Retest-Verhältnisse für EC- (A) und EO-Bedingungen (B).
Diskussion
In dieser Studie wurden die quantitativen EEG-Signale und die Test-Retest-Zuverlässigkeit von medizinischen und Verbraucher-EEG-Systemen verglichen, um ihre mögliche Anwendung in der klinischen Forschung und in klinischen Studien zu bewerten. Die neu eingeführten EEG-Systeme für Endverbraucher wurden aufgrund ihrer geringen Kosten, ihrer guten Zugänglichkeit und ihres Potenzials für Heimstudien in schwierigen Bevölkerungsgruppen bewertet. Zu den beliebten Anwendungen von EEG-Systemen für Endverbraucher gehören Meditations- und Entspannungstraining sowie die Bewältigung von Ängsten und Schmerzen. Jüngste Untersuchungen haben ihren Nutzen über das Spielen hinaus erforscht: NeuroSky hat gezeigt, dass es in der Lage ist, den Beginn des ersten Schlafstadiums zu erkennen (Van Hal et al., 2014), und es besteht auch Interesse daran, das EEG von Verbrauchern in Gehirn-Computer-Schnittstellen zu bewerten (Bialas und Milanowski, 2014; Kim et al., 2015; Taherian et al., 2017). Die Anwendung von einfacheren EEG-Systemen (z. B. mit 6 Kanälen) wird auch für Notfallsituationen erforscht (Jakab et al., 2014). Eine frühere Bewertung, bei der zwar ein komplexeres Headset zum Einsatz kam, zeigte, dass kommerziell erhältliche EEG-Systeme mit mehreren Leitungen, wie die Emotiv EPOC-Kappe mit 16 Elektroden, ebenfalls einen Wert für die Bewertung klinischer Bedingungen haben können (Schiff et al., 2016).
Diese Studie lieferte Beweise dafür, dass EEG-Daten von recht guter Qualität erfolgreich mit Verbraucher-EEGs gesammelt werden können. Allerdings gab es Unterschiede im Leistungsanstieg, im Test-Retest und in der Form des Alpha-Peaks, der bei 8-13 Hz beobachtet wurde. Mindwave zeigte insgesamt ähnliche Fp1-Leistungsspektren wie die medizinischen Systeme mit einem leichten breitbandigen Anstieg gegenüber B-Alert und Enobio. Muse zeigte einen breitbandigen Anstieg der Leistungsspektren, der möglicherweise Artefakte in den Daten widerspiegelt, die mit einer trockenen Elektrode erfasst wurden.
Die EEG-Systeme für den Privatgebrauch zeigten eine deutlich bequemere und schnellere Einrichtung, was für den beabsichtigten Einsatz in Unterhaltungs- und Selbsthilfeanwendungen optimal ist. Die Datenqualität wurde jedoch insgesamt durch die Artefaktanfälligkeit der Trockenelektrode negativ beeinflusst. Wie erwartet, war die Datenqualität besonders während der EO beeinträchtigt. Die fehlende Möglichkeit zur Impedanzprüfung und die Anwendung im Frontalbereich, der besonders anfällig für Augenblinzeln und Muskelbewegungen beim Öffnen der Augen ist, trugen wahrscheinlich ebenfalls zu diesen relativen Artefakten bei. Darüber hinaus ist die von EEG-Systemen für Endverbraucher durchgeführte Bewertung naturgemäß begrenzt und auf die einzige anatomische Hirnregion beschränkt, die von den wenigen Kanälen abgedeckt wird, was eine Bewertung mehrerer Netze ausschließt.
Trockene Elektroden können im Laufe der Zeit auch zu Unbehagen führen und bergen ein höheres Risiko für eine falsche Platzierung auf der Stirn, was zu einer ungenauen Signalerfassung und Prüfung/Retest führt. Im Vergleich zu medizinischen Geräten war die Test-/Retest-Zuverlässigkeit bei EEG-Systemen für Verbraucher geringer. Die Zuverlässigkeit wurde mit einer Test-/Retest-Erfassung für alle Systeme gemessen (Abbildung 5). Während B-Alert, Enobio und Mindwave recht gut abschnitten, war die Zuverlässigkeit bei Muse relativ gering. Während für Muse bei Besuch 2 ein deutlicher Alpha-Peak nachgewiesen wurde (Abbildung 4), deutet das Fehlen eines Alpha-Peaks bei Besuch 1 auf einen Mangel an Konsistenz hin, der möglicherweise auf Artefakte zurückzuführen ist. Konsistente und zuverlässige Messungen der Hirnaktivität sind in klinischen Studien von entscheidender Bedeutung, wenn es um die Überwachung des Krankheitsverlaufs und die Bewertung der Wirksamkeit einer experimentellen Therapie geht. Während die Verbrauchersysteme für eine schnelle Bewertung bei begrenzter Zeit nützlich sein können, könnten diese Einschränkungen des Verbraucher-EEG ihre Anwendung in der Forschung und in klinischen Studien behindern, und ein medizinisches System mit hoher Test-Retest-Zuverlässigkeit wird für die Verwendung als pharmakodynamischer Endpunkt in klinischen Bewertungen empfohlen.
Schließlich hat der Vergleich von medizinischen und Verbraucher-EEG-Systemen unter experimentellen Bedingungen Unterschiede in der Leistung und insbesondere spezifische Anwendungseinschränkungen aufgezeigt, die die Anwendung von Verbrauchersystemen in der Forschung und in klinischen Studien behindern könnten. Andererseits sind die medizinischen Multi-Lead-Systeme für Unterhaltungszwecke, die eine schnelle Einrichtung und Datenverarbeitung mit einer minimalen Anzahl von Elektroden erfordern, weniger ideal. Die wichtigste Einschränkung dieser Studie liegt in der geringen Größe der Studienpopulation und der fehlenden Randomisierung der Reihenfolge der für die Erfassung verwendeten Systeme. Die Daten wurden in der gleichen Reihenfolge der Systeme erfasst, um Auswirkungen der Erfassungszeit zu vermeiden, die das EEG aufgrund von zirkadianen Rhythmen beeinflussen können. Die EEG-Leistungsmessung hat sich jedoch als sehr zuverlässig und wiederholbar für Einzelpersonen erwiesen, wenn Standard-EEG-Systeme verwendet werden. Aus diesem Grund wurde die gewählte Stichprobengröße als aussagekräftig erachtet.
Zusammenfassend lässt sich sagen, dass EEG-Daten mit allen vier getesteten Systemen, einschließlich EEG-Systemen für Endverbraucher, erfolgreich erfasst werden können, allerdings mit unterschiedlichen Einschränkungen in Bezug auf Benutzerfreundlichkeit, Datenqualität und Zuverlässigkeit, die ihre optimale Anwendung, auch in klinischen Studien, bestimmen. Die Anfälligkeit für Artefakte und die Variabilität in der Test-/Retest-Zuverlässigkeit, die mit den aktuellen Verbraucher-EEG-Systemen verbunden sind, legen die Verwendung von EEG-Systemen medizinischer Qualität für robuste klinische Querschnitts- und Längsschnitt-EEG-Datensammlungen nahe.
Beiträge der Autoren
ER und AV: waren an der Konzeption und dem Design des Projekts, der Analyse und Interpretation der Daten und der Erstellung des Manuskripts beteiligt. SW, CB und GR: beteiligten sich an der Konzeption und dem Design des Projekts, seiner Durchführung, der Analyse und Interpretation der Daten und der Erstellung des Manuskripts. Alle Autoren waren an der Ausarbeitung, dem Schreiben und der Überarbeitung des Manuskripts beteiligt und haben die endgültige Version des Manuskripts gelesen und genehmigt.
Finanzierung
Diese Studie wurde von Biogen unterstützt.
Erklärung zu Interessenkonflikten
ER und AV: Mitarbeiter von Biogen. SW und CB: Mitarbeiter von Advanced Brain Monitoring, Inc. GR: Mitarbeiter von Neuroelectrics.
Dankesworte
Wir möchten den Studienteilnehmern für ihre Zeit und ihre Beiträge zu dieser Studie danken. Das Biogen-Team war am Studiendesign, an der Analyse und Interpretation der Daten, an der Abfassung des Berichts und an der Entscheidung, den Artikel zur Veröffentlichung einzureichen, beteiligt.
Babiloni, C., De Pandis, M. F., Vecchio, F., Buffo, P., Sorpresi, F., Frisoni, G. B., et al. (2011). Kortikale Quellen von elektroenzephalographischen Rhythmen im Ruhezustand bei Demenz im Zusammenhang mit der Parkinson-Krankheit und der Alzheimer-Krankheit. Clin. Neurophysiol. 122, 2355-2364. doi: 10.1016/j.clinph.2011.03.029
PubMed Abstract | CrossRef Full Text | Google Scholar
Berka, C., Verma, A., Korszen, S., and Johnson, R. (2014). „Development of EEG biomarkers for Alzheimer’s disease“, in GTC Biomarkers Summit (San Diego, CA).
Bialas, P., and Milanowski, P. (2014). A high frequency steady-state visually evoked potential based brain computer interface using consumer-grade EEG headset. Conf. Proc. IEEE Eng. Med. Biol. Soc. 2014, 5442-5445. doi: 10.1109/EMBC.2014.6944857
PubMed Abstract | CrossRef Full Text | Google Scholar
Caso, F., Cursi, M., Magnani, G., Fanelli, G., Falautano, M., Comi, G., et al. (2012). Quantitatives EEG und LORETA: wertvolle Werkzeuge zur Unterscheidung von FTD und AD? Neurobiol. Aging 33, 2343-2356. doi: 10.1016/j.neurobiolaging.2011.12.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Chen, C. C., Hsu, C. Y., Chiu, H. W., Hu, C. J., and ChiehLee, T. (2015). Frequenzleistung und Kohärenz der Elektroenzephalographie sind mit dem Schweregrad der Alzheimer-Krankheit korreliert: eine multizentrische Analyse in Taiwan. J. Formos Med. Assoc. 114, 729-735. doi: 10.1016/j.jfma.2013.07.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Garn, H., Waser, M., Deistler, M., Benke, T., Dal-Bianco, P., Ransmayr, G., et al. (2015). Quantitative EEG-Marker im Zusammenhang mit dem Schweregrad der Alzheimer-Krankheit im prospektiven Demenz-Register Österreich (PRODEM). Clin. Neurophysiol. 126, 505-513. doi: 10.1016/j.clinph.2014.07.005
PubMed Abstract | CrossRef Full Text | Google Scholar
Goossens, J., Laton, J., Van Schependom, J., Gielen, J., Struyfs, H., Van Mossevelde, S., et al. (2016). EEG dominante Frequenzspitze unterscheidet zwischen Alzheimer-Krankheit und frontotemporaler lobärer Degeneration. J. Alzheimers Dis. 55, 53-58. doi: 10.3233/JAD-160188
PubMed Abstract | CrossRef Full Text | Google Scholar
Jakab, A., Kulkas, A., Salpavaara, T., Kauppinen, P., Verho, J., Heikkilä, H., et al. (2014). Neuartiges drahtloses Elektroenzephalographie-System mit minimaler Vorbereitungszeit für den Einsatz in Notfällen und in der prähospitalen Versorgung. Biomed. Eng. Online 13:60. doi: 10.1186/1475-925X-13-60
CrossRef Full Text | Google Scholar
Kim, M., Kim, B. H., and Jo, S. (2015). Quantitative Bewertung einer kostengünstigen nicht-invasiven hybriden Schnittstelle auf der Grundlage von EEG und Augenbewegungen. IEEE Trans. Neural. Syst. Rehabil. Eng. 23, 159-168. doi: 10.1109/TNSRE.2014.2365834
PubMed Abstract | CrossRef Full Text | Google Scholar
Kroupi, E., Castellano, M., Ibanez, D., Montplaisir, J., Gagnon, J. F., Postuma, R., et al. (2017). „Deep networks using auto-encoders for PD prodromal analysis,“ in Proceedings of 1st HBP Student Conference (Vienna).
Lenartowicz, A., and Loo, S. K. (2014). Verwendung von EEG zur Diagnose von ADHS. Curr. Psychiatry Rep. 16:498. doi: 10.1007/s11920-014-0498-0
CrossRef Full Text | Google Scholar
Moretti, D. V., Frisoni, G. B., Binetti, G., and Zanetti, O. (2011). Anatomisches Substrat und Kopfhaut-EEG-Marker sind bei Personen mit kognitiver Beeinträchtigung und Alzheimer-Krankheit korreliert. Front Psychiatry 1:152. doi: 10.3389/fpsyt.2010.00152
PubMed Abstract | CrossRef Full Text | Google Scholar
Nishida, K., Yoshimura, M., Isotani, T., Yoshida, T., Kitaura, Y., Saito, A., et al. (2011). Unterschiede im quantitativen EEG zwischen frontotemporaler Demenz und Alzheimer-Krankheit, dargestellt durch LORET. Clin. Neurophysiol. A 122, 1718-1725. doi: 10.1016/j.clinph.2011.02.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Pijnenburg, Y. A., Strijers, R. L., Made, Y. V., van der Flier, W. M., Scheltens, P., and Stam, C. J. (2008). Untersuchung der funktionellen Konnektivität des EEG im Ruhezustand bei frontotemporaler lobärer Degeneration. Clin. Neurophysiol. 119, 1732-1738. doi: 10.1016/j.clinph.2008.02.024
PubMed Abstract | CrossRef Full Text | Google Scholar
Ruffini, G., David, I.-S., Castellano, M., and Soria-Frisch, A. (2016). „EEG-driven RNN classification for prognosis of neurodegeneration in at-risk patients,“ in Internet Corporation for Assigned Names and Numbers (ICANN) (Copenhargen).
Google Scholar
Sarnthein, J., and Jeanmonod, D. (2007). Hohe thalamokortikale Theta-Kohärenz bei Patienten mit Morbus Parkinson. J. Neurosci. 27, 124-131. doi: 10.1523/JNEUROSCI.2411-06.2007
PubMed Abstract | CrossRef Full Text | Google Scholar
Schiff, S., Casa, M., Di Caro, V., Aprile, D., Spinelli, G., De Rui, M., et al. (2016). Ein kostengünstiges, benutzerfreundliches elektroenzephalographisches Aufzeichnungssystem für die Beurteilung der hepatischen Enzephalopathie. Hepatology 63, 1651-1659. doi: 10.1002/hep.28477
PubMed Abstract | CrossRef Full Text | Google Scholar
Shani Waninger, S. K., Berka, C., Tan, V., and Johnson, R. (2015). „A novel portable neurocognitive biomarker assessment for Parkinson’s Disease“, in GTC Biomarkers Summit (San Diego, CA).
Snyder, S. M., Rugino, T. A., Hornig, M., and Stein, M. A. (2015). Integration eines EEG-Biomarkers in die ADHS-Bewertung durch einen Kliniker. Brain Behav. 5:e00330. doi: 10.1002/brb3.330
PubMed Abstract | CrossRef Full Text | Google Scholar
Soria-Frisch, J. M., Ibanez, D., Dunne, S., Grau, C., Ruffini, G., Rodrigues-Brazete, J., et al. (2014). „Machine Learning for a Parkinsons prognosis and diagnosis system based on EEG“, in Proceedings International Pharmaco-EEG Society Meeting IPEG (Leipzig).
Taherian, S., Selitskiy, D., Pau, J., and Claire Davies, T. (2017). Are we there yet? Evaluierung kommerzieller Gehirn-Computer-Schnittstellen für die Steuerung von Computeranwendungen durch Menschen mit Zerebralparese. Disabil. Rehabil. Assist. Technol. 12, 165-174. doi: 10.3109/17483107.2015.1111943
PubMed Abstract | CrossRef Full Text | Google Scholar
Van Hal, B., Rhodes, S., Dunne, B., and Bossemeyer, R. (2014). Low-cost EEG-based sleep detection. Conf. Proc. IEEE Eng. Med. Biol. Soc. 2014, 4571-4574. doi: 10.1109/EMBC.2014.6944641
PubMed Abstract | CrossRef Full Text | Google Scholar
Waninger, S., Stikic, M., Tatinada, R., and Verma, A. (2016). „Identification of neurophysiological biomarkers of MCI using resting state, EEG,“ in Alzheimer’s Association International Conference (Toronto, ON).
Google Scholar