- Hintergrund und Einleitung
- Falldarstellung
- Diskussion
- Pathophysiologie der ADI
- Literatursuche
- Ursachen von ADI
- Klinische Präsentation von ADI
- Begleitende Komplikationen der ADI
- Managementansätze bei ADI
- Schlussfolgerung
- Datenverfügbarkeit
- Ethische Erklärung
- Einwilligung zur Teilnahme
- Beiträge der Autoren
- Finanzierung
- Conflict of Interest Statement
- Acknowledgments
Hintergrund und Einleitung
Der hypothalamische adipöse Diabetes insipidus (ADI), ein seltenes Syndrom mit heterogenem klinischem Bild, ist durch eine Reihe von Defekten in den homöostatischen Mechanismen des Wasserhaushalts gekennzeichnet. Dazu gehören die Osmoregulation des Durstmechanismus, die Arginin-Vasopressin-Sekretion und die Fähigkeit der Nieren, den Urin zu konzentrieren. In den letzten vier Jahrzehnten wurden weltweit weniger als einhundert schwere Fälle gemeldet (1).
Die Behandlung solcher Patienten ist äußerst schwierig, da diese Patienten zu starken Schwankungen des Plasmanatriums neigen, selbst wenn die DI gut kontrolliert wird (2).
Wir berichten über einen Fall von schwerer ADI, der postoperativ nach einer Operation einer zerebralen arteriovenösen Malformation (AVM) auftrat. Wir beschreiben die mögliche Pathogenese in diesem Fall und überprüfen die Literatur für alle ähnlich berichteten Fälle und beschreiben die möglichen beteiligten Mechanismen, die klinische Präsentation, das akute und chronische Management und die Prognose.
Falldarstellung
Eine 27-jährige Frau stellte sich mit einer linken frontalen intrazerebralen Blutung mit intraventrikulärer Ausdehnung als Folge eines großen Basalganglienkomplexes (AVM) mit komplexen arteriellen Zuführungen aus den linken mittleren Hirnarterien (MCA) und den vorderen Hirnarterien (ACA) mit einer Spetzler-Martin-Bewertungsskala von 3 (3) vor.
Nach der anfänglichen Erholung von der dekompressiven Kraniotomie und der Gerinnselentfernung unterzog sie sich ~2 Wochen später einer elektiven AVM-Exzisionsoperation. Während der AVM-Operation berichteten die Chirurgen über starke Blutungen aus den Zubringergefäßen (MCA, ACA und Adergefäße) mit schweren intrazerebralen Blutungen und intraventrikulären Blutungen, die eine massive Bluttransfusion von bis zu 32 Einheiten intraoperativ erforderten. Sie wurde in ein Barbiturat-induziertes Koma und eine induzierte Hypotonie versetzt, um das Hirnödem zu minimieren (4).
Bald nach dem Auftreten der starken intraoperativen Blutung begann sie eine Polyurie mit großen Urinmengen zu haben. Obwohl ihre Natriumkonzentration präoperativ normal war, war die Natriumkonzentration unmittelbar (innerhalb der ersten Stunde) postoperativ in einem Bereich von 151-160 mmol/L erhöht, verbunden mit einer niedrigen Osmolalität des Urins <130 mosm/L. Es wurde eine vorübergehende DI in Betracht gezogen, und es wurde mit intravenösem Desmopressin (IV-Desmopressin) 1 mcg begonnen, das täglich zusammen mit einer 3,5-4 l halbstarken Kochsalzinfusion an drei aufeinanderfolgenden Tagen gegeben wurde.
Am vierten postoperativen Tag entwickelte sie jedoch ein Lungenödem (wahrscheinlich eine Folge der massiven Bluttransfusion während des Eingriffs, der intravenösen hypotonen Flüssigkeiten und des gleichzeitigen intravenösen Desmopressins), woraufhin das intravenöse Desmopressin abgesetzt und frisches gefrorenes Plasma und Diuretika (intravenöses Furosemid 40 mg) verabreicht wurden, um das extravaskuläre Ödem zu reduzieren. In der darauffolgenden Stunde entwickelte sie erneut eine Polyurie mit einer Urinausscheidung von 800 ml in einer einzigen Stunde, und ihre Natriumkonzentration stieg tendenziell auf 172 mmol/L. Angesichts des begleitenden postoperativen Hirnödems wurde beschlossen, die Natriumkonzentration gezielt zu senken, so dass die Natriumabnahme innerhalb von 5-10 mmol/L/Tag blieb, wobei ein Zielwert von 155 mmol/L angestrebt wurde. Es wurde eine niedrige Dosis von 0,25 mcg Desmopressin i.v. verabreicht und ein Titrationsschema vorgeschlagen, um eine stündliche Urinausscheidung von weniger als 100 ml/h zu erreichen. Am 5. postoperativen Tag benötigte sie 0,75 mcg Desmopressin i.v. und am 6. Tag zweimal täglich 0,25 mcg i.v., als sie einen Zielwert von 155 mmol/L erreichte. Diese Natriumkonzentration konnte mit der Desmopressin-Dosierung für weitere 2 Tage aufrechterhalten werden.
Am 9. postoperativen Tag wurde Desmopressin abgesetzt, da die Patientin in der Lage war, eine niedrige Urinausscheidung ohne Desmopressin aufrechtzuerhalten, und die Natriumkonzentration stabil war. Zu diesem Zeitpunkt wurde angenommen, dass sie ein Syndrom der unangemessenen antidiuretischen Hormonausschüttung (SIADH) entwickelt hatte, und die Flüssigkeitszufuhr wurde auf 1 l/Tag beschränkt. Ihre Natriumkonzentration blieb in dieser Woche stabil bei 134-138 mmol/L.
Am 14. postoperativen Tag entwickelte sie erneut eine Polyurie mit steigender Natriumkonzentration und Serumosmolalität. Zu diesem Zeitpunkt wurde die Desmopressin-Infusion mit 0,25 mcg zweimal täglich wieder aufgenommen. Die Natriumkonzentration konnte mit IV-Desmopressin (0,25 mcg zweimal täglich) und Flüssigkeit bei 138-150 mmol/L gehalten werden. Sie hatte eine dreiphasige Phase mit einer vorübergehenden DI, gefolgt von SIADH und einer anschließenden permanenten DI durchlaufen (siehe Abbildung 1). Die Serumwerte von Cortisol, Wachstumshormon, Insulin-ähnlichem Wachstumsfaktor-1, Schilddrüsenfunktion und Prolaktin lagen alle im normalen Bereich.

Abbildung 1. Diagramm mit allen seriellen Messungen bei unserer Patientin während des gesamten Krankenhausaufenthalts.
Nach einer ventrikuloperitonealen Shunt-Insertion (zur Aufrechterhaltung des intrakraniellen Drucks) 6 Wochen nach der AVM-Entfernung wurde sie auf die Rehabilitationsstation verlegt und das intravenöse Desmopressin-Regime auf ein subkutanes (SC) Regime umgestellt (siehe Abbildung 1). Als die nasogastrische Sondenernährung eingestellt wurde, versuchten wir, die Flüssigkeitszufuhr über den Durst zu regulieren. Die Blutuntersuchungen zeigten einen Anstieg des Natriumspiegels auf bis zu 165 mmol/L, und sie verspürte während dieser Zeit der Hypernatriämie trotz einer Serumosmolalität von 350 mosm/kg keinen Durst. Trotz Erholung der Aphasie blieb sie adipsisch. Eine Durstskala wurde nicht verwendet, da sie auf Befragen äußerte, dass sie überhaupt keinen Durst verspürte, und eine Durstskala nicht angewendet werden konnte. Daher musste die Flüssigkeitszufuhr reguliert werden, um das Natriumgleichgewicht aufrechtzuerhalten. Ihre Urinausscheidung war konstant und ihr Natriumhaushalt gut reguliert durch die Verabreichung von 0,5 mcg Desmopressin am Morgen und 0,375 mcg in der Nacht bei einer regulierten Flüssigkeitszufuhr von 1,5-2 l pro Tag. Sie wies keine Anzeichen von Störungen der Thermoregulation auf. Eine Kranioplastik aus Polyetheretherketon (PEEK) wurde ~4 Monate nach der Erstoperation durchgeführt.
Nach 5 Monaten intensiver multidisziplinärer Rehabilitation hatte sie immer noch eine nicht funktionsfähige dominante rechte Hand und erhebliche kognitive Restdefizite, und eine sichere Dosierung und Selbstverabreichung von subkutanem Desmopressin war langfristig nicht möglich.
Ein Versuch mit nasalem Desmopressin und oralem Desmopressin zeigte eine signifikant variable Absorption, die zu größeren Schwankungen der Natriumkonzentrationen führte. Daraufhin entschieden wir uns für das sublinguale Desmopressin, das als Desmopressin Melt erhältlich ist. Nach mehreren Versuchen mit verschiedenen Dosierungsschemata konnten wir die Urinausscheidung mit Desmopressin Melt oral lyophilizate 120 mcg (2 Tabletten) am Morgen und 60 mcg (1 Tablette) am Abend auf etwa 2 l/Tag einstellen. Bei dieser Dosis trat jedoch zu bestimmten Tageszeiten eine Hyponatriämie auf. Wir führten eine weitere Dosistitration durch, indem wir die Desmopressin-Tabletten mit einer Pinzette/Zange aus der Blisterpackung nahmen und sie mit Hilfe eines Tablettenschneiders in exakte Viertelstücke (je 15 mcg) zerschnitten. Mit einem Regime von 90 mcg (1,5 Tabletten) am Morgen und 75 mcg (1,25 Tabletten) am Abend konnten wir ähnliche Ergebnisse erzielen wie mit dem subkutanen Regime. Mit diesem Regime und einer geregelten Flüssigkeitszufuhr von 2 Litern pro Tag konnte ihre Natriumkonzentration ohne größere Schwankungen oder kognitive Symptome im Bereich von 135-150 mmol/L gehalten werden. Diese Dosierung ermöglichte ihr auch eine erhöhte Aktivität am Tag zur Rehabilitation, und sie konnte gut schlafen, ohne durch Polyurie in der Nacht gestört zu werden.
Siehe Abbildung 1 für die seriellen Natriummessungen bei dieser Patientin während des gesamten Krankenhausaufenthalts mit den oben beschriebenen Ereignissen.
In Anbetracht der klinischen Geschichte und der Tatsache, dass ihre Hypophyse und ihr Hypothalamus größtenteils intakt sind, ist es unwahrscheinlich, dass sie signifikante Defekte in der Baroregulation hatte.
Diskussion
Pathophysiologie der ADI
Unter physiologischen Bedingungen werden Plasmanatrium, Osmolalität und Wasserhaushalt durch ein sorgfältiges Zusammenspiel zwischen Durst und Wasseraufnahme, neurohypophysärer Vasopressin-Sekretion und der Antidiurese an den distalen Nierensammelröhrchen innerhalb enger Grenzen gehalten.
Periphere Signale (oropharyngeale, Darm-Osmosensoren, Blutosmolalität) kodieren in Echtzeit Informationen über den aktuellen Hydratationszustand, die zentral integriert werden (5). Ein Zustand der Dehydratation führt zu stimulierenden Signalen an das subfornische Organ (SFO), das hierarchisch Signale an das Organum vasculosum der Lamina terminalis (OVLT) und den medianen präoptischen Nukleus (MnPO) sendet (6). Der MnPO, der möglicherweise als „zentraler Detektor“ dient, sendet stimulierende Signale an die Hypothalamuskerne, um die Freisetzung von Vasopressin zu erhöhen, und sendet auch ein verstärktes Durstsignal über den SFO und OVLT (7, 8). Die mit dem Durst verbundenen Nervenbahnen, die den SFO und den OVLT mit dem cingulären und insulären Kortex verbinden, führen zu einer bewussten Wahrnehmung des Durstes (7, 8). Im Gegensatz dazu führen die Signale der peripheren Sensoren bei ausreichender Flüssigkeitszufuhr zu einer Hemmung dieser Bereiche und zu einer negativen Rückkopplung mit dem MnPO, was zu einer Unterdrückung des Durstgefühls und einer geringeren Vasopressinsekretion und -freisetzung führt (roter Schaltkreis). Tatsächlich sind die Neuronen im MnPO, OVLT und SFO umfassend und wechselseitig miteinander verbunden, da die optogenetische und chemogenetische Aktivierung von Neuronen in jedem dieser Bereiche den Durst stimulieren kann (9). Eine Unterbrechung der Blutzufuhr, die zu einer Schädigung der Zellen führt, hat daher Adipositas zur Folge. Es wurden auch Fälle von ADI aufgrund von Autoimmunität gegen neuronale Zellen aus dem SFO und OVLT veröffentlicht, was auf die funktionelle Bedeutung dieser neuronalen Sensoren bei der Durstkontrolle hinweist (10).
Die AVP-Neuronen zeigen eine „phasische“ Aktivität von Aktionspotentialen mit Intervallen, in denen AVP an den Axonendigungen freigesetzt wird. Die Freisetzung von Vasopressin wird durch die osmosensorischen Eingänge aus dem MnPO über Barorezeptoren reguliert, und es gibt auch eine antizipatorische Regulierung, bei der die Vasopressinfreisetzung vor den Mahlzeiten (prandial), bei Hyperthermie und nach einem zirkadianen Muster stimuliert wird (11). Es gibt ein zirkadianes Tagesmuster der Sekretion von Vasopressin in den Blutkreislauf mit einem Anstieg der Werte zwischen 24:00 und 02:00 Uhr und einem progressiven Absinken der Werte im Laufe des Tages mit einem Tiefpunkt zwischen 16:00 und 20:00 Uhr (12). Dieser zirkadiane Anstieg um Mitternacht, der durch eine erhöhte Vasopressinausschüttung verursacht wird, ist zum Teil auf eine verstärkte synaptische Erregung von magnozellulären neurosekretorischen Neuronen durch den suprachiasmatischen Kern zurückzuführen, von dem bekannt ist, dass er den zirkadianen Rhythmus reguliert (11). Bei ADI ist die osmosensorische Regulierung der Vasopressin-Sekretion am stärksten betroffen, und andere Auswirkungen können je nach Ort und Ausmaß der Verletzung variieren, während die Barorezeptor-Reaktion bei vielen Patienten mit begrenzter Verletzung erhalten bleibt, wie in einer Studie gezeigt wurde (13).
AVP wirkt über Vasopressin-2 (V2)-Rezeptoren auf die Nierensammelkanäle, um die Wasserdurchlässigkeit zu erhöhen, was zu einer verminderten Urinbildung führt. Die Rückresorption von Wasser wird durch die Regulierung des Wasserkanals Aquaporin-2 (AQP2) gesteuert. Kurzfristig induziert AVP die intrazelluläre Verlagerung von AQP2-haltigen Vesikeln zur apikalen Plasmamembran und reguliert so den AQP2-Transport. Bei ausreichender AVP-Konzentration reguliert es langfristig die Transkription des AQP2-Gens und erhöht so die AQP2-Proteinmenge im Sammelkanal (14). Bei ADI ist es wahrscheinlich, dass die akute osmosensorische Reaktion stärker beeinträchtigt wird als die chronische Reaktion. Daher wird es eine relative Häufigkeit von Aquaporin geben, aber der akute Transport zur apikalen Membran wird beeinträchtigt sein.
Siehe Abbildung 2 für eine detaillierte Darstellung der Mechanismen.
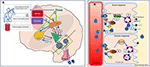
Abbildung 2. Schematische Darstellung der Regulation des Flüssigkeitshaushalts beim Menschen. (A) Die Steuerung und Regulierung der Vasopressinsekretion im Gehirn. (A) Periphere Signale (oropharyngeale, Darm-Osmosensoren, Blut-Osmolalität) kodieren Informationen über den aktuellen Hydratationszustand in Echtzeit (1) und werden zentral integriert (2). Ein Zustand der Dehydratation führt zu stimulierenden Signalen an den SFO, der hierarchisch Signale an den OVLT und den MnPO sendet (3). Das MnPO, das als „zentraler Detektor“ dienen kann, sendet stimulierende Signale an die Hypothalamuskerne, um die Freisetzung von Vasopressin zu erhöhen (4), und sendet auch ein verstärktes Durstsignal über den SFO und den OVLT (5, blauer Kreislauf im Diagramm). Im Gegensatz dazu kommt es bei ausreichender Flüssigkeitszufuhr zu einer Hemmung dieser Bereiche und zu einer negativen Rückkopplung vom MnPO, was zu einer Unterdrückung des Durstgefühls und einer geringeren Vasopressinsekretion und -freisetzung führt (roter Schaltkreis 6). Die mit dem Durst verbundenen neuronalen Bahnen, die den SFO und den OVLT mit dem cingulären und insulären Kortex verbinden, führen zur bewussten Wahrnehmung von Durst (7). Bei adipöser DI sind in Abwesenheit von osmosensorischen Reizen die damit verbundenen neuronalen Schaltkreise aufgrund von Zellschäden, stimulierender Freisetzung oder Hemmung von Vasopressin und die bewusste Wahrnehmung von Durst gestört. (B) Der Wirkungsmechanismus von Vasopressin auf die Nierensammeltubuli. (B) Vasopressin im Blutkreislauf bindet an den Vasopressin-Rezeptor 2 auf der luminalen Oberfläche der Hauptzellen des distalen Sammeltubulus in den Nieren (1). In der akuten Phase bildet es über die Synthese von cAMP aus ATP durch AC (Adenylatzyklase) die Proteinkinase A (2), die die Translokation von Aquaporin aus dem Speicherbläschen zur apikalen Membran und zur Luminaloberfläche des Blutes stimuliert (3). Dies führt dazu, dass Wasser in die Zelle transportiert (4) und anschließend in den Blutkreislauf aufgenommen wird (5). In der chronischen Phase sind über die cAMP-vermittelte Transkriptionskontrolle des Aquaporin-Gens (6) erhöhte Spiegel des Aquaporin-Wasserkanals in den Hauptzellen zu finden (7). Bei adipöser DI ist die akute Reaktion wahrscheinlich stärker betroffen als die chronische Reaktion, da die osmosensorisch bedingte Vasopressin-Sekretion beeinträchtigt ist.
Literatursuche
Wir führten eine systematische Literatursuche durch, einschließlich Pubmed, Scopus und Embase, um Fälle zu finden, die als Fallbericht oder Fallserie von ADI aus den Jahren 1980 bis 2018 berichtet wurden. Wir verwendeten den Suchbegriff: Adipsia, Adipsic disorder und Adipsic DI und wir beschränkten die Suche auf die englische Sprache und auf Menschen. Wir haben auch alle anderen Referenzen durchsucht, die wir beim Lesen der einzelnen Fallberichte/Fallserien gefunden haben. Wir fanden 25 Referenzen (10, 13, 15-39) mit insgesamt 45 in der Literatur berichteten Fällen. Wir haben alle Fallberichte in Tabelle 1 zusammengefasst.
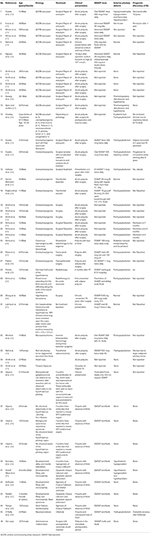
Table 1. Demografie, Ätiologie, klinische Präsentation, Behandlung und Prognose von Patienten mit adipösem Diabetes insipidus, über die in der Literatur berichtet wurde.
Ursachen von ADI
Vierzig Prozent (17/46) der in der Literatur beschriebenen Fälle von ADI traten als Folge der Ruptur eines Aneurysmas der vorderen Kommunikationsarterie (ACOM) und des postoperativen Clippings mit einem frontalen Kraniektomiezugang auf. In einem Fall wurde die doppelte Pathologie eines Kraniopharyngioms und eines ACOM-Aneurysmas beschrieben (15). Die arterielle Versorgung des OVLT wurde aus vier Quellen beschrieben (40): (1) eine obere mediane Quelle, die von der vorderen Kommunikationsarterie abzweigt, (2) und (3) zwei seitliche Quellen, die von Arterien stammen, die von jeder vorderen Hirnarterie unterhalb der vorderen Kommunikationsarterie abzweigen, und (4) eine untere mediane Quelle, die unterhalb des Chiasma opticum aufsteigt. Charakteristischerweise liegen die Kapillaren, die dieses Organ auskleiden, außerhalb der Blut-Hirn-Schranke, so dass eine Änderung der Osmolalität von diesen Organen leicht wahrgenommen werden kann (41). Es ist anzumerken, dass Verbesserungen in der chirurgischen Technik und die Verwendung von Coiling anstelle von Clipping diese Komplikationen verringern können. Bei Patienten in gutem klinischen Zustand mit rupturierten Aneurysmen des vorderen Kreislaufs, die für das Coiling geeignet sind, zeigen Daten aus einer Metaanalyse, dass das Coiling mit einem besseren Ergebnis verbunden ist (42). Im Vergleich zum Clipping, bei dem beide Enden des Aneurysmas abgeschnitten werden und die Blutversorgung des Hypothalamus unterbrochen wird, können durch das Einsetzen einer Spirale in das Aneurysma die Zuführungen zum Hypothalamus in den meisten Fällen erhalten werden.
Die zweite Ursache für ADI wurde als supraselläres Kraniopharyngiom beschrieben (17/46). In diesen Fällen wird häufig eine transfrontale Exzision durchgeführt, und in einigen Fällen wurde eine Erholung nach der Operation beschrieben. Ein Fall von kavernösem Hämangiom mit ähnlicher Manifestation nach einer Blutungsepisode wurde ebenfalls beschrieben (26).
Hypothalamische Tumoren einschließlich Hamartom, Zirbeldrüsentumor und Keimzelltumor können mit ADI auftreten (26, 29, 30). Es wurde über einen Fall von hepatozellulärem Karzinom mit Metastasen im Hypothalamus und daraus resultierender ADI berichtet (31).
Interessanterweise sind nur zwei Fälle von Hypophysentumoren mit ADI beschrieben worden (18, 32). In beiden Fällen handelte es sich um einen aggressiven Tumor mit mehrfacher transfrontaler Resektion und intrakranieller Blutung während des Eingriffs. Jeweils ein Fall wurde auch im Zusammenhang mit einem Schädel-Hirn-Trauma und einer Toluol-Exposition beschrieben (13).
Vier Fälle wurden beschrieben, bei denen eine plötzliche akute Polyurie und Hypernatriämie auftrat. Diese Patienten wiesen keine strukturellen Anomalien im Hypothalamus auf und detaillierte Untersuchungen ergaben Hinweise auf Antikörper gegen die OVLT-Organe. In diesen Fällen wurde eine zugrundeliegende Autoimmunpathologie vermutet (10, 33).
Kongenitale oder frühkindliche Fälle bei Patienten mit Entwicklungsstörungen des Corpus callosum wurden ebenfalls mit Manifestation von ADI beschrieben (34-38). Ein Fall von Neurosarkoidose, die den Hypophysenvorder- und -hinterlappen sowie den Hypothalamus stark befallen hat, wurde ebenfalls mit ADI beschrieben (39).
Klinische Präsentation von ADI
Die klinische Präsentation in den meisten der beschriebenen Fälle ist Polyurie in der ersten Woche nach dem chirurgischen Clipping einer AVM oder nach einer Kraniotomie. Die biochemische Präsentation ist eine Hypernatriämie mit erhöhter Serumosmolalität in Gegenwart von unangemessen verdünntem Urin in großen Mengen. Wird das Durstgefühl mit Hilfe einer Durstskala gemessen, geben diese ADI-Patienten trotz der Hypernatriämie einen geringen oder minimalen Durst an. Interessanterweise reagieren diese Patienten normal auf Hypotonie und ihr Barorezeptor-Mechanismus ist intakt (13).
Unser Patient durchlief eine dreiphasige Phase mit anfänglicher DI, gefolgt von SIADH und dann permanenter DI. Dieses als triphasische Reaktion beschriebene Muster wurde nach Hypophysen- und Kraniopharyngiom-Operationen beschrieben. Die Pathophysiologie der dreiphasigen Reaktion scheint durch eine frühe hypothalamische Dysfunktion (gekennzeichnet durch Polyurie und Hypernatriämie), die anschließende Freisetzung von vorgebildetem Vasopressin aus den Speicherbläschen im Hypophysenhinterlappen (unabhängig von einem Stimulus) (gekennzeichnet durch SIADH) und schließlich die Entleerung der Vasopressinspeicher (permanente DI) erklärt zu werden (43). Bei unserer Patientin ist es wahrscheinlich, dass in der dritten Phase die mangelnde Reaktion auf die Osmolalität bei der Freisetzung von Vasopressin demaskiert wird, nachdem SIADH verschwunden ist, und nicht eine absolute Erschöpfung von Vasopressin.
Begleitende Komplikationen der ADI
In wenigen Fallberichten wurden Störungen der Thermoregulation beschrieben. Panhypopituitarismus wurde nur bei Kraniopharyngiomen und Hypophysentumoren berichtet und lag bei unserem Patienten nicht vor.
Obwohl nicht durchgängig berichtet, gehören zu den anderen wichtigen Komplikationen der Hypernatriämie tiefe Venenthrombosen; daher kann niedermolekulares Heparin während akuter Krankheit und Immobilisierung angezeigt sein (18).
Auch über hypothalamische Adipositas und Schlafapnoe wurde häufig berichtet (18). In einer Fallserie (13), in der die AVP-Reaktion auf Hypotonie untersucht wurde, wurde festgestellt, dass die Patienten mit Kraniopharyngiomen auch einen Verlust der baro-regulierten AVP-Reaktion aufwiesen. Diese Patienten wiesen Anzeichen von Panhypopituitarismus auf, was darauf hindeutet, dass die Operation ihrer Tumore eine weitreichendere Schädigung der Hypophyse hinterlassen hatte, einschließlich des Hypophysenhinterlappens, der der letzte gemeinsame Weg für die AVP-Sekretion ist.
Managementansätze bei ADI
Das Management dieser Fälle wurde beschrieben (15, 18). Die Aufklärung von Patienten und Angehörigen über die Grundsätze des Wasserhaushalts und des Managements ist von entscheidender Bedeutung. Die Wasserzufuhr kann auf 1,5-2 l täglich festgelegt und dann eine Titration von Desmopressin vorgenommen werden. Die tägliche Gewichtskontrolle ist nützlich, um Dehydratation oder Flüssigkeitsüberladung zu erkennen. Es wird empfohlen, wöchentlich Plasmanatriumkonzentrationen zu bestimmen, um Schwankungen zu überwachen. Trotz strenger Überwachung ist es schwierig, rund um die Uhr eine Kontrolle der Plasmanatriumkonzentration zu erreichen, die die physiologische Osmoregulation nachahmt. Angesichts des Risikos rascher Schwankungen der Natriumkonzentration und der Symptome einer Hyponatriämie im unteren Referenzbereich ist es ratsam, die Natriumkonzentration im oberen Referenzbereich zu halten.
Desmopressin, das synthetische Analogon von AVP, wurde 1972 erstmals zur Behandlung von DI eingeführt (44). Die meisten Patienten kommen gut mit niedrigen Dosen von Desmopressin zurecht, die zweimal täglich verabreicht werden. Es besteht ein feines Gleichgewicht, und der Natriumspiegel kann bei geringfügigen Dosiseskalationen auf sehr niedrige Werte ansteigen.
Unsere Patientin kam sehr gut mit sehr niedrigen Dosen parenteraler Verabreichungen zurecht, die bekanntermaßen die geringste Variabilität der Bioverfügbarkeit aufweisen (45). Die Absorption von intranasalen Formulierungen ist sehr variabel, insbesondere bei Kindern oder Erwachsenen mit kognitiven Problemen, da sie die Lösung möglicherweise nicht gleichmäßig inhalieren (46, 47). Orale Formulierungen sind eine gute Option, da eine Erhöhung der Dosis zu einer längeren Wirkungsdauer führt, aber keine Spitzenwirkung hat (48-50). Wir haben diese Darreichungsform in unterschiedlichen Dosierungen von 50-100 mcg ausprobiert, aber wir stellten fest, dass die Wirkung bei dieser Formulierung von Tag zu Tag erheblich schwankt. Sublinguales Desmopressin (Minirin Melt) ist seit 2005 erhältlich. Pharmakologische Studien haben gezeigt, dass die sublinguale Verabreichung im Vergleich zur oralen Verabreichung zu einer um ~60 % höheren Bioverfügbarkeit führt (49, 50). Verfeinerte Dosen von sublingualem Desmopressin könnten durch Zerschneiden jeder 60-mcg-Tablette erreicht werden, was Dosisanpassungen von 65 bis 90 mcg sublingual ermöglicht. Ein ähnliches pharmakokinetisches Profil solcher geteilten Tabletten wurde beschrieben (51). Es ist bekannt, dass die gleichzeitige Einnahme von Nahrungsmitteln die Resorptionsrate und den Resorptionsgrad um 40 % verringert, daher sollte eine Stunde vor und nach der Verabreichung der sublingualen Desmopressin-Tabletten auf jegliche Nahrungsaufnahme verzichtet werden. Kürzlich wurde ein detailliertes Flüssigkeitsverabreichungsprotokoll mit täglicher Natriumüberwachung mit subkutanem Desmopressin in fester Dosierung beschrieben (28), das die Schwierigkeiten bei der täglichen Überwachung aufzeigt. In einem anderen aktuellen Fallbericht (27) wurde ebenfalls über die Verwendung der sublingualen Desmopressinform für ADI in einer Dosis von 60 und 120 mcg täglich berichtet. Die Verwendung von sublingualem Desmopressin kann eine nützliche Alternative sein, wenn mit anderen Formulierungen keine optimale Wirkung erzielt werden kann. Diese Patienten benötigen eine strenge Überwachung des täglichen Gewichts, des Urinvolumens und der Flüssigkeitsaufnahme rund um die Uhr. Angesichts der kognitiven und Gedächtnisstörungen, zu denen diese Patienten neigen, benötigen sie in der Regel eine Betreuungsperson, die die Flüssigkeitszufuhr überwacht, um sicherzustellen, dass sie die erforderliche Menge trinken.
In unserer Überprüfung der Fälle hatten 6 Patienten eine Remission der ADI, von denen 2 mit einem ACOM-Aneurysma (15, 16) und 4 mit einem Kraniopharyngiom (15, 26) zusammenhingen. Bei einem Patienten mit Neurosarkoidose kam es zu einer Remission unter Infliximab-Therapie (39). Diese Beobachtungen könnten darauf hindeuten, dass sowohl die Osmorezeptoren, die den Durst regulieren, als auch ihre efferenten Bahnen eine stärkere Neuroplastizität aufweisen als diejenigen, die die AVP-Produktion regulieren (26).
Schlussfolgerung
ADI ist eine extrem seltene Komplikation hypothalamischer Störungen, die zu einem Funktionsverlust des Durstzentrums führt. Aufgrund der hierarchischen Kontrolle durch das Durstzentrum ist das Fehlen von Durst auch mit einem Verlust der Vasopressinregulation und Polyurie verbunden. Patienten, die an ADI leiden, müssen mit niedrigen Dosen von Desmopressin und einem ausgeglichenen Flüssigkeitshaushalt vorsichtig behandelt werden. Mit den derzeitigen Überwachungs- und personalisierten Betreuungsansätzen ist es immer noch nicht möglich, eine quasi-physiologische Osmoregulation rund um die Uhr zu imitieren.
Datenverfügbarkeit
Alle für diese Studie generierten Datensätze sind im Manuskript/den ergänzenden Dateien enthalten.
Ethische Erklärung
Die schriftliche, informierte Zustimmung wurde von der/den Person(en) für die Veröffentlichung aller potenziell identifizierbaren Bilder oder Daten in diesem Artikel eingeholt.
Einwilligung zur Teilnahme
Wir haben die schriftliche Erlaubnis der nächsten Angehörigen des Patienten eingeholt, dieses Manuskript zu verfassen und zu veröffentlichen.
Beiträge der Autoren
RD war der primäre Endokrinologe, der den Flüssigkeitshaushalt des Patienten verwaltete, die Idee konzipierte, das Manuskript schrieb, die Literaturrecherche durchführte, die Daten beschaffte und das endgültige Manuskript schrieb und überprüfte. HC, AC und JH waren als Assistenzärzte an der Behandlung dieses Patienten beteiligt und überprüften das endgültige Manuskript. HT war der Anästhesist, der diesen Patienten während der Intensivphase betreute, entwickelte die Idee und bewertete das endgültige Manuskript kritisch. KC war der für den Patienten zuständige Rehabilitationsspezialist. Sie entwickelte die Idee und beurteilte das endgültige Manuskript kritisch. BB konzipierte die Idee und bewertete das endgültige Manuskript kritisch.
Finanzierung
RD wurde zum Teil durch den Center Grant des National Medical Research Council (NMRC/CG/017/2013) und den National Medical Research Council Clinician Scientist Award (MOH-CSAINV17nov-0006) unterstützt.
Conflict of Interest Statement
Die Autoren erklären, dass die Forschung in Abwesenheit jeglicher kommerzieller oder finanzieller Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Acknowledgments
Wir danken der Patientin und ihren Eltern, dass sie uns erlaubt haben, dieses Manuskript zu schreiben und zu veröffentlichen.
1. Eisenberg Y, Frohman LA. Adipsischer Diabetes insipidus: eine Übersicht. Endocr Pract. (2016) 22:76-83. doi: 10.4158/EP15940.RA
PubMed Abstract |Ref Full Text | Google Scholar
2. Robertson GL. Abnormalities of thirst regulation. Kidney Int. (1984) 25:460-9. doi: 10.1038/ki.1984.39
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Spetzler RF, Martin NA. Ein vorgeschlagenes Klassifizierungssystem für arteriovenöse Malformationen. J Neurosurg. (1986) 65:476-83. doi: 10.3171/jns.1986.65.4.0476
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Ellens NR, Figueroa BE, Clark JC. Die Verwendung von Barbiturat-induziertem Koma während zerebrovaskulärer neurochirurgischer Eingriffe: ein Überblick über die Literatur. Brain Circ. (2015) 1:140-6. doi: 10.4103/2394-8108.172887
CrossRef Full Text | Google Scholar
5. Zimmerman CA, Huey EL, Ahn JS, Beutler LR, Tan CL, Kosar S, et al. A gut-to-brain signal of fluid osmolarity controls thirst satiation. Nature. (2019) 568:98-102. doi: 10.1038/s41586-019-1066-x
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Augustine V, Gokce SK, Lee S, Wang B, Davidson TJ, Reimann F, et al. Hierarchical neural architecture underlying thirst regulation. Nature. (2018) 555:204-9. doi: 10.1038/nature25488
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Bichet DG. Regulation von Durst und Vasopressinfreisetzung. Annu Rev Physiol. (2019) 81:359-73. doi: 10.1146/annurev-physiol-020518-114556
PubMed Abstract | CrossRef Full Text | Google Scholar
8. McKinley MJ, Denton DA, Ryan PJ, Yao ST, Stefanidis A, Oldfield BJ. Von den zirkumventrikulären Sinnesorganen zur Großhirnrinde: Neurale Bahnen zur Kontrolle von Durst und Hunger. J Neuroendocrinol. (2019) 31:e12689. doi: 10.1111/jne.12689
PubMed Abstract | CrossRef Full Text | Google Scholar
9. McKinley MJ, Yao ST, Uschakov A, McAllen RM, Rundgren M, Martelli D. Der mediane präoptische Nukleus: im Zentrum der Regulation von Körperflüssigkeit, Natrium, Temperatur, Schlaf und kardiovaskulärer Homöostase. Acta Physiol. (2015) 214:8-32. doi: 10.1111/apha.12487
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Hiyama TY, Matsuda S, Fujikawa A, Matsumoto M, Watanabe E, Kajiwara H, et al. Autoimmunität gegen den Natriumspiegelsensor im Gehirn verursacht essentielle Hypernatriämie. Neuron. (2010) 66:508-22. doi: 10.1016/j.neuron.2010.04.017
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Baylis PH, Thompson CJ. Osmoregulation der Vasopressinsekretion und Durst in Gesundheit und Krankheit. Clin Endocrinol. (1998) 29:549-76. doi: 10.1111/j.1365-2265.1988.tb03704.x
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Gizowski C, Bourque CW. Die neuronale Grundlage von homöostatischem und antizipatorischem Durst. Nat Rev Nephrol. (2018) 14:11-25. doi: 10.1038/nrneph.2017.149
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Smith D, McKenna K, Moore K, Tormey W, Finucane J, Phillips J, et al. Baroregulation of vasopressin release in adipsic diabetes insipidus. J Clin Endocrinol Metab. (2002) 87:4564-8. doi: 10.1210/jc.2002-020090
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Jung HJ, Kwon TH. Molekulare Mechanismen zur Regulierung von Aquaporin-2 im Nierensammelkanal. Am J Physiol Renal Physiol. (2016) 311:F1318-28. doi: 10.1152/ajprenal.00485.2016
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Cuesta M, Gupta S, Salehmohamed R, Dineen R, Hannon MJ, Tormey W, et al. Heterogene Muster der Wiederherstellung von Durst bei erwachsenen Patienten mit adipösem Diabetes insipidus. QJM. (2016) 109:303-8. doi: 10.1093/qjmed/hcv175
PubMed Abstract |Ref Full Text | Google Scholar
16. Imai E, Kaneko S, Tsukamoto Y. Renale kompensatorische Anpassung für den Umgang mit Wasser bei einem Patienten mit adipösem Diabetes insipidus nach Clipping eines rupturierten Aneurysmas der vorderen kommunizierenden Arterie. Clin Nephrol. (2017) 88:112-6. doi: 10.5414/CN108963
PubMed Abstract | CrossRef Full Text | Google Scholar
17. McIver B, Connacher A, Whittle I, Baylis P, Thompson C. Adipsischer hypothalamischer Diabetes insipidus nach Clipping eines Aneurysmas der vorderen Kommunikationsarterie. BMJ. (1991) 303:1465-7. doi: 10.1136/bmj.303.6815.1465
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Ball SG, Vaidya B, Bayliss PH. Hypothalamisches adipöses Syndrom: Diagnose und Behandlung. Clin Endocrinol. (1997) 47:405-9. doi: 10.1046/j.1365-2265.1997.2591079.x
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Nguyen BN, Yablon SA, Chen CY. Hypodipsische Hypernatriämie und Diabetes insipidus nach Clipping eines Aneurysmas der vorderen Kommunikationsarterie: diagnostische und therapeutische Herausforderungen bei amnestischen Rehabilitationspatienten. Brain Injury. (2001) 15:975-80. doi: 10.1080/02699050110063459
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Nussey SS, Ang VT, Jenkins JS. Chronische Hypernatriämie und Hypothermie nach Subarachnoidalblutung. Postgrad Med J. (1986) 62:467-741. doi: 10.1136/pgmj.62.728.467
CrossRef Full Text | Google Scholar
21. Spiro SG, Jenkins JS. Adipsie und Hypothermie nach Subarachnoidalblutung. BMJ. (1971) 3:411-2. doi: 10.1136/bmj.3.5771.411
CrossRef Full Text | Google Scholar
22. Crowley RK, Sherlock M, Agha D, Smith D, Thompson CJ. Klinische Einblicke in den adipsischen Diabetes insipidus: eine große Fallserie. Clin Endocrinol. (2007) 66:475-82. doi: 10.1111/j.1365-2265.2007.02754.x
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Colleran K, Sanchez-Goettler L, Sloan A. Hypothalamische Adipositas kompliziert durch adipösen zentralen Diabetes insipidus nach chirurgischer Resektion eines Kraniopharyngioms. J Clin Hypertens. (2009) 11:608-10. doi: 10.1111/j.1751-7176.2009.00057.x
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Zantut-Wittmann D, Garmes HM, Panzan AD, Lima Mde O, Baptista MT. Schwere Rhabdomyolyse aufgrund von adipöser Hypernatriämie nach Kraniopharyngiomoperation. Arq Bras Endocrinol Metabol. (2007) 51:7. doi: 10.1590/S0004-27302007000700023
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Raghunathan V, Dhaliwal MS, Gupta A, Jevalikar G. From cerebral salt wasting to diabetes insipidus with adipsia: case report of a child with craniopharyngioma. J Pediatr Endocrinol Metab. (2015) 28:323-6. doi: 10.1515/jpem-2014-0224
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Sinha A, Ball S, Jenkins A, Hale J, Cheetham T. Objective assessment of thirst recovery in patients with adipsic diabetes insipidus. Pituitary. (2011) 14:307-11. doi: 10.1007/s11102-011-0294-3
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Pérez MA, Millán HA, Naranjo JA, Flórez Romero A. Adipsic diabetes insipidus secondary to craniopharyngioma resection. BMJ Case Rep. (2019) 12:e225903. doi: 10.1136/bcr-2018-225903
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Pabich S, Flynn M, Pelley E. Daily sodium monitoring and fluid intake protocol: preventing recurrent hospitalization in adipsic diabetes insipidus. J Endoc Soc. (2019) 3:882-6. doi: 10.1210/js.2018-00406
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Pereira MC, Vieira MM, Pereira JS, Salgado D. Adipsia in a diabetes insipidus patient. Case Rep Oncol. (2015) 8:385-8. doi: 10.1159/000440611
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Zhang Y, Wang D, Feng Y, Zhang W, Zeng X. Juvenile-onset gout and adipsic diabetes insipidus: a case report and literature review. J Int Med Res. (2018) 46:4829-36. doi: 10.1177/0300060518800114
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Latcha S, Lubetzky M, Weinstein AM. Schwere Hyperosmolarität und Hypernatriämie bei einer adipösen jungen Frau. Clin Nephrol. (2011) 76:407-11. doi: 10.5414/CN106617
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Sherlock M, Agha A, Crowley R, Smith D, Thompson CJ. Adipöser Diabetes insipidus nach Hypophysenoperation wegen eines Makroprolaktinoms. Pituitary. (2006) 9:59-64. doi: 10.1007/s11102-006-8280-x
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Hiyama TY, Utsunomiya AN, Matsumoto M, Fujikawa A, Lin CH, Hara K, et al. Adipsische Hypernatriämie ohne hypothalamische Läsionen begleitet von Autoantikörpern gegen das subfornische Organ. Brain Pathol. (2017) 27:323-31. doi: 10.1111/bpa.12409
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Komatsu H, Miyake H, Kakita S, Ikuta H. Hypoplasie des Corpus callosum in Verbindung mit adipöser Hypernatriämie und hypothalamischem Hypogonadotropinismus: ein Fallbericht und Literaturübersicht. Pediatr Int. (2001) 43:683-7. doi: 10.1046/j.1442-200X.2001.01453.x
PubMed Abstract | CrossRef Full Text | Google Scholar
35. Schaff-Blass E, Robertson GL, Rosenfield RL. Chronische Hypernatriämie durch einen angeborenen Defekt in der Osmoregulation von Durst und Vasopressin. J Pediatr. (1983) 102:703-8. doi: 10.1016/S0022-3476(83)80237-6
PubMed Abstract | CrossRef Full Text | Google Scholar
36. AvRuskin TW, Tang SC, Juan C. Essential hypernatremia, antidiuretic hormone and neurohypophysin secretion: response to chlorpropamide. Acta Endocrinol. (1981) 96:145-53. doi: 10.1530/acta.0.0960145
CrossRef Full Text | Google Scholar
37. Radetti G, Rizza F, Mengarda G, Pittschieler K. Adipsic hypernatremia in two sisters. Am J Dis Child. (1991) 145:321-5. doi: 10.1001/archpedi.1991.02160030091028
PubMed Abstract | CrossRef Full Text | Google Scholar
38. Takeya T, Hamano K, Iwasaki N, Kitazawa R, Tsuji C, Jougamoto M. Ein Fall von chronischer Hypernatriämie mit Corpus Callosum Agenese. Nippon Shounikagakkai Zasshi. (1996) 100:1392-5.
Google Scholar
39. O’Reilly MW, Sexton DJ, Dennedy MC, Counihan TJ, Finucane FM, O’Brien T, et al. Radiologische Remission und Wiederherstellung des Durstgefühls nach Infliximab-Therapie bei adipösem Diabetes insipidus sekundär zu Neurosarkoidose. QJM. (2015) 108:657-9. doi: 10.1093/qjmed/hct023
PubMed Abstract |Ref Full Text | Google Scholar
40. Duvernoy H, Koritké JG, Monnier G. . Zeitschrift für Zellforschung und mikroskopische Anatomie. (1969) 102:49-77. doi: 10.1007/BF00336416
PubMed Abstract | CrossRef Full Text | Google Scholar
41. Duvernoy HM, Risold PY. Die zirkumventrikulären Organe: ein Atlas der vergleichenden Anatomie und Vaskularisation. Brain Res Rev. (2007) 56:119-47. doi: 10.1016/j.brainresrev.2007.06.002
PubMed Abstract | CrossRef Full Text | Google Scholar
42. Lindgren A, Vergouwen MD, van der Schaaf I, Algra A, Wermer M, Clarke MJ, et al. Endovascular coiling versus neurosurgical clipping for people with aneurysmal subarachnoid haemorrhage. Cochrane Database Syst Rev. (2018) 8:CD003085. doi: 10.1002/14651858.CD003085.pub3
PubMed Abstract | CrossRef Full Text | Google Scholar
43. Ewout JH, Robert Z. Wasserhaushaltsstörungen nach neurochirurgischen Eingriffen: die dreiphasige Reaktion revisited. NDT Plus. (2010) 3:42-4. doi: 10.1093/ndtplus/sfp117
CrossRef Full Text | Google Scholar
44. Andersson KE, Arner B. Auswirkungen von DDAVP, einem synthetischen Analogon von Vasopressin, bei Patienten mit kranialem Diabetes insipidus. Acta Med Scand. (1972) 192:21-7. doi: 10.1111/j.0954-6820.1972.tb04772.x
PubMed Abstract | CrossRef Full Text | Google Scholar
45. Rembratt A, Graugaard-Jensen C, Senderovitz T, Norgaard JP, Djurhuus JC. Pharmakokinetik und Pharmakodynamik von oral versus intravenös verabreichtem Desmopressin am Tag versus in der Nacht bei gesunden Männern im Alter von 55-70 Jahren. Eur J Clin Pharmacol. (2004) 60:397-402. doi: 10.1007/s00228-004-0781-9
PubMed Abstract | CrossRef Full Text | Google Scholar
46. Vande Walle J, Stockner M, Raes A, Nørgaard JP. Desmopressin 30 Jahre im klinischen Einsatz: ein Sicherheitsüberblick. Curr Drug Saf. (2007) 2:232-8. doi: 10.2174/157488607781668891
PubMed Abstract | CrossRef Full Text | Google Scholar
47. Yutaka O, Robertson GL, Nørgaard JP, Juul KV. Die Behandlung des neurohypophysären Diabetes insipidus. J Clin Endocrinol Metabol. (2013) 98:3958-67. doi: 10.1210/jc.2013-2326
CrossRef Full Text | Google Scholar
48. Fjellestad-Paulsen A, Höglund P, Lundin S, Paulsen O. Pharmakokinetik von 1-Deamino-8-D-Arginin-Vasopressin nach verschiedenen Verabreichungswegen bei gesunden Probanden. Clin Endocrinol. (1993) 38:177-82. doi: 10.1111/j.1365-2265.1993.tb00990.x
CrossRef Full Text | Google Scholar
49. Lam KS, Wat MS, Choi KL, Ip TP, Pang RW, Kumana CR. Pharmakokinetik, Pharmakodynamik, Langzeitwirksamkeit und Sicherheit von oralem 1-Deamino-8-D-Arginin-Vasopressin bei erwachsenen Patienten mit zentralem Diabetes insipidus. Br J Clin Pharmacol. (1996) 42:379-85. doi: 10.1046/j.1365-2125.1996.39914.x
PubMed Abstract | CrossRef Full Text | Google Scholar
50. Steiner IM, Kaehler ST, Sauermann R, Rinosl H, Muller M, Joukhadar C. Plasma pharmacokinetics of desmopressin following sublingual administration: an exploratory dose-escalation study in healthy male volunteers. Int J Clin Pharmacol Ther. (2006) 44:172-9. doi: 10.5414/CPP44172
PubMed Abstract | CrossRef Full Text | Google Scholar
51. De Waele K, Cools M, De Guchtenaere A, Van de Walle J, Raes A, Van Aken S, et al. Desmopressin Lyophilisat zur Behandlung von zentralem Diabetes insipidus: erste Erfahrungen bei sehr jungen Säuglingen. Int J Endocrinol Metab. (2014) 12:e16120. doi: 10.5812/ijem.16120
PubMed Abstract | CrossRef Full Text | Google Scholar