- Introduction
- Materialien und Methoden
- Einschlusskriterien
- Ovarielle Stimulation und Eizellentnahme
- Embryotransferverfahren
- Primäre Ergebnismessungen und statistische Analyse
- Ergebnisse
- Eizellen- und Embryoparameter
- Schwangerschaftsergebnisse und kumulative Lebendgeburtenrate (CLBR)
- Diskussion
- Schlussfolgerung
- Datenverfügbarkeit
- Ethikerklärung
- Beiträge der Autoren
- Finanzierung
- Erklärung zu Interessenkonflikten
- Danksagungen
Introduction
Kürzlich wurde ein neuartiges System, die POSEIDON-Kriterien, zur Klassifizierung von Unfruchtbarkeitspatientinnen mit schlechter Prognose entwickelt, die sich einer Behandlung mit assistierter Reproduktionstechnologie (ART) unterziehen (1). Es handelt sich um ein nützliches System zur Identifizierung und Klassifizierung von Patientinnen mit eingeschränkter Ovarialreserve oder schlechtem Ansprechen der Eierstöcke (poor ovarian response, POR), das eine Orientierungshilfe für die Diagnose und Behandlung dieser Patientinnen bietet (2). Es wurden vier Untergruppen vorgeschlagen, die auf quantitativen und qualitativen Parametern basieren, darunter Alter, Biomarker für die ovarielle Reserve und ovarielle Reaktion. Durch die Einführung einer detaillierteren Stratifizierung der POR haben die neuen Kriterien die Heterogenität der Patientinnen, die die Bologna-Kriterien erfüllen, erheblich verringert (3). Dadurch können innerhalb der POR-Population Patientenuntergruppen unterschieden werden, die identifiziert werden und von spezifischen Maßnahmen profitieren können (4). Obwohl die POSEIDON-Kriterien aufgestellt wurden und einige spezifische Behandlungsempfehlungen für die einzelnen Patientenuntergruppen vorgeschlagen wurden (5), gibt es nach wie vor keine ausreichenden Belege für die Gültigkeit der in den POSEIDON-Kriterien verwendeten Parameter sowie für die Ergebnisbewertung der verschiedenen Untergruppen.
Unter den vier Gruppen, die auf den POSEIDON-Kriterien basieren, ist Gruppe 1 aufgrund ihres jüngeren Alters und ihrer normalen Ovarialreserve zweifellos die Gruppe mit der besten Prognose, während Gruppe 4 aufgrund des fortgeschrittenen Alters und der verminderten Ovarialreserve die schlechteste Prognose hat. Eine interessante Frage ist jedoch, wer ein besseres Schwangerschaftsergebnis erzielen würde: die älteren Frauen (Gruppe 2) mit normaler Ovarialreserve oder die jungen Frauen (Gruppe 3) mit verminderter Ovarialreserve. Die kumulative Lebendgeburtenrate (CLBR) gilt als ein bevorzugtes Maß für den Erfolg einer IVF-Behandlung (6). Bisher gibt es nur sehr wenige Berichte über die CLBR der vier durch die POSEIDON-Kriterien definierten Patientengruppen.
Die Merkmale und die Prognose der Patientinnen sollten zur Entwicklung klinischer Behandlungsstrategien genutzt werden. Das Ziel dieser Studie ist es, die Patienten mit schlechter Prognose zu charakterisieren, um die Entscheidungsfindung bei der Behandlung zu erleichtern. In dieser Studie wurden die Ausgangscharakteristika und Ergebnisse der nach den POSEIDON-Kriterien definierten Patientengruppen analysiert, und die CLBR, die aus einem Zyklus mit aspirierter In-vitro-Fertilisation (IVF)/intrazytoplasmatischer Spermieninjektion (ICSI) resultiert, wurde als primäre Ergebnismessung für Patienten mit niedriger Prognose vorgeschlagen, die sich einer IVF-Behandlung unterziehen (7).
Materialien und Methoden
Diese retrospektive Studie umfasste 18.455 frisch aspirierte IVF-Zyklen mit anschließendem eingefrorenen Embryotransfer von Januar 2014 bis Januar 2017 in unserem Zentrum. Das Ergebnis der Lebendgeburt wurde mindestens 2 Jahre lang bis Januar 2019 nachverfolgt. Die Studie wurde von der Ethikkommission für die klinische Anwendung der assistierten Reproduktionstechnologie beim Menschen des Northwest Women’s and Children’s Hospital genehmigt (Nr. 2018002). Die Ethikkommission genehmigte diese Studie und verzichtete auf die Einholung einer informierten Zustimmung. Alle Untersuchungen wurden in Übereinstimmung mit den einschlägigen Richtlinien und Vorschriften durchgeführt.
Einschlusskriterien
Die Patienten wurden nach den POSEIDON-Kriterien kategorisiert:
Patienten mit niedriger Prognose
Gruppe 1 (n = 879 Zyklen): Alter < 35, Antralfollikelzahl (AFC) ≥ 5, Anzahl der entnommenen Eizellen ≤ 9 im vorherigen Zyklus;
Gruppe 2 (n = 482 Zyklen): Alter ≥ 35, AFC≥5, Anzahl der entnommenen Oozyten ≤ 9 im vorherigen Zyklus;
Gruppe 3 (n = 858 Zyklen): Alter < 35, AFC < 5;
Gruppe 4 (n = 1.306 Zyklen): Alter ≥ 35, AFC < 5;
Nicht-Niedrigprognose-Patientinnen
Gruppe 5 (n = 664 Zyklen): AFC ≥ 5, vorherige Stimulation der Eierstöcke > 9 Eizellen;
Gruppe 6 (n = 13708 Zyklen): AFC ≥ 5, keine vorherige ovarielle Stimulation.
Flussdiagramm und Datenverarbeitungsprozess sind in Abbildung 1 aufgeführt. Die demografischen und basalen Merkmale der Patientinnen sind in Tabelle 1 aufgeführt.
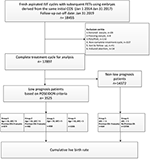
Abbildung 1. Flussdiagramm und Datenverarbeitung.
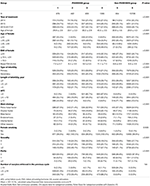
Tabelle 1. Demografische Daten und Ausgangscharakteristika.
Ovarielle Stimulation und Eizellentnahme
Das Protokoll für die ovarielle Stimulation (OS) wurde individuell nach dem Alter der Frau, dem Body-Mass-Index (BMI), dem basalen follikelstimulierenden Hormon (FSH) und der Antralfollikelzahl (AFC) festgelegt. 94,33 % der IVF-Patientinnen erhielten rekombinante und/oder Urin-Gonadotropine (rFSH/hMG) im GnRH-Agonisten-Protokoll oder GnRH-Antagonisten-Protokoll, gefolgt von IVF oder ICSI. Bei Frauen mit verminderter ovarieller Reserve wurde das Protokoll der milden Stimulation oder der ovariellen Stimulation in der Lutealphase oder der natürliche Zyklus verwendet. Humanes menopausales Gonadotropin (hMG, Li Zhu, China) wurde je nach Ansprechen der Patientinnen auf die Stimulation im milden Ovulationsprotokoll oder im Shanghai-Protokoll hinzugefügt. Humanes Choriongonadotropin (hCG) 4.000-10.000 IE oder rekombinantes hCG (r-hCG, MerckSerono S.p.A.) 250μg wurde verabreicht, wenn 2-3 Follikel die Größe von 17 mm oder mehr erreicht hatten. Sechsunddreißig Stunden später wurde die Eizellentnahme mittels transvaginaler ultraschallgesteuerter Aspiration durchgeführt. Die Parameter der ovariellen Stimulation jeder Gruppe sind in Tabelle 2 aufgeführt.

Table 2. Parameter der Stimulation der Eierstöcke.
Embryotransferverfahren
Die Verfahren zur Aufbereitung der Eizellen und Entwicklung der Embryonen sowie das Embryo-Scoring-System wurden in unseren früheren Artikeln beschrieben (8, 9). Embryonen des Grades 1-3 am Tag 3 wurden als brauchbare Embryonen betrachtet, und Embryonen des Grades 1-2 galten als Embryonen guter Qualität. Alle frischen Embryotransfers (ETs) wurden an Tag 3 oder Tag 5 durchgeführt. In Fällen, in denen am Tag 3 eine ausreichende Anzahl (≥ 3-4) von Embryonen guter Qualität vorhanden war, wurde der Blastozystentransfer am Tag 5 durchgeführt. Abgesehen von den übertragenen Embryonen wurden die zusätzlichen Embryonen der Patientinnen an Tag 3 oder im Blastozystenstadium (Tag 5-6) vitrifiziert. Embryonen im Spaltstadium 1-3 an Tag 3 und Blastozysten mit einem Gardner-Score über 4CC wurden kryokonserviert (Cryo-top, offenes System, Kuwayama). Die Methoden und das Verfahren der gefrorenen ET sind in einer früheren Verifikationsstudie unseres Teams ausführlich beschrieben (8, 9). Wenn die Einnistung im frischen Zyklus fehlschlug, wurde der gefriergetaute Embryotransfer (FET) mit den verbleibenden vitrifizierten Embryonen oder Blastozysten durchgeführt. Patientinnen unter 35 Jahren mit Embryonen von guter Qualität wurden zu einem Ein-Embryo-Transfer ermutigt. Ein Ein-Embryo-Transfer wurde auch bei Patientinnen mit einer abnormen Gebärmutter (z. B. vernarbte Gebärmutter, Gebärmutterfehlbildung) und/oder anderen Fällen, die mit einer Zwillingsschwangerschaft in Konflikt standen, durchgeführt. Die intramuskuläre Injektion von Progesteron (60 mg/Tag) wurde zur Unterstützung der Lutealphase ab dem Tag der Eizellentnahme bis zu einem negativen Beta-hCG-Serum oder bis zur 8. Schwangerschaftswoche verabreicht.
Primäre Ergebnismessungen und statistische Analyse
Das primäre Ergebnis war die kumulative Lebendgeburt (CLB), definiert als mindestens eine Lebendgeburt aus einem aspirierten ART-Zyklus in der frischen ET oder in der anschließenden FET im Verhältnis zur Anzahl der entnommenen Eizellen. Der Zähler der CLBR-Berechnung war die Summe der Lebendgeburten in den FETs und der Lebendgeburten in frischen Zyklen. Wenn eine Patientin mehrere Geburten hatte, wurde nur die erste Geburt in die Analyse einbezogen. Die CLBR wurde als kumulative Lebendgeburt pro transvaginaler Oozytenpunktion gemäß der Terminologiedefinition definiert (7, 10) Ein Behandlungszyklus wurde als eine Oozytenentnahme definiert. Ein vollständiger Behandlungszyklus bezeichnete einen Behandlungszyklus, bei dem eine Lebendgeburt erreicht wurde, oder einen Behandlungszyklus, bei dem eine Lebendgeburt mit allen transferierten Embryonen nicht erreicht wurde. Die kumulative Lebendgeburtenrate in dieser Studie wurde auf der Grundlage des vollständigen Behandlungszyklus berechnet, so dass die Patientinnen (n = 337) mit nicht vollständiger Behandlung ausgeschlossen wurden.
Die Datenverarbeitung und statistische Analyse wurden mit der Software EmpowerStats (www.empowerstats.com) und dem statistischen Softwarepaket R durchgeführt. Zur Bewertung der Odds Ratio (OR) von CLBR in verschiedenen Patientengruppen wurde ein multiples variables Regressionsmodell mit potenziellen Störfaktoren als Variablen erstellt und für das Jahr der Behandlung, den BMI der Frau, die Art der Unfruchtbarkeit, die Dauer der Unfruchtbarkeit, die Gravidität, die Parität, die Hauptursache, das OS-Protokoll, den Gonadotropin-Typ und die FSH-Startdosis angepasst. Die Patientinnen wurden über einen Zeitraum von 3 Jahren erfasst, in denen das IVF-Verfahren überarbeitet wurde. Um die durch diesen Faktor verursachte Verzerrung zu beseitigen, wurde die kumulative Lebendgeburtenrate um das Jahr der Behandlung bereinigt. Der BMI der Frau, die Art der Unfruchtbarkeit, die Dauer der Unfruchtbarkeit, die Gravidität, die Parität und die Hauptursache der Unfruchtbarkeit waren wichtige Faktoren, die sich erfahrungsgemäß oder in der Literatur auf die Schwangerschaft und die Lebendgeburt auswirken. OS-Protokoll, Gonadotropin-Typ und FSH-Startdosis sind die Schlüsselindikatoren, die die Anzahl der entnommenen Eizellen und letztlich die kumulative Chance auf Lebendgeburten beeinflussen.
Ergebnisse
Eizellen- und Embryoparameter

Tabelle 3. Eizellen- und Embryoparameter und CLBRs.
Schwangerschaftsergebnisse und kumulative Lebendgeburtenrate (CLBR)
In Übereinstimmung mit dem Verteilungsmuster der Anzahl der Eizellen und Embryonen nach Gruppen betrug die CLBR in der Reihenfolge vom höchsten zum niedrigsten Wert 44.6% in Gruppe 1 (n = 879), 35,5% in Gruppe 3 (n = 858), 24,5% in Gruppe 2 (n = 482) und 12,7% in Gruppe 4 (n = 1306). Es wurde eine Regressionsanalyse mit mehreren Variablen durchgeführt, wobei die Variablen, die als Störfaktoren wirken könnten, in den Tabellen 1 und 2 beschrieben sind. Die bereinigten Odds Ratios (ORs) für CLBR mit ihren 95 %-Konfidenzintervallen (CIs) sind in Tabelle 4 dargestellt. In Übereinstimmung mit dem Trend der nicht bereinigten Ergebnisse war die CLBR in Gruppe 3 (OR 0,9, 95% CI 0,7-1,2, p = 0,615) etwas niedriger und in Gruppe 5 (OR 1,3, 95% CI 0,9-1,7, p = 0,111) etwas höher als die CLBR in Gruppe 1, ohne dass ein signifikanter statistischer Unterschied bestand. Die CLBR in Gruppe 2 war signifikant niedriger als in Gruppe 1 (OR 0,6, 95% CI 0,4-0,8, p = 0,004) und die CLBR in Gruppe 4 war im Vergleich zu Gruppe 1 am niedrigsten (OR 0,4, 95% CI 0,3-0,6, p < 0,001). Tabelle 5 zeigt die Schwangerschaftsergebnisse per Frischübertragung oder FET bei Patienten mit niedriger Prognose. Die Implantationsraten in den älteren Gruppen (Gruppe 2 und Gruppe 4) waren signifikant niedriger als in den jungen Gruppen (Gruppe 1 und Gruppe 3).

Tabelle 4. Logistische Regressionsanalyse für CLBRs.

Tabelle 5. Schwangerschaftsergebnisse pro Transfer sowohl bei frischem als auch bei gefrorenem Embryotransfer bei Patienten mit niedriger Prognose.
Abbildung 2 zeigt das Trenddiagramm der wichtigsten Ereignisse bei Patienten mit niedriger Prognose. Es gab eine Überschneidung der Trendlinien zwischen Gruppe 2 und Gruppe 3 nach dem Embryotransfer. Die Patienten der Gruppe 2 (Alter ≥35; AFC ≥ 5) hatten eine höhere AFC, mehr entnommene Eizellen, mehr Embryonen und mehr Embryonen guter Qualität, aber eine geringere Implantationsrate und CLBR. Im Gegensatz dazu hatten die Patientinnen der Gruppe 3 (Alter < 35; AFC < 5) zwar weniger Eizellen und Embryonen, aber die CLBR war höher als die der Gruppe 2. Die SWOT-Analyse der 4 Gruppen von Patientinnen mit niedriger Prognose, die nach den POSEIDON-Kriterien definiert wurden, ist in Abbildung 3 dargestellt.
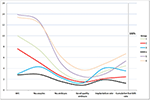
Abbildung 2. Trenddiagramm der wichtigsten Ereignisse bei Patienten mit niedriger Prognose. Es gab eine Kreuzung der Trendlinien zwischen Gruppe 2 (rot) und Gruppe 3 (blau) nach dem Embryotransfer. Die X-Achse zeigt die durchschnittliche Anzahl der AFC, die Anzahl der Eizellen, die Anzahl der Embryonen, die Anzahl der Embryonen guter Qualität, die Implantationsrate und die Rate der kumulativen Lebendgeburten. Die Y-Achse auf der linken Seite steht für die Anzahl der ersten vier Variablen (n) und die Y-Achse auf der rechten Seite für die Rate der letzten beiden Variablen (%).

Abbildung 3. SWOT-Analyse von 4 Gruppen von Patienten mit niedriger Prognose, die nach den POSEIDON-Kriterien definiert wurden.
Diskussion
Das wichtigste Ergebnis dieser retrospektiven Studie in der nach den POSEIDON-Kriterien definierten Population war, dass die CLBR in Gruppe 1 am höchsten war, gefolgt von Gruppe 3 und Gruppe 2, und am niedrigsten in Gruppe 4. Unseren Ergebnissen zufolge war die CLBR der jungen Frauen mit geringer Ovarialreserve (Gruppe 3) etwas niedriger als die der jungen Frauen mit guter Ovarialreserve und früherem niedrigen Ansprechverhalten (Gruppe 1). Obwohl die Patientinnen der Gruppe 2 (Alter ≥ 35; AFC ≥ 5) eine bessere Ovarialreserve, mehr Eizellen und mehr Embryonen hatten, waren die CLBR und die Implantationsrate umgekehrt niedriger als bei den Patientinnen der Gruppe 3 mit schlechterer Ovarialreserve, weniger Eizellen und weniger Embryonen. Diese Erkenntnis könnte die Entwicklung von Behandlungsstrategien für Patientinnen mit schlechter Prognose erleichtern.
Die innovativen POSEIDON-Kriterien zielen darauf ab, Patientinnen mit schlechter Prognose anhand des Alters der Frau, der AFC und des Ansprechens der Eierstöcke im vorangegangenen Zyklus in vier verschiedene Gruppen einzuteilen und zu stratifizieren (4). Die Patientinnen der Gruppe 2 zeichnen sich durch eine gute Ovarialreserve und ein fortgeschrittenes Alter aus, genau das Gegenteil der Patientinnen der Gruppe 3, die eine schlechte Ovarialreserve haben, aber jünger sind. Studien (11-13) haben gezeigt, dass die CLBR mit der Anzahl der entnommenen Eizellen auch bei Frauen in fortgeschrittenem Alter ansteigt (14). Es wurde angenommen, dass die Anzahl der entnommenen Eizellen eine sehr wichtige Variable ist, die unabhängig mit der CLBR assoziiert ist. Es wurde erwartet, dass die Patientinnen der Gruppe 2 mit einer höheren Anzahl von Eizellen eine bessere Prognose haben als die Patientinnen der Gruppe 3, da die Patientinnen der Gruppe 2 mehr Embryonen zum Transfer hatten. Allerdings waren die CLBR und die Implantationsrate in Gruppe 2 umgekehrt höher als in Gruppe 3.
Unsere Ergebnisse stimmen mit früheren Studien (15, 16) über den Zusammenhang zwischen ovarieller Reserve und Schwangerschaftsergebnis überein. Chang et al. (15) stellten fest, dass die Raten für normale Befruchtung, Spaltung, hochwertige Embryonen, Implantation und Schwangerschaft bei älteren Frauen niedriger waren als bei jüngeren Frauen mit verminderter Ovarialreserve. Der Hauptgrund dafür waren die negativen Auswirkungen alternder Eizellen auf das Schwangerschaftsergebnis (niedrige Implantationsrate und hohe Schwangerschaftsverlustrate) aufgrund von Chromosomenanomalien (17) und zytoplasmatischen Funktionsstörungen (18). Die Abnahme der Fruchtbarkeit mit zunehmendem Alter betrifft sowohl die Quantität als auch die Qualität der Eizellen. Implantation und Fehlgeburt hängen mit der Qualität der Eizellen, aber nicht unbedingt mit der ovariellen Reserve zusammen (16). Die gute ovarielle Reserve in Gruppe 2 würde die Möglichkeit erhöhen, mehr Eizellen und Embryonen für den Transfer zu erhalten, aber gleichzeitig würde die höhere Aneuploidierate zu einer niedrigen Implantationsrate und einer hohen Fehlgeburtenrate führen.
Im Hinblick auf die Behandlung von Patientinnen der Gruppe 2 sollte mehr Aufmerksamkeit auf die Entwicklung von Strategien zur Verbesserung der Eizellenqualität als auf die Eizellen- oder Embryonenquantität gerichtet werden. Da in Gruppe 2 am Tag 3 mehr Embryonen erzielt werden, ist die Kultivierung der Embryonen bis zum Blastozystenstadium für den Transfer eine gute Option. Embryonen vom Tag 5-6 haben eine geringere Rate an segmentaler Aneuploidie (19) und eine höhere Lebensfähigkeit für die Implantation (20) als Embryonen vom Tag 2-3. Genetische Präimplantationstests auf Aneuploidien (PGT-A) sind für Frauen im fortgeschrittenen Stadium ebenfalls von Vorteil, um einen euploiden Embryo für den Transfer auszuwählen (21). Eine optimale Stimulationsbehandlung der Eierstöcke zur Verbesserung der Eizellenqualität (22, 23) könnte eine Alternative darstellen. Ergänzungsmittel wie Dehydroepiandrosteron wurden versucht, die Follikelentwicklung zu verbessern (24), obwohl es keine ausreichenden Beweise für ihre Verwendung bei diesen Patientinnen gibt.
Die Patientinnen in Gruppe 3 (Alter < 35; AFC < 5) hatten eine schlechte ovarielle Reserve, die erwartungsgemäß schlecht ansprachen und ein schlechtes Schwangerschaftsergebnis hatten. Interessanterweise war die Eizellenproduktionsrate (145,3 % entnommene Eizellen pro AFC) in Gruppe 3 signifikant höher als in den anderen Gruppen, obwohl die FSH-Startdosis nicht signifikant erhöht wurde (Tabelle 2). Dies deutet darauf hin, dass die Reaktion der Antralfollikel auf Gonadotropin möglicherweise die Grenze ihrer Leistungsfähigkeit erreicht hat, so dass eine weitere Erhöhung der täglichen Gonadotropindosis keinen zusätzlichen Nutzen für die Oozytenzahl hat (25). Die Bewertung der Empfindlichkeit der Eierstöcke gegenüber FSH ist ein Schlüsselelement zur Verbesserung der IVF-Erfolgsraten bei diesen Patientinnen mit schlechter Prognose und eröffnet neue Behandlungsperspektiven (26). Die hohe Oozytenproduktionsrate pro AFC in Gruppe 3 unterstützte auch die berichtete Empfehlung einer maximalen Tagesdosis von 300 IE rFSH (5). Bei den Patientinnen der Gruppe 3 sollten mehr Anstrengungen auf die Erhöhung der Oozytenzahl gerichtet werden, da das klinische Schwangerschaftsergebnis gesichert ist, sobald Oozyten gewonnen werden.
Die Patientinnen der Gruppe 5 waren die Patientinnen mit nicht niedriger Prognose, die ein gutes Ansprechen der Eierstöcke hatten (mehr als 9 Oozyten bei der letzten Entnahme), jedoch scheiterten die meisten dieser Patientinnen an einer Lebendgeburt im letzten IVF-Zyklus. Im Vergleich zu einer anderen Gruppe von Patientinnen mit nicht schlechter Prognose, die eine erste IVF-Behandlung erhalten hatten (Gruppe 6), hatten die Patientinnen der Gruppe 5 zwar mehr AFC und mehr Eizellen entnommen, aber die Embryonalentwicklung und das Schwangerschaftsergebnis waren schlechter als in der Gruppe 6. Daher kann das Scheitern der ersten IVF-Patientinnen mit gutem Ansprechen der Eierstöcke die schlechte Prognose für eine nachfolgende IVF-Behandlung sein.
Der Becken-Tubus-Faktor ist die häufigste Ursache für Unfruchtbarkeit und macht etwa 10,8-78,3% der unfruchtbaren Frauen in China aus (27, 28). Der Eileiterfaktor umfasst hauptsächlich den Verschluss der Eileiter und eine peritoneale Pathologie, die zu Verwachsungen führt, die durch Hysterosalpingographie und Laparoskopie diagnostiziert werden. Die häufigste Ursache der Eileiterunfruchtbarkeit wurde auf eine entzündliche Erkrankung des Beckens (PID), Salpingitis und Endometriose zurückgeführt (29). In den Patientengruppen dieser Studie ist der Eileiterfaktor die Hauptursache für die Unfruchtbarkeit und liegt zwischen 62,9 und 71,4 %, was höher ist als bei Frauen mit Unfruchtbarkeit in anderen Ländern und Regionen. Daher ist bei der Interpretation der Ergebnisse Vorsicht geboten.
Einschränkungen ergeben sich aus dem retrospektiven Charakter der Studie, und die Tatsache, dass die Daten von einem einzigen Zentrum stammen, schwächt die Allgemeingültigkeit unserer Beobachtungen. Weitere potenzielle Einschränkungen könnten darin bestehen, dass bei einigen Frauen mit verminderter Ovarialreserve ein Protokoll mit Nicht-GnRH-Analoga verwendet wurde und nicht bei Frauen mit normaler Ovarialreserve. Frische Zyklen, die keine Eizellen erbrachten, wurden in dieser Studie nicht berücksichtigt, z. B. Zyklen mit abgebrochener Stimulation der Eierstöcke.
Die Ergebnisse dieser Studie können neue Erkenntnisse für die Entwicklung von Behandlungsstrategien für Patientinnen mit niedriger Prognose liefern. Es wurde eine SWOT-Analyse durchgeführt, um das Management für Patientinnen mit schlechter Prognose in der Klinik zu unterstützen, die aus den POSEIDON-Berichten (1, 2, 4, 5) und den Daten dieser Studie abgeleitet wurde. Die Ansprechbarkeit der Antralfollikel auf Gonadotropin war in Gruppe 3 extrem höher als in den anderen Gruppen. In Anbetracht des erfreulichen CLBR-Ergebnisses in Gruppe 3 schlagen wir zur Erhöhung der Eizellausbeute vor, weitere Stimulationen der Eierstöcke zu versuchen, aber keine stärkere Stimulation der Eierstöcke durch eine übermäßige tägliche Gonadotropin-Dosis. Obwohl die Patientinnen in Gruppe 2 eine größere ovarielle Reserve sowie mehr Eizellen und Embryonen haben, war die CLBR niedriger als erwartet. Die Behandlungsstrategie für Gruppe 2 sollte eher auf die Verbesserung der Lebendgeburtenrate als auf die Erhöhung der Anzahl der entnommenen Eizellen ausgerichtet sein.
Schlussfolgerung
Im Einklang mit dem Verteilungsmuster der Oozyten- und Embryonenmenge nach Patientengruppen waren die CLBRs in der Reihenfolge vom höchsten zum niedrigsten Wert in Gruppe 1 (junge Frauen mit guter Ovarialreserve), Gruppe 3 (junge Frauen mit schlechter Ovarialreserve), Gruppe 2 (Frauen im fortgeschrittenen Alter mit guter Ovarialreserve) und schließlich Gruppe 4 (Frauen im fortgeschrittenen Alter mit schlechter Ovarialreserve).
Datenverfügbarkeit
Die Rohdaten, die die Schlussfolgerungen dieses Manuskripts untermauern, werden von den Autoren ohne unangemessene Vorbehalte jedem qualifizierten Forscher zur Verfügung gestellt.
Ethikerklärung
Die Studie wurde von der Ethikkommission für die klinische Anwendung der assistierten Reproduktionstechnologie beim Menschen des Northwest Women’s and Children’s Hospital genehmigt (Nr. 2018002). Die Ethikkommission, die diese Studie genehmigt hat, verzichtete auf die Einholung einer informierten Zustimmung. Die gesamte Forschung wurde in Übereinstimmung mit den einschlägigen Richtlinien und Vorschriften durchgeführt.
Beiträge der Autoren
WS und JS haben die Studie konzipiert und entworfen. WS und WZ verfassten und überarbeiteten das Manuskript. WS, ZZ und WZ analysierten und interpretierten die Daten. LT, ZZ und HZ sammelten und bereinigten die Daten. Alle Autoren haben die endgültige Version des Manuskripts gelesen und genehmigt.
Finanzierung
Die Studie wurde von General Projects of Social Development in Shaanxi Province (No. 2018SF-247) und Personnel Training Program of Northwest women and children’s Hospital (2018ZD02) finanziert.
Erklärung zu Interessenkonflikten
Die Autoren erklären, dass die Forschung in Abwesenheit jeglicher kommerzieller oder finanzieller Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Danksagungen
Wir danken allen Klinikern, Wissenschaftlern und Embryologen im Northwest Women and Children’s Hospital für ihre Unterstützung bei der Datenerhebung und allen Patienten für ihren Beitrag zu dieser Studie. Wir danken Dr. Xinglin Chen vom Department of Epidemiology and Biostatistics, X&Y solutions Inc. in Boston für ihren Beitrag zur statistischen Unterstützung.
1. Alviggi C, Andersen CY, Buehler K, Conforti A, De Placido G, Esteves SC, et al. A new more detailed stratification of low responders to ovarian stimulation: from a poor ovarian response to a low prognosis concept. Fertil Steril. (2016) 105:1452-3. doi: 10.1016/j.fertnstert.2016.02.005
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Humaidan P, Alviggi C, Fischer R, Esteves SC. Die neue POSEIDON-Stratifizierung von „Patienten mit niedriger Prognose bei assistierter Reproduktionstechnologie“ und der vorgeschlagene Marker für ein erfolgreiches Ergebnis. F1000Res. (2016) 5:2911. doi: 10.12688/f1000research.10382.1
CrossRef Full Text | Google Scholar
3. Ferraretti AP, La Marca A, Fauser BC, Tarlatzis B, Nargund G, Gianaroli L, et al. ESHRE consensus on the definition of ‚poor response‘ to ovarian stimulation for in vitro fertilization: the Bologna criteria. Hum Reprod. (2011) 26:1616-24. doi: 10.1093/humrep/der092
PubMed Abstract |Ref Full Text | Google Scholar
4. Esteves SC, Roque M, Bedoschi GM, Conforti A, Humaidan P, Alviggi C. Definition von Patienten mit niedriger Prognose, die sich einer assistierten Reproduktionstechnologie unterziehen: POSEIDON-Kriterien – das Warum. Front Endocrinol. (2018) 9:461. doi: 10.3389/fendo.2018.00461
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Shi W, Zhang S, Zhao W, Xia X, Wang M, Wang H, et al. Faktoren im Zusammenhang mit der klinischen Schwangerschaft nach vitrifiziertem, erwärmtem Embryotransfer: eine retrospektive und multivariate logistische Regressionsanalyse von 2313 Transferzyklen. Hum Reprod. (2013) 28:1768-75. doi: 10.1093/humrep/det094
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Polyzos NP, Drakopoulos P, Parra J, Pellicer A, Santos-Ribeiro S, Tournaye H, et al. Cumulative live birth rates according to the number of oocytes retrieved after the first ovarian stimulation for in vitro fertilization/intracytoplasmic sperm injection: a multicenter multinational analysis including approximately 15,000 women. Fertil Steril. (2018) 110:661-70 e1. doi: 10.1016/j.fertnstert.2018.04.039
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Zhou J, Wang B, Hu Y, Sun H. Zusammenhang zwischen der Anzahl der entnommenen Eizellen und der kumulativen Lebendgeburtenrate bei Frauen im Alter von 35-40 Jahren, die sich langen GnRH-Agonisten IVF/ICSI-Zyklen unterziehen. Arch Gynecol Obstet. (2017) 296:1005-12. doi: 10.1007/s00404-017-4503-9
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Malchau SS, Henningsen AA, Forman J, Loft A, Nyboe Andersen A, Pinborg A. Cumulative live birth rate prognosis based on the number of aspirated oocytes in previous ART cycles. Hum Reprod. (2019) 34:171-80. doi: 10.1093/humrep/dey341
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Devesa M, Tur R, Rodriguez I, Coroleu B, Martinez F, Polyzos NP. Kumulative Lebendgeburtsraten und Anzahl der entnommenen Eizellen bei Frauen im fortgeschrittenen Alter. Eine Analyse an einem einzigen Zentrum mit 4500 Frauen im Alter von >/ = 38 Jahren. Hum Reprod. (2018) 33:2010-17. doi: 10.1093/humrep/dey295
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Chang Y, Li J, Li X, Liu H, Liang X. Egg quality and pregnancy outcome in young infertile women with diminished ovarian reserve. Med Sci Monit. (2018) 24:7279-84. doi: 10.12659/MSM.910410
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Bishop LA, Richter KS, Patounakis G, Andriani L, Moon K, Devine K. Diminished ovarian reserve as measured by means of baseline follicle-stimulating hormone and antral follicle count is not associated with pregnancy loss in younger in vitro fertilization patients. Fertil Steril. (2017) 108:980-7. doi: 10.1016/j.fertnstert.2017.09.011
CrossRef Full Text | Google Scholar
17. Igarashi H, Takahashi T, Nagase S. Oocyte aging underlies female reproductive aging: biological mechanisms and therapeutic strategies. Reprod Med Biol. (2015) 14:159-69. doi: 10.1007/s12522-015-0209-5
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Babariya D, Fragouli E, Alfarawati S, Spath K, Wells D. The incidence and origin of segmental aneuploidy in human oocytes and preimplantation embryos. Hum Reprod. (2017) 32:2549-60. doi: 10.1093/humrep/dex324
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Zeng M, Su S, Li L. Comparison of pregnancy outcomes after vitrification at the cleavage and blastocyst stage: a meta-analysis. J Assist Reprod Genet. (2018) 35:127-34. doi: 10.1007/s10815-017-1040-1
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Lin LT, Vitale SG, Chen SN, Wen ZH, Tsai HW, Chern CU, et al. Luteal phase ovarian stimulation may improve oocyte retrieval and oocyte quality in poor ovarian responders undergoing in vitro fertilization: preliminary results from a single-center prospective pilot study. Adv Ther. (2018) 35:847-56. doi: 10.1007/s12325-018-0713-1
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Narkwichean A, Maalouf W, Baumgarten M, Polanski L, Raine-Fenning N, Campbell B, et al. Efficacy of dehydroepiandrosterone (DHEA) to overcome the effect of ovarian ageing (DITTO): a proof of principle double blinded randomized placebo controlled trial. Eur J Obstet Gynecol Reprod Biol. (2017) 218:39-48. doi: 10.1016/j.ejogrb.2017.09.006
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Grynberg M, Labrosse J. Understanding follicular output rate (FORT) and its implications for POSEIDON criteria. Front Endocrinol. (2019) 10:246. doi: 10.3389/fendo.2019.00246
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Hou LY. Epidemiologische Studie über Unfruchtbarkeit in drei Provinzen Chinas. Phd Thesis, Graduate School of Peking Union Medical College, Beijing, China (2011).
Google Scholar
28. Zhu Hui-li HW. Epidemiologie und Ätiologie der oviduktalen Unfruchtbarkeit. J Int Reprod Health/Family Plann. (2016) 35:212-216.
Google Scholar