INTRODUCTION
Heterozygote familiäre Hypercholesterinämie (FH) ist eine häufige genetische Störung, die mit vorzeitigen atherosklerotischen Herz-Kreislauf-Erkrankungen (ASCVD) einhergeht. Kinder mit unbehandelter FH haben ein erhöhtes Risiko für eine vorzeitige ASCVD nach dem 20. Lebensjahr.1 Die starke Erhöhung des Low-Density-Lipoprotein-Cholesterins (LDL-C) beginnt bereits im Fötus und führt zu einer anhaltenden Exposition der Arterienwand gegenüber LDL-C, was die Cholesterinablagerung und die Gefäßentzündung beschleunigt und den frühen Beginn der Atherosklerose, insbesondere in den Koronararterien und der Aorta, begünstigt.
Statine und andere lipidsenkende Therapien (LLTs) senken den LDL-C-Wert wirksam, sind bei Kindern und Jugendlichen sicher und stellen die Endothelfunktion in jungen Jahren wieder her.2-4 Kürzlich wurde ein universelles Screening von Kindern ab 2 Jahren und vor dem 8. Lebensjahr vorgeschlagen5,6 , um behandlungsbedürftige Personen zu erkennen. Dieser Ansatz beruht jedoch auf theoretischen Überlegungen und hat sich in der Praxis nicht bewährt.
Allerdings ist wenig über die Merkmale von FH-Patienten unter 18 Jahren, den bei diesen Patienten angewandten LLT und die in der Praxis erreichten Lipidziele bekannt. Das Informationsdefizit ist bei den Follow-up-Daten noch größer. Nationale Register können diese entscheidenden Informationen liefern, die zur Verbesserung von Versorgungsmodellen für FH, therapeutischen Protokollen und der Gesundheitspolitik erforderlich sind.7,8 Die SpAnish Familial HypErcHolEsterolaemiA CohoRt STudy (SAFEHEART) (NCT02693548) wurde konzipiert, um einen besseren Einblick in die prognostischen Faktoren und Mechanismen zu gewinnen, die die Entwicklung von ASCVD und Mortalität in einer FH-Population beeinflussen.
Unser Ziel war es, die Patientencharakteristika zu analysieren und die LLT- und Lipidziele bei der Aufnahme und während der Nachbeobachtung von FH-Patienten unter 18 Jahren, die in SAFEHEART aufgenommen wurden, zu bewerten und die Faktoren zu bestimmen, die die Wahrscheinlichkeit des Erreichens dieser Ziele vorhersagen.
METHODSStudiendesign und Population
SAFEHEART ist eine offene, multizentrische, landesweite, langfristige prospektive Kohortenstudie in einer molekular definierten FH-Population in Spanien. Die Rekrutierung von Teilnehmern aus FH-Familien begann im Jahr 2004 und ist noch nicht abgeschlossen. Einschlusskriterien waren Indexfälle mit einer genetischen Diagnose von FH und ihre Verwandten, die älter als 15 Jahre sind und eine genetische Diagnose von FH haben, sowie ihre Verwandten ohne eine genetische Diagnose von FH (Kontrollgruppe). Dennoch wurden auch Teilnehmer unter 15 Jahren in die Studie aufgenommen, wenn ihre Eltern dies wünschten. Diese Studie wurde von den örtlichen Ethikkommissionen genehmigt. Alle in Frage kommenden Personen und/oder mindestens ein Elternteil oder Erziehungsberechtigter gaben eine schriftliche Einverständniserklärung ab. Ein Koordinierungszentrum mit Sitz in Madrid, Spanien, war für die Nachbetreuung der Teilnehmer verantwortlich. Die Patienten und/oder ihre Eltern wurden jährlich mit einem standardisierten Telefonanruf kontaktiert, um relevante Änderungen der Lebensgewohnheiten und der Medikamenteneinnahme sowie etwaige kardiovaskuläre Ereignisse oder andere medizinische Probleme zu erfassen. Die teilnehmenden Ärzte, die Patienten und Familien in dieses Register aufnahmen, wurden geschult und erhielten auf jährlichen Tagungen, an denen Ärzte mit Fachkenntnissen auf diesem Gebiet teilnahmen, verstärkte Leitlinien für bewährte Praktiken; außerdem wurden ein elektronisches Programm und eine telefonische Beratung eingesetzt, und ein webbasiertes Schulungsprogramm wurde eingesetzt, um das Management bei Bedarf weiter zu unterstützen. Die Behandlungsentscheidungen wurden ausschließlich vom Arzt des jeweiligen Patienten getroffen.
Klinische und Labormessungen
Demografische und klinische Merkmale wurden wie an anderer Stelle beschrieben erfasst.9 Venöse Blutproben wurden nach 12-stündigem Fasten entnommen. Serum-, Plasma- und DNA-Proben wurden aliquotiert und bei -80°C aufbewahrt. Das Gesamtcholesterin im Serum, die Triglyceride und das High-Density-Lipoprotein-Cholesterin (HDL-C) wurden in einem Zentrallabor mit enzymatischen Methoden gemessen. Die LDL-C-Konzentration im Serum wurde nach der Friedewald-Formel berechnet. Die DNA wurde mit Standardmethoden aus Vollblut isoliert, und FH wurde mit einem DNA-Microarray genetisch diagnostiziert.10 Die LDL-C-Ziele wurden entsprechend den jüngsten Empfehlungen und Zielsetzungen definiert. Low-Density-Lipoprotein-Cholesterin
mg/dL war das primäre Ziel.11 Ein alternatives Ziel für Patienten unter 14 Jahren bestand in LDL-C mg/dL bei Fehlen anderer kardiovaskulärer Risikofaktoren (Rauchen, HDL-C mg/dL, Lipoprotein (a) > 50mg/dL oder LDL-C > 250mg/dL) oder vorzeitiger kardiovaskulärer Erkrankung bei den Vorfahren oder Großeltern.6 Vorzeitige familiäre ASCVD wurde definiert als das Auftreten eines ersten Ereignisses vor dem 55. Lebensjahr bei Männern und vor dem 65. Lebensjahr bei Frauen.Klassifizierung der lipidsenkenden Therapie
Die maximale Statin-Dosis wurde definiert als Atorvastatin 40 bis 80mg/d oder Rosuvastatin 20 bis 40mg/d, die als hochintensive Statin-Dosen angesehen wurden. Die maximale Kombinationstherapie wurde definiert als maximale Statin-Dosis plus Ezetimib 10 mg/d. Als maximaler LLT wurde jeder LLT definiert, von dem erwartet wurde, dass er eine mindestens 50%ige Senkung der LDL-C-Basisspiegel bewirkt: Simvastatin 20, 40 oder 80 mg/d plus Ezetimib 10 mg/d; Pravastatin 40 mg/d in Kombination mit Ezetimib 10 mg/d; Fluvastatin 80 mg/d plus Ezetimib 10 mg/d; Atorvastatin 40 oder 80 mg/d mit oder ohne Ezetimib 10 mg/d; Atorvastatin 10 oder 20 mg/d plus Ezetimib 10 mg/d; Rosuvastatin 20 oder 40 mg/d mit oder ohne Ezetimib 10 mg/d; Rosuvastatin 10 mg/d plus Ezetimib 10 mg/d; und Pitavastatin 4 mg/d in Kombination mit Ezetimib 10 mg/d.12,13
Genetische Analyse
Mutationen des Low-Density-Lipoprotein-Cholesterin-Rezeptors (LDLR) wurden entsprechend ihrer bekannten Auswirkungen auf die Funktion des LDL-Rezeptorproteins in Null-Mutationen (rezeptor-negativ) und Defekt-Mutationen (rezeptor-defekt) eingeteilt, wie dies bereits beschrieben wurde.14 Varianten, die zum vollständigen Fehlen oder zur Verkürzung des Proteins (Funktionsverlust) führen und durch In-vitro-Funktionsanalyse oder Computersimulationsanalyse nachgewiesen wurden, wurden als rezeptor-negativ eingestuft. Zu diesen Varianten gehörten die folgenden: a) Punktmutationen, die ein vorzeitiges Stoppcodon verursachen; b) Missense-Mutationen, die die fünfte cysteinreiche Wiederholung in der Ligandenbindungsdomäne des LDL-C-Rezeptorgens betreffen (Klasse-2A-Mutation); c) kleine Deletionen oder Insertionen, die eine Rahmenverschiebung und ein vorzeitiges Stoppcodon verursachen; und d) große Umlagerungen. Bei den rezeptordefekten Mutationen handelte es sich um die übrigen Inframe-Punktmutationen sowie kleine Inframe-Deletionen und -Insertionen. Alle Mutationen, deren Funktionalität nicht durch In-vitro-Untersuchungen oder Computersimulationsanalysen nachgewiesen werden konnte, wurden als „unbekannte Funktionalität“ eingestuft, da wir nicht sicher sein konnten, ob die Auswirkung auf den Rezeptor negativ oder defekt war; sie wurden jedoch als pathogen betrachtet, da alle Personen, die eine dieser Mutationen trugen, eine Hypercholesterinämie aufwiesen, während die Verwandten ohne diese Mutation normale Cholesterinwerte hatten.14
Statistische Analyse
Die statistischen Analysen wurden mit SPSS Version 18.0 (SPSS Inc, Chicago, Illinois, Vereinigte Staaten) durchgeführt. Die Normalität der Verteilung der Variablen wurde mit dem Kolmogorov-Smirnov-Test analysiert. Quantitative Daten werden als Median und Interquartilsbereich (IQR) und qualitative Daten als absolute Zahl und Prozentsatz angegeben. Es wurden zwei Populationen definiert: die Population bei Studienbeginn (n = 241) und die Population bei der Nachbeobachtung (auch als Kohorte bezeichnet), zu der diejenigen Patienten gehörten, die bei der Nachbeobachtung ein vollständiges Plasmalipidprofil aufwiesen (n = 217). Alle Vergleiche zwischen Studienbeginn und Nachuntersuchung wurden in der Kohortenstudie durchgeführt. Vergleiche von Häufigkeiten zwischen qualitativen Variablen wurden mit dem Chi-Quadrat-Test durchgeführt. Veränderungen bei binären Variablen wurden mit dem McNemar-Test analysiert. Die Medianwerte quantitativer Variablen wurden mit dem nichtparametrischen Mann-Whitney-Test oder dem gepaarten Wilcoxon-Signed-Rank-Test verglichen. In der Kohortenstudie wurde eine binäre logistische Vorwärtsregressionsanalyse durchgeführt, um die mit der Statineinnahme assoziierten Variablen zu bestimmen. Wir berücksichtigten Variablen, die in univariaten Analysen statistisch signifikant waren, sowie a priori Prädiktoren und Confounder: Alter, Geschlecht und Nachsorge in einer primären/spezialisierten Einrichtung. Eine weitere binäre logistische Vorwärtsregressionsanalyse wurde in der Kohortenstudie durchgeführt, wobei die Patienten, die das Ziel bei Studienbeginn erreicht hatten, ausgeschlossen wurden, um die Variablen zu bestimmen, die mit dem Erreichen von LDL-C
mg/dL in Verbindung stehen. Wir haben Variablen einbezogen, die in univariaten Analysen statistisch signifikant waren, sowie a priori Prädiktoren und Störfaktoren: Alter, Geschlecht, Art der Mutation (null oder defekt), Verwendung von Ezetimib und Follow-up in einer primären/spezialisierten Einrichtung. Die Unterschiede wurden als statistisch signifikant angesehen, wenn das P-Ergebnis
bis heute wurden 4141 Teilnehmer in das SAFEHEART-Register aufgenommen; 392 sind jünger als 18 Jahre. Bei 241 von ihnen wurde FH auf molekularer Ebene bestätigt, bei 217 wurde ein vollständiges Lipidprofil erstellt (90,0 %) (Abbildung 1). Vierundzwanzig Patienten wurden aus der Analyse ausgeschlossen, weil sie bei der Nachbeobachtung kein vollständiges Lipidprofil aufwiesen. Bei 40 Patienten (18,4 %) fand die Nachbeobachtung in der Primärversorgung statt. Die mediane Nachbeobachtungszeit betrug 4,69 Jahre (IQR, 2,48-6,38 Jahre).
Schematisches Flussdiagramm der Studie. FH, familiäre Hypercholesterinämie.
Bei der Aufnahme in die Studie (die Population bei Studienbeginn) waren 129 FH-Patienten (53,5%) männlich. Das mittlere Alter betrug 15,0 Jahre (IQR, 14,0-16,0 Jahre). Die 2 jüngsten Patienten waren 8 Jahre alt. Bei keinem der Patienten lag eine ASCVD in der Vorgeschichte vor, und bei 40 (16,6 %) war eine vorzeitige familiäre ASCVD vorhanden. Die Ausgangscharakteristika sind in Tabelle 1 dargestellt. Tabelle 1 zeigt einen Vergleich der Ausgangscharakteristika zum Zeitpunkt des Einschlusses zwischen den Patienten der Kohorte und denjenigen, die nicht nachbeobachtet wurden. Es wurden keine signifikanten Unterschiede zwischen den beiden Gruppen festgestellt. Kein Patient hatte eine Vorgeschichte von ASCVD, Bluthochdruck oder Diabetes mellitus. Ein höherer Anteil der Gruppe ohne Nachsorge wurde in der Primärversorgung betreut, obwohl der Unterschied statistisch nicht signifikant war. In der Kohorte kam es zu einer signifikanten Senkung der Plasmakonzentrationen von Gesamtcholesterin, LDL-C, Triglyceriden und Nicht-HDL-C; bei der Nachuntersuchung wurde auch ein signifikanter Anstieg des HDL-C beobachtet (Tabelle 2).
Baseline-Charakteristika der Population bei Studienbeginn
| FH-Patienten mit Follow-up Median (IQR)/Anzahl. (%) |
FH-Patienten ohne Nachuntersuchung Median (IQR)/Anzahl. (%) |
P | |
|---|---|---|---|
| Anzahl | 217 | 24 | |
| Geschlecht (männlich) | 117 (53,9%) | 12 (50%) | .72 |
| Alter, j | 15,0 (14,0-16,0) | 15,0 (13,0-15,8) | .06 |
| Vorzeitig bekannte ASCVD | 36 (16,6%) | 4 (16,7%) | 1.00 |
| Aktiver Tabakraucher | 13 (6,0%) | 2 (8,3%) | .65 |
| Xanthome | 1 (0,5%) | 0 (0,0%) | .99 |
| Hornhautbogen | 6 (2,8%) | 1 (4,2%) | .53 |
| BMI, kg/m2 | 21,09 (19,40-22,80) | 20,79 (17,80-22,70) | .64 |
| Taillenumfang, cm | 72,0 (66,0-78,0) | 72,0 (66,0-75,8) | .94 |
| Cholesterin insgesamt, mg/dL | 223,5 (194,0-262.3) | 217,5 (194,5-277,5) | .76 |
| LDL-C, mg/dL | 162,6 (133.0-195.8) | 153.9 (13.1-209.3) | .71 |
| HDL-C, mg/dL | 49.0 (42.8-55.0) | 48.5 (41.5-56.0) | .96 |
| TG, mg/dL | 62.0 (49.0-80.3) | 66.0 (42.1-82.3) | .90 |
| Nicht-HDL-C, mg/dL | 174.0 (145.8-210.9) | 167.0 (146.5-225.3) | .74 |
| Lp (a), mg/dL | 18.80 (7.00-48.50) | 13.45 (9.10-28.10) | .46 |
| Im Rahmen der Primärversorgung behandelt | 40 (22,9%) | 7 (46,7%) | .06 |
ASCVD, atherosklerotische kardiovaskuläre Erkrankung; BMI, Body Mass Index; FH, familiäre Hypercholesterinämie; HDL-C, High-Density-Lipoprotein-Cholesterin; LDL-C, Low-Density-Lipoprotein-Cholesterin; Lp (a), Lipoprotein (a); IQR, Interquartilsbereich; TG, Triglyceride.
Plasma-Lipid- und Lipoproteinkonzentrationen (Kohorte)
| Kohorte bei Eintritt | Kohorte bei Follow-Nachbeobachtung | P | |
|---|---|---|---|
| Gesamtcholesterin, mg/dL | 221.0 (194.0-260.2) | 203.0 (183.0-233.5) | .001 |
| LDL-C, mg/dL | 157,7 (132,8-194,5) | 138,0 (116,5-165.4) | .001 |
| HDL-C, mg/dL | 49,0 (43,0-55,0) | 50,0 (44,0-58.0) | .002 |
| TG, mg/dL | 62.0 (49.0-80.2) | 70.0 (54.5-91.0) | .004 |
| Nicht-HDL-C, mg/dL | 171,0 (145,8-209,2) | 154.0 (132,0-182,5) | .001 |
HDL-C, High-Density-Lipoprotein-Cholesterin; LDL-C, Low-Density-Lipoprotein-Cholesterin; TG, Triglyceride.
Werte sind Median (Interquartilsbereich).
Funktionelle Mutationen
Wir identifizierten 212 Patienten mit einer Mutation in LDL-C-Rezeptorgenen (97,7 %) und 5 Patienten mit einer Mutation in Apolipoprotein-B-Genen (2,3 %). Von den Mutationen in den LDL-C-Rezeptorgenen wurden 95 (43,8 %) als Null-Mutationen, 92 (42,4 %) als defekte Mutationen und 25 (11,5 %) als Mutationen mit unbekannter Funktionalität eingestuft.
Lipidsenkende Therapie und Zielerreichung
Tabelle 3 zeigt die Verwendung verschiedener LLT-Schemata zu Beginn und bei der Nachbeobachtung. Die Ergebnisse zeigen einen signifikanten Anstieg der Verwendung von Statinen (44,2 % bei Studienbeginn und 68,2 % bei der Nachbeobachtung), Ezetimib (8,7 % bei Studienbeginn und 15,2 % bei der Nachbeobachtung), der maximalen Statindosis (3,3 % bei Studienbeginn und 13,9 % bei der Nachbeobachtung) und des maximalen LLT (7,9 % bei Studienbeginn und 23,6 % bei der Nachbeobachtung). Das am häufigsten verordnete Statin bei Studienbeginn (25,3%) und bei der Nachuntersuchung (30.5%) war Atorvastatin. Die Verschreibung von Rosuvastatin nahm zu (von 6,0 % bei der Aufnahme auf 20,3 % bei der Nachuntersuchung). Die mediane Dauer der Statintherapie betrug 7,0 Jahre (5,0 bis 9,0 Jahre). Das Alter bei der Menarche betrug 12,0 Jahre (12,0 bis 13,0 Jahre) bei Mädchen, die mit Statinen behandelt wurden, und 12,0 Jahre (11,0 bis 13,0 Jahre) bei Mädchen, die nicht mit Statinen behandelt wurden (P = .77). Es wurde kein Anstieg der hepatischen Transaminasen oder der Kreatinphosphokinase beobachtet. Fibrate und Gallensäuresequestratoren wurden nur bei 15 Patienten bei der Aufnahme (7,0 %) und 3 Patienten bei der Nachuntersuchung (1,5 %) eingesetzt. Eine Ezetimib-Monotherapie ohne Statin wurde bei 18 Patienten bei Studienbeginn (8,3 %) und bei 24 Patienten bei der Nachuntersuchung (11,1 %) eingesetzt. Was die Therapietreue betrifft, so gaben 10 Patienten (4,6 %) an, dass sie während der Nachbeobachtung an mindestens einem Tag im Monat keine Medikamente einnahmen. Bei der multivariablen Analyse war keine Variable unabhängig mit der Statineinnahme verbunden.
Lipidsenkende Therapien und Erreichen des LDL-C-Ziels (Kohorte)
| Bei Eintritt/Folge- | Bei Eintritt/Nachuntersuchung+ | Bei Eintritt+Nachuntersuchung- | Bei Eintritt+Nachuntersuchung+ | P | |
|---|---|---|---|---|---|
| Patienten mit Statinen | 60 (27.6%) | 61 (28.1%) | 9 (4.1%) | 87 (40.1%) | .001 |
| Patienten mit maximaler Statindosis | 186 (85.7%) | 24 (11.1%) | 1 (0.5%) | 6 (2.8%) | .001 |
| Patienten mit Ezetimib | 177 (81.6%) | 21 (9.7%) | 7 (3,2%) | 12 (5,5%) | .013 |
| Patienten unter maximaler Kombinationstherapie | 211 (97,2%) | 6 (2,8%) | 0 (0.0%) | 0 (0,0%) | N/A |
| Patienten unter maximaler LLT | 163 (75,1%) | 37 (17,1%) | 3 (1,4%) | 14 (6,5%) | .001 |
| LDL-C | 111 (51,2%) | 62 (28,6%) | 16 (7.4%) | 28 (12.9%) | .001 |
| LDL-C | 44 (20.3%) | 64 (29.5%) | 19 (8,8%) | 90 (41,5%) | .001 |
LDL-C, Low-Density-Lipoprotein-Cholesterin; LLT, lipidsenkende Therapie.
Werte sind n (%). – = nicht vorhanden; + = vorhanden.
Siehe Text für LLT-Klassifizierung.
Die LDL-C-Konzentration im Plasma sank um durchschnittlich 12,5 % und erreichte bei der Nachuntersuchung einen Medianwert von 138,0 mg/dL. Die Zielwerte für das Low-Density-Lipoprotein-Cholesterin, wie sie in den jüngsten internationalen Empfehlungen für FH definiert sind, wurden bei Studienbeginn von 20,3 % und bei der Nachuntersuchung von 41,5 % erreicht (Tabelle 3 und Abbildung 2). Wenn ein alternatives Ziel von LDL-C
mg/dL für Patienten unter 14 Jahren in Betracht gezogen wurde, erreichten 8 von 48 Patienten (16,7 %) und 1 von 6 Patienten (16,7 %) das Ziel bei der Aufnahme bzw. bei der Nachuntersuchung. Die einzige Variable, die in der multivariablen Analyse unabhängig mit dem Erreichen des LDL-C-Ziels assoziiert war, war die Einnahme von Statinen (Odds Ratio, 13,83; 95% Konfidenzintervall, 2,98-64,15). Die Art des Gesundheitsdienstleisters (Facharzt oder Hausarzt), das Alter, das Geschlecht, der Lipoprotein(a)-Wert und die Art der Mutation waren nicht mit dem Erreichen des LDL-C-Ziels assoziiert.
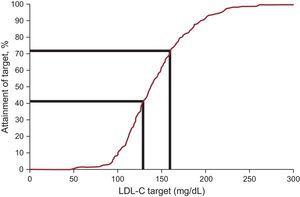
Behandlungsziele bei Patienten mit familiärer Hypercholesterinämie, die jünger als 18 Jahre sind: Anteil der Patienten, die das LDL-C-Ziel erreichen. LDL-C, Low-Density-Lipoprotein-Cholesterin.
DISKUSSION
In dieser Studie berichten wir über die Charakteristika, den Einsatz von LLT und die Erreichung des LDL-C-Ziels in einer longitudinalen Kohorte von molekular definierten FH-Patienten, die jünger als 18 Jahre sind und in das SAFEHEART-Register aufgenommen wurden. Dieses einzigartige Register für FH-Patienten basiert auf Daten, die in Spanien sowohl in spezialisierten Einrichtungen als auch in der Primärversorgung aus dem wirklichen Leben gewonnen wurden. Unsere Ergebnisse zeigen, dass ein LDL-C-Behandlungsziel
mg/dL nur von 20,3 % der Patienten bei der Aufnahme und von 41,5 % bei der Nachuntersuchung erreicht wurde, wobei 68,2 % der Patienten einen LLT erhielten. Die Einnahme von Statinen war der einzige Faktor, der unabhängig mit dem Erreichen des LDL-C-Ziels verbunden war. Soweit uns bekannt ist, wurde in keiner anderen Arbeit die Zielerreichung bei FH-Patienten unter 18 Jahren nachgewiesen, und diese Studie ist die erste, die darüber in einer großen Population berichtet.
Kürzlich analysierte ein britisches Register15 207 Kinder mit FH, identifizierte Mutationen bei 64 % der Kinder und stellte fest, dass 48 % der Kinder einen LLT erhielten; der LDL-C-Wert wurde um 35 % gesenkt. Die Autoren meldeten jedoch keine Ergebnisse zur Zielerreichung. Ein anderer Bericht, der eine kleine Stichprobe (n = 89) analysierte, ergab eine 43%ige LDL-C-Reduktion bei langfristiger Nachbeobachtung.16 Diese stärkere Reduktion ist wahrscheinlich auf eine häufigere Anwendung der Kombinationstherapie (56%) zurückzuführen. Es wurden keine Ergebnisse zum Erreichen von Zielen gezeigt. In einem anderen retrospektiven Artikel über 207 Patienten in den Niederlanden wurden nur 26 % der Patienten mit LLT behandelt, und auch hier wurden keine Ergebnisse hinsichtlich der Erreichung des LDL-C-Ziels berichtet.17
Diese Längsschnittstudie zeigte, dass sich die LDL-C-Werte bei FH-Patienten unter 18 Jahren im Laufe der Zeit aufgrund der Änderung der LLT und der ärztlichen Aufklärung verändern können. Der Anteil der Patienten, die Statine einnahmen, die maximale Statindosis und der maximale LLT stiegen während der Nachbeobachtung deutlich an. Interessanterweise deuten unsere Daten darauf hin, dass unsere Kohorte nicht verzerrt ist, da es keine statistisch signifikanten Unterschiede zwischen den Patienten, die nicht weiterverfolgt wurden, und der Kohorte gab.
Eine frühzeitige Diagnose und Behandlung von FH ist besonders bei Kindern und Jugendlichen wichtig, um die Entwicklung von ASCVD im Erwachsenenalter zu verhindern. Ein Screening auf FH bei Kindern ist lohnenswert und muss vor dem Alter von 8 Jahren durchgeführt werden, da Kinder mit Hypercholesterinämie ein erhöhtes Risiko für vorzeitige ASCVD aufweisen. Darüber hinaus können durch das Screening diejenigen mit dem höchsten Risiko identifiziert und eine LLT eingeleitet werden, die den atherosklerotischen Prozess nachweislich wirksam umkehren und das ASCVD-Risiko verringern kann. Kinder mit FH haben in der Regel keine klinische ASCVD. Dennoch spricht das Vorhandensein eines zukünftigen Risikos für den Einsatz von LLT, wobei Statine der Eckpfeiler der FH-Behandlung sind.18
Die Sicherheit und Verträglichkeit von LLT bei pädiatrischer FH sind stets umstritten, obwohl sie Berichten zufolge ähnlich wie bei Erwachsenen sind.5,19,20 Kürzlich berichteten Ramaswami et al.15 über keine Sicherheitsbedenken, ähnlich wie unsere Ergebnisse. Dennoch wird eine strenge Überwachung empfohlen, insbesondere bei Patienten, die höhere Statin-Dosen erhalten. Heranwachsende Mädchen sollten auch dazu angehalten werden, die Statintherapie auszusetzen, wenn sie eine Schwangerschaft in Betracht ziehen. Obwohl mehr Daten zu Sicherheitsaspekten bei Kindern unter Langzeitbehandlung mit LLT erforderlich sind, haben neuere Arbeiten zur langfristigen Nachbeobachtung ein ausgezeichnetes Sicherheitsprofil gezeigt.21 Dieses Ergebnis wird indirekt durch unsere Daten gestützt, da ein hoher Anteil der Patienten während der Nachbeobachtung eine LLT-Therapie begann und es nur wenige Abbrüche gab. Unsere Ergebnisse zeigen deutlich, dass ein höherer Prozentsatz der Patienten Statine, eine hohe Statindosis und eine maximale LLT einnimmt, wobei der Anteil der Patienten, die die Medikation abbrechen, gering ist. Diese Daten bestätigen die Sicherheit, Adhärenz und Verträglichkeit von Statinen, selbst bei hoher Dosierung, bei FH-Patienten unter 18 Jahren.22 Darüber hinaus stimmen unsere Ergebnisse mit früheren Berichten überein, die keine Auswirkungen auf die sexuelle Reifung zeigen.23 All diese Ergebnisse bestätigen das Konzept „je jünger, desto besser“ in Bezug auf das ideale Alter für die Einführung von Statinen bei diesen jungen FH-Patienten.23
Unsere Ergebnisse zeigen eine hohe Anzahl von FH-Patienten, die jünger als 18 Jahre sind, und deuten in Übereinstimmung mit früheren Studien15,16 auf die Bereitschaft erwachsener FH-Patienten hin, ihre unmittelbaren Familienangehörigen in Screening- und Registeraktivitäten einzubeziehen. Diese Tatsache spiegelt die Ernsthaftigkeit wider, mit der diese Patienten ihr Problem angehen, und die Auswirkungen, die der Rat ihrer Ärzte auf die Änderung ihres Lebensstils haben kann. Eine solche Einstellung bei erwachsenen Patienten bildet die Grundlage für einen gesunden Lebensstil bei ihren Angehörigen.24
Obwohl das gängigste Ziel für FH-Patienten unter 18 Jahren ein LDL-C-Wert unter 130mg/dL ist, kann bei Patienten unter 14 Jahren, die Nichtraucher sind, HDL-C ≥ 40mg/dL, Lipoprotein (a) mg/dL und LDL-C mg/dL aufweisen und keine vorzeitigen kardiovaskulären Erkrankungen bei den Vorfahren oder Großeltern haben, ein alternativer Ansatz verfolgt werden.6 Andere neuere Leitlinien empfehlen eine 50-prozentige Senkung des LDL-C-Wertes im Vergleich zu den Werten vor der Behandlung, aber für Kinder im Alter von ≥ 10 Jahren, insbesondere wenn zusätzliche kardiovaskuläre Risikofaktoren, einschließlich erhöhtem Lipoprotein (a), vorliegen, sollte das LDL-C-Ziel bei mg/dL liegen.11 Unsere Ergebnisse zeigen auch, wie schwierig es für diese Patienten ist, die Lipidziele zu erreichen.25 Außerdem war die Erreichung des LDL-C-Ziels ähnlich, unabhängig davon, ob die Patienten von Fachärzten oder Hausärzten behandelt wurden. Es ist also möglich, bei pädiatrischen Patienten mit FH in der hausärztlichen Versorgung ein Niveau zu erreichen, das mit dem der fachärztlichen Versorgung vergleichbar ist. Um dieses Ziel zu erreichen, ist es wichtig, die Unterstützung zu betonen, die Kliniker durch Register und spezielle Schulungsprogramme erhalten. Register können die Behandlung von FH-Patienten unter 18 Jahren optimieren, indem sie die Integration von primärer und fachärztlicher Versorgung ermöglichen, und sie können auch die Gesundheitsbehörden bei der Entscheidungsfindung unterstützen.8,26
Einschränkungen und Stärken
In dieser großen Follow-up-Studie von FH-Patienten unter 18 Jahren blieb die Intervention unverändert gegenüber derjenigen, die vom Arzt des Patienten durchgeführt wurde. Ein zuverlässiges Basis-Lipidprofil ist in diesem Register nicht vorhanden, da einige Patienten bereits behandelt wurden, als sie in die Studie aufgenommen wurden. Darüber hinaus könnten die Ergebnisse durch verschiedene Bedingungen wie unterschiedliche Lebensstile und eine Assoziation mit verschiedenen kardiovaskulären Risikofaktoren verändert worden sein.
ZUSAMMENFASSUNG
Die Daten des SAFEHEART-Registers zeigen, dass ein hoher Anteil der FH-Patienten unter 18 Jahren hohe LDL-C-Werte aufweist und die empfohlenen LDL-C-Ziele nicht erreicht. Wir fanden eine Zunahme der LLT-Intensität und einen signifikanten Rückgang der LDL-C-Werte während der Nachbeobachtung. Die Einnahme von Statinen war der einzige unabhängige Prädiktor für das Erreichen der LDL-C-Ziele. Außerdem wurden während der Nachbeobachtung keine Sicherheitsbedenken festgestellt. Diese Ergebnisse deuten darauf hin, dass viele FH-Patienten nicht ausreichend kontrolliert werden und dass es noch Raum für eine Verbesserung der Behandlung gibt. Darüber hinaus kann die Nachbeobachtung dieser FH-Population zum Wissen über die Sicherheit einer lebenslangen LLT und das optimale Alter für den Therapiebeginn beitragen, um die Entwicklung von ASCVD im Erwachsenenalter zu verhindern.
Finanzierung
Diese Arbeit wurde durch den Zuschuss G03/181 der Fundación Hipercolesterolemia Familiar, FIS PI12/01289 des Instituto de Salud Carlos III und den Zuschuss 08-2008 des Centro Nacional de Investigación Cardiovascular unterstützt.
INTERESSENSKONFLIKTE
Es wurden keine erklärt.
- –
Kinder mit unbehandelter heterozygoter familiärer Hypercholesterinämie haben ein erhöhtes Risiko, nach dem 20. Lebensjahr vorzeitig an ASCVD zu erkranken.
- –
Statine und andere lipidsenkende Therapien senken den LDL-C-Wert wirksam und sind bei Kindern und Jugendlichen sicher.
- –
Wenig ist bekannt über die Merkmale von FH-Patienten unter 18 Jahren, die bei diesen Patienten eingesetzten lipidsenkenden Therapien und die im wirklichen Leben erreichten Lipidziele.
- –
Dieses Informationsdefizit ist bei den Follow-up-Daten noch größer.
Was fügt diese Studie hinzu?
- –
Ein hoher Anteil der FH-Patienten, die jünger als 18 Jahre sind, erreicht die empfohlenen LDL-C-Ziele nicht.
- –
Wir fanden eine Zunahme der LLT-Intensität und einen signifikanten Rückgang der LDL-C-Werte während der Nachbeobachtung.
- –
Die Einnahme von Statin war der einzige unabhängige Prädiktor für das Erreichen der LDL-C-Ziele, und während der Nachbeobachtung wurden keine Sicherheitsbedenken festgestellt.
- –
Diese Ergebnisse bekräftigen das Konzept „je jünger, desto besser“.