Lernziele
- Beziehen Sie die Elektronenkonfigurationen der Elemente auf die Form des Periodensystems.
- Bestimmen Sie die erwartete Elektronenkonfiguration eines Elements anhand seines Platzes im Periodensystem.
In Kapitel 3 „Atome, Moleküle und Ionen“ haben wir das Periodensystem als ein Werkzeug zur Organisation der bekannten chemischen Elemente eingeführt. Ein Periodensystem ist in Abbildung 8.11 „Das Periodensystem“ dargestellt. Die Elemente sind nach ihrer Ordnungszahl (der Anzahl der Protonen im Kern) geordnet, und Elemente mit ähnlichen chemischen Eigenschaften sind in Spalten zusammengefasst.
Abbildung 8.11 Das Periodensystem
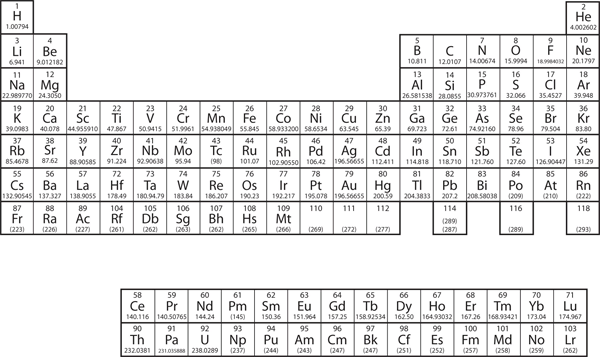
Warum ist das Periodensystem so aufgebaut wie es ist? Die Antwort ist recht einfach, wenn man die Elektronenkonfigurationen versteht: Die Form des Periodensystems ahmt die Füllung der Unterschalen mit Elektronen nach.
Beginnen wir mit H und He. Ihre Elektronenkonfigurationen sind 1s1 bzw. 1s2; bei He ist die n = 1-Schale gefüllt. Diese beiden Elemente bilden die erste Reihe des Periodensystems (siehe Abbildung 8.12 „Die 1“).
Abbildung 8.12 Die 1s-Unterschale
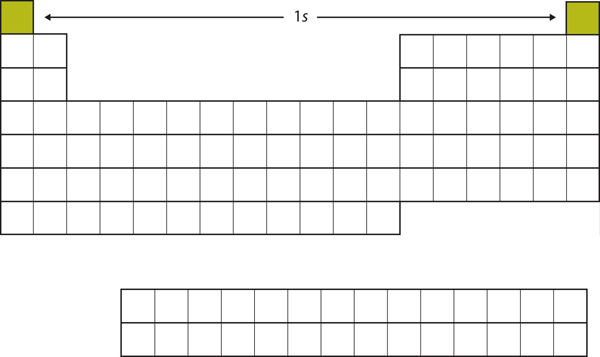
H und He stellen die Füllung der 1s-Unterschale dar.
Die nächsten beiden Elektronen würden bei Li und Be in die 2s-Unterschale gehen. Abbildung 8.13 „Die 2“ zeigt, dass diese beiden Elemente im Periodensystem nebeneinander liegen.
Abbildung 8.13 Die 2s-Unterschale
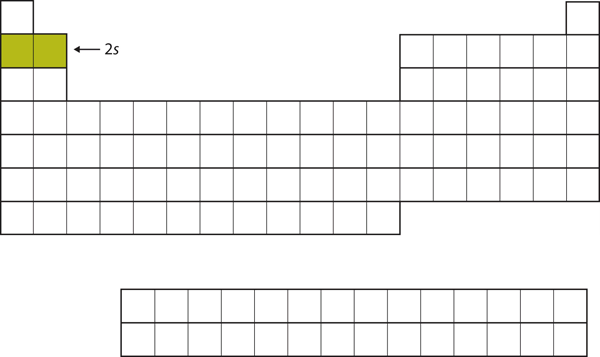
Bei Li und Be wird die 2s-Unterschale gefüllt.
Für die nächsten sechs Elemente wird die 2p-Unterschale mit Elektronen besetzt. Auf der rechten Seite des Periodensystems sind diese sechs Elemente (B bis Ne) zusammengefasst (Abbildung 8.14 „Die 2“).
Abbildung 8.14 Die 2p-Unterschale
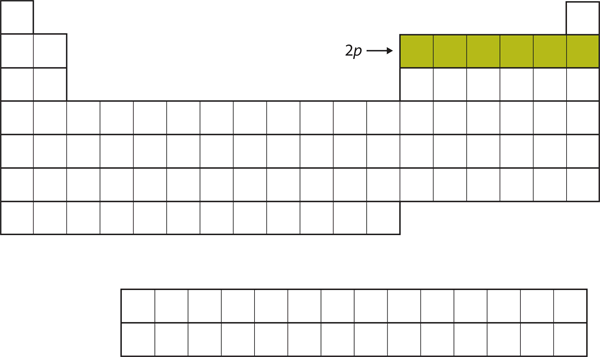
Für B bis Ne ist die 2p-Unterschale besetzt.
Die nächste zu besetzende Unterschale ist die 3s-Unterschale. Die Elemente, bei denen diese Unterschale besetzt ist, Na und Mg, befinden sich wieder auf der linken Seite des Periodensystems (Abbildung 8.15 „Die 3“).
Abbildung 8.15 Die 3s-Teilschale
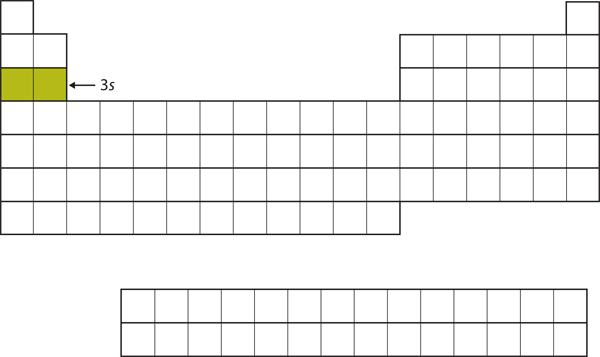
Jetzt wird die 3s-Teilschale besetzt.
Als nächstes wird die 3p-Teilschale mit den nächsten sechs Elementen gefüllt (Abbildung 8.16 „Die 3“).
Abbildung 8.16 Die 3p-Teilschale
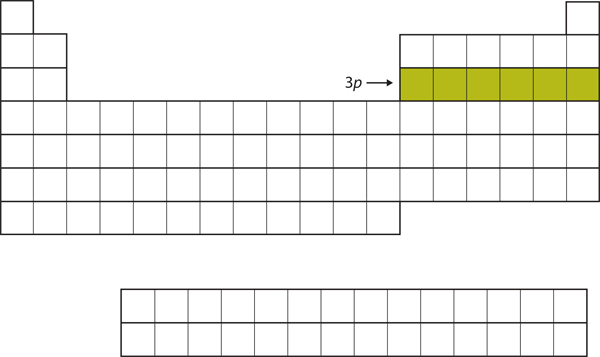
Als nächstes wird die 3p-Teilschale mit Elektronen gefüllt.
Anstatt die 3d-Teilschale als nächstes zu füllen, gehen die Elektronen in die 4s-Teilschale (Abbildung 8.17 „Die 4“).
Abbildung 8.17 Die 4s-Unterschale
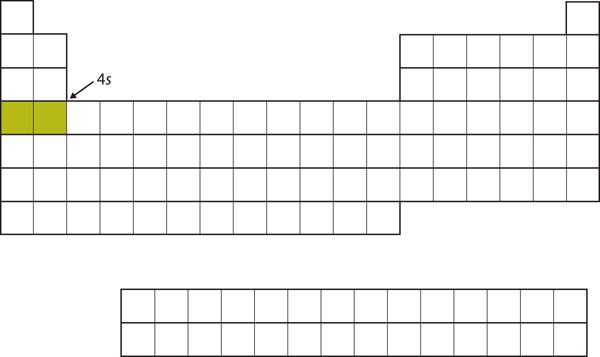
Die 4s-Unterschale wird vor der 3d-Unterschale gefüllt. Dies spiegelt sich in der Struktur des Periodensystems wider.
Nachdem die 4s-Unterschale gefüllt ist, wird die 3d-Unterschale mit bis zu 10 Elektronen gefüllt. Dies erklärt den Abschnitt von 10 Elementen in der Mitte des Periodensystems (Abbildung 8.18 „Die 3“).
Abbildung 8.18 Die 3d-Unterschale
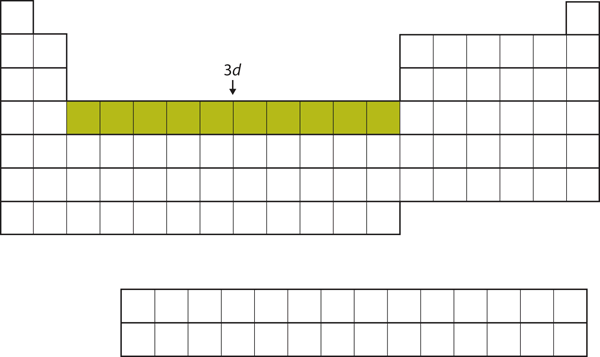
Die 3d-Unterschale ist im mittleren Abschnitt des Periodensystems gefüllt.
Und so weiter. Wenn wir durch die Zeilen des Periodensystems gehen, zeigt die Gesamtform der Tabelle, wie die Elektronen die Schalen und Unterschalen besetzen.
Die ersten beiden Spalten auf der linken Seite des Periodensystems sind die, in denen die s-Unterschalen besetzt werden. Aus diesem Grund werden die ersten beiden Zeilen des Periodensystems als s-Block bezeichnet. In ähnlicher Weise sind der p-Block die rechten sechs Spalten des Periodensystems, der d-Block die mittleren 10 Spalten des Periodensystems, während der f-Block der 14-spaltige Abschnitt ist, der normalerweise als vom Hauptteil des Periodensystems losgelöst dargestellt wird. Er könnte Teil des Hauptkörpers sein, aber dann wäre das Periodensystem ziemlich lang und unhandlich. Abbildung 8.19 „Blöcke im Periodensystem“ zeigt die Blöcke des Periodensystems.
Abbildung 8.19 Blöcke im Periodensystem
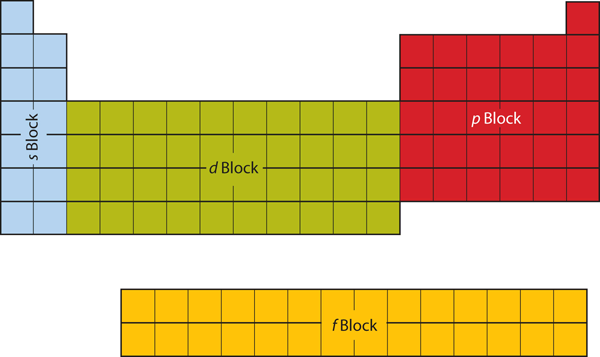
Das Periodensystem ist in Blöcke unterteilt, je nachdem, welche Unterschale für die Atome, die zu diesem Abschnitt gehören, gefüllt wird.
Die Elektronen in der höchsten Schale und alle Elektronen in der letzten nicht gefüllten Unterschale werden Valenzelektronen genannt; die höchste Schale wird Valenzschale genannt. (Die inneren Elektronen werden als Kernelektronen bezeichnet.) Die Valenzelektronen bestimmen weitgehend die Chemie eines Atoms. Wenn wir nur die Elektronenkonfiguration der Valenzschale betrachten, stellen wir fest, dass die Elektronenkonfiguration der Valenzschale in jeder Spalte gleich ist. Nehmen wir zum Beispiel die Elemente in der ersten Spalte des Periodensystems: H, Li, Na, K, Rb und Cs. Ihre Elektronenkonfigurationen (abgekürzt für die größeren Atome) sind wie folgt, wobei die Elektronenkonfiguration der Valenzschale hervorgehoben ist:
| H: | 1s1 |
| Li: | 1s22s1 |
| Na: | 3s1 |
| K: | 4s1 |
| Rb: | 5s1 |
| Cs: | 6s1 |
Sie alle haben eine ähnliche Elektronenkonfiguration in ihren Valenzschalen: ein einziges s-Elektron. Da ein großer Teil der Chemie eines Elements von den Valenzelektronen beeinflusst wird, würden wir erwarten, dass diese Elemente eine ähnliche Chemie aufweisen – und das tun sie auch. Die Anordnung der Elektronen in den Atomen erklärt nicht nur die Form des Periodensystems, sondern auch die Tatsache, dass Elemente in derselben Spalte des Periodensystems eine ähnliche Chemie aufweisen.
Das gleiche Konzept gilt für die anderen Spalten des Periodensystems. Die Elemente in jeder Spalte haben die gleiche Valenzschalen-Elektronenkonfiguration, und die Elemente haben einige ähnliche chemische Eigenschaften. Dies gilt grundsätzlich für alle Elemente in den Blöcken s und p. In den d- und f-Blöcken gibt es Ausnahmen von der Reihenfolge, in der die Unterschalen mit Elektronen gefüllt werden, so dass ähnliche Valenzschalen in diesen Blöcken nicht absolut sind. Allerdings gibt es in diesen Blöcken viele Ähnlichkeiten, so dass eine Ähnlichkeit der chemischen Eigenschaften zu erwarten ist.
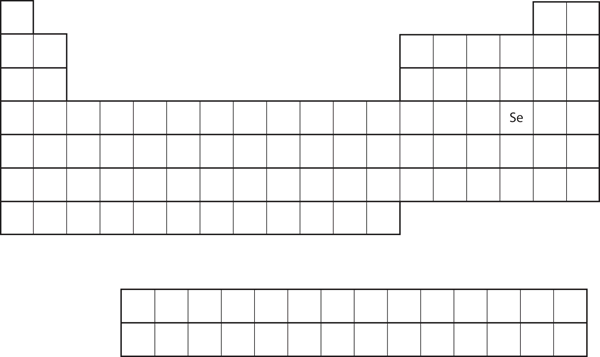
Die Ähnlichkeit der Elektronenkonfiguration der Valenzschalen impliziert, dass wir die Elektronenkonfiguration eines Atoms allein durch seine Position im Periodensystem bestimmen können. Nehmen wir Se, wie in Abbildung 8.20 „Selen im Periodensystem“ dargestellt. Es befindet sich in der vierten Spalte des p-Blocks. Das bedeutet, dass seine Elektronenkonfiguration auf eine p4-Elektronenkonfiguration hinauslaufen sollte. Tatsächlich ist die Elektronenkonfiguration von Se erwartungsgemäß 4s23d104p4.
Abbildung 8.20 Selen im Periodensystem
Beispiel 8
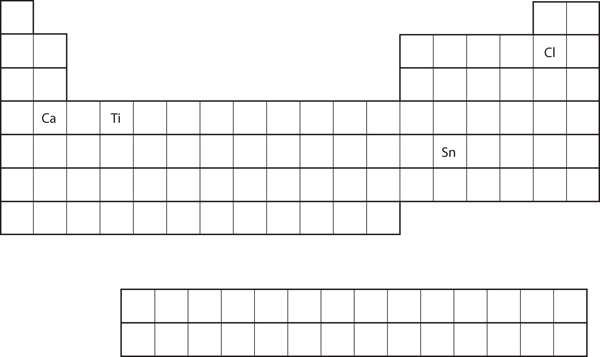
Aus der Position des Elements im Periodensystem ist die Elektronenkonfiguration der Valenzschale für jedes Atom vorherzusagen. Siehe Abbildung 8.21 „Verschiedene Elemente im Periodensystem“.
- Ca
- Sn
Lösung
- Ca befindet sich in der zweiten Spalte des s-Blocks. Wir würden erwarten, dass seine Elektronenkonfiguration mit s2 endet. Die Elektronenkonfiguration von Calcium ist 4s2.
- Sn befindet sich in der zweiten Spalte des p-Blocks, so dass wir erwarten, dass seine Elektronenkonfiguration auf p2 endet. Die Elektronenkonfiguration von Zinn ist 5s24d105p2.
Teste dich selbst
Ermitteln Sie anhand der Position des Elements im Periodensystem die Elektronenkonfiguration der Valenzschale für jedes Atom. Siehe Abbildung 8.21 „Verschiedene Elemente im Periodensystem“.
- Ti
- Cl
Antwort
- 4s23d2
- 3s23p5
Abbildung 8.21 Verschiedene Elemente im Periodensystem
Nahrungsmittel und Getränke App: Künstliche Farben
Die Farbe von Gegenständen entsteht durch einen anderen Mechanismus als die Farben von Neonlicht und anderen Entladungslampen. Obwohl farbige Lichter ihre Farben erzeugen, sind Gegenstände farbig, weil sie vorzugsweise eine bestimmte Farbe des weißen Lichts reflektieren, das auf sie scheint. Eine rote Tomate zum Beispiel ist leuchtend rot, weil sie rotes Licht reflektiert, während sie alle anderen Farben des Regenbogens absorbiert.
Viele Lebensmittel, wie z. B. Tomaten, sind stark gefärbt; in der Tat ist die gängige Aussage „man isst zuerst mit den Augen“ eine implizite Erkenntnis, dass die visuelle Attraktivität von Lebensmitteln genauso wichtig ist wie ihr Geschmack. Aber was ist mit verarbeiteten Lebensmitteln?
Vielen verarbeiteten Lebensmitteln werden Farbstoffe zugesetzt. Es gibt zwei Arten von Lebensmittelfarbstoffen: natürliche und künstliche. Zu den natürlichen Farbstoffen gehören karamellisierter Zucker für Braun; Annatto, Kurkuma und Safran für verschiedene Orange- oder Gelbtöne; Betanin aus Rüben für Violett; und sogar Karmin, ein tiefroter Farbstoff, der aus der Cochenille gewonnen wird, einem kleinen Insekt, das ein Parasit auf Kakteen in Mittel- und Südamerika ist. (Das ist richtig: Sie könnten Käfersaft essen!)
Einige Farbstoffe sind künstlich. In den Vereinigten Staaten lässt die Food and Drug Administration derzeit nur sieben Verbindungen als künstliche Farbstoffe in Lebensmitteln, Getränken und Kosmetika zu:
- FD&C Blue #1: Brilliant Blue FCF
- FD&C Blue #2: Indigotine
- FD&C Green #3: Fast Green FCF
- RD&C Rot #3: Erythrosin
- FD&C Rot #40: Allurarot AC
- FD&C Gelb #5: Tartrazin
- FD&C Gelb #6: Sunset Yellow FCF
Die Farbstoffe mit den niedrigeren Nummern sind nicht mehr auf dem Markt oder wurden aus verschiedenen Gründen entfernt. Bei diesen künstlichen Farbstoffen handelt es sich in der Regel um große Moleküle, die bestimmte Lichtfarben sehr stark absorbieren, so dass sie bereits in sehr geringen Konzentrationen in Lebensmitteln und Kosmetika verwendet werden. Selbst bei solch geringen Mengen behaupten einige Kritiker, dass ein kleiner Teil der Bevölkerung (vor allem Kinder) empfindlich auf künstliche Farbstoffe reagiert, und drängen darauf, ihre Verwendung einzuschränken oder zu stoppen. Formelle Studien über künstliche Farbstoffe und ihre Auswirkungen auf das Verhalten sind jedoch nicht schlüssig oder widersprüchlich. Trotzdem genießen die meisten Menschen weiterhin verarbeitete Lebensmittel mit künstlichen Farbstoffen (wie die in der nebenstehenden Abbildung gezeigten).

Künstliche Lebensmittelfarbstoffe sind in einer Vielzahl von Lebensmitteln enthalten, z. B. in verarbeiteten Lebensmitteln, Süßigkeiten und Eifarben. Sogar in Tierfutter sind künstliche Farbstoffe enthalten, obwohl es dem Tier wahrscheinlich egal ist!
Quelle: Foto mit freundlicher Genehmigung von Matthew Bland, http://www.flickr.com/photos/matthewbland/3111904731.
Key Takeaways
- Die Anordnung der Elektronen in den Atomen ist für die Form des Periodensystems verantwortlich.
- Elektronenkonfigurationen können anhand der Position eines Atoms im Periodensystem vorhergesagt werden.
Übungen
-
Wo im Periodensystem werden s Unterschalen von Elektronen besetzt?
-
Wo im Periodensystem sind die d-Unterschalen mit Elektronen besetzt?
-
In welchem Block befindet sich Ra?
-
In welchem Block befindet sich Br?
-
Wie lauten die Valenzelektronenkonfigurationen der Elemente in der zweiten Spalte des Periodensystems?
-
Wie lauten die Valenzelektronenschalen-Konfigurationen der Elemente in der vorletzten Spalte des Periodensystems?
-
Wie lauten die Valenzelektronenschalen-Konfigurationen der Elemente in der ersten Spalte des p-Blocks?
-
Wie lauten die Valenzelektronenkonfigurationen der Elemente in der letzten Spalte des p-Blocks?
-
Ermitteln Sie anhand der Position des Elements im Periodensystem die Elektronenkonfiguration der einzelnen Atome.
a) Sr
b) S
10. Bestimme die Elektronenkonfiguration der einzelnen Atome anhand der Position des Elements im Periodensystem.
a) Fe
b) Ba
11. Bestimme die Elektronenkonfiguration der einzelnen Atome anhand der Position des Elements im Periodensystem.
a) V
b) Ar
12. Bestimme die Elektronenkonfiguration der einzelnen Atome anhand der Position des Elements im Periodensystem.
a) Cl
b) K
13. Bestimme die Elektronenkonfiguration der einzelnen Atome anhand der Position des Elements im Periodensystem.
a) Ge
b) C
14. Berechne anhand der Position des Elements im Periodensystem die Elektronenkonfiguration der einzelnen Atome.
a) Mg
b) I
Antworten
die ersten beiden Spalten
der s-Block
ns27.
ns2np19.
a) 1s22s22p63s23p64s23d104p65s2
b) 1s22s22p63s23p411.
a) 1s22s22p63s23p64s23d3
b) 1s22s22p63s23p613.
a) 1s22s22p63s23p64s23d104p2
b) 1s22s22p2