Fallbericht
Eine Omentalmasse: Any Idea?
Mascianà G*, Gallo IF, Valeri S und Coppola R
Abteilung für Allgemeinchirurgie, Universität Campus Bio-Medico, Italien
*Korrespondierender Autor: Mascianà Gianluca, UniversitàCampus Bio-Medico, Via Alvaro delPortillo 21 – 00128 Rom, Italien
Veröffentlicht: 20 Jul, 2017
Zitiere diesen Artikel als: Mascianà G, Gallo IF, Valeri S, CoppolaR. An Omental Mass: Any Idea? AnnClin Case Rep. 2017; 2: 1406.
Abstract
Pseudomyxoma Extra Peritonei (PE) ist ein seltener Befund, die häufigste Ursache ist die Ruptur einer Mukozele des Blinddarms in das Retroperitoneum. Hier berichten wir über den Fall einer 52 Jahre alten Patientin mit einer Masse im rechten Abdomen und unklaren Unterbauchschmerzen, die sich der Resektion einer extraperitoneal abgekapselten Masse unterzog. Die histopathologische Untersuchung ergab ein muzinöses Pseudomyxom mit einem niedrigen Differenzierungsgrad. Wir berichten über einen Fall von Pseudomyxoma extraperitonei mit einem Überblick über die Literatur.
Falldarstellung
Eine 52-jährige Patientin wurde wegen einer Masse im rechten Abdomen und unklaren Unterbauchschmerzen in unsere Klinik überwiesen. Das einzige bemerkenswerte Ereignis in ihrer Vorgeschichte war ein Fibromneoplasma in der rechten Brust, das 10 Jahre zuvor entfernt worden war.
Untersuchungen
Bei der abdominalen Untersuchung zeigte sich eine große, festsitzende Masse in der rechten subcostalen Region. Es gab weder zervikale, axilläre oder inguinale Lymphadenopathien noch Anzeichen von Aszites. Andere Tests waren normal, mit Ausnahme eines leicht erhöhten CEA-Wertes (8,5 ng/ml; Normalwert: 0-2,5). Die Computertomographie (CT) des Brustkorbs und des Abdomens ergab eine rundliche, 100 mm x 70 mm x 80 mm große Masse in der rechten Flanke mit gleichmäßigen Rändern, einer partiellen Kapsel und einer 19 mm großen inneren Verkalkung mit Wandverkalkung und hyperdensen zentralen Streifen (Abbildung 1). Die US-geführte Aspiration der Masse ergab ein zelluläres Material. Die oberen und unteren endoskopischen Untersuchungen waren negativ.
Behandlung
Der Fall wurde in einer multidisziplinären Teamsitzung besprochen. Da es sich als schwierig erwies, eine präoperative Diagnose zu stellen, wurde der Patient operiert, wobei eine extraperitoneal abgekapselte Masse gefunden wurde, die frei von allen umgebenden Strukturen, einschließlich Bauchspeicheldrüse, Nieren und Darm, war. Diese Masse wurde vollständig reseziert, ohne die Kapsel zu durchbrechen. Die histopathologische Analyse ergab ein muzinöses Pseudomyxom mit niedrigem Differenzierungsgrad. Die Immunhistochemie war positiv für CK20 und CK7. Der Patient konnte 4 Tage nach der Operation ohne Komplikationen entlassen werden. Bei der Nachuntersuchung 3 Jahre später gab es keine Anzeichen eines Rezidivs.
Abbildung 1
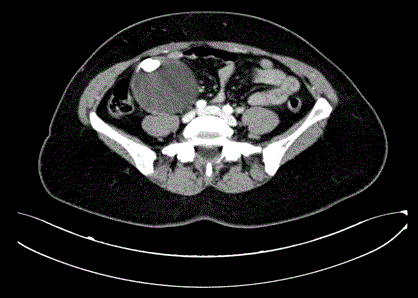
Abbildung 1
CT-Aufnahme des Abdomens und des Beckens, zeigt die Masse im rechten Unterleib.
Tabelle 1
Großer Titel
| Autor | Patient (Alter/Geschlecht) | Publikationsjahr | Primärtumor | Behandlung |
| Bonnan | 37 M | 1948 | Mukozele des Blinddarms | Evakuierung der Zyste in einem 2-stufigen Verfahren |
| Früh | 57 M | 1968 | Mukozele des Wurmfortsatzes | Entfernung des Tumors |
| Früh | 63 M | 1968 | Appendix | Exzision |
| Brady | 67 M | 1986 | Appendix | Chirurgisches Debulking retroperitoneale Chemotherapie |
| Moran | 58 M | 1988 | NA | Drainage, Appendektomie und erneute Drainage. Chemotherapie, Strahlentherapie Mukolytika, Radiofrequenz-Hyperthermie |
| Baker | 33 M | 1988 | Rectum | Debulking, Omentektomie |
| Snyder | 50 F | 1992 | Appendix | Exzision, Omentektomie, totale Hysterektomie und Oophorektomie |
| Fann | 47 M | 1993 | NA | Exzision |
| Radosavljevic | 41 M | 1993 | Appendix | Chemotherapie |
| Shelton | 81 M | 1994 | Muzinöses Zystadenom des Blinddarms | Debulking und Appendektomie |
| Tamai | 39 NA | 1995 | Adenokarzinom des Blinddarms | Hemikolektomie rechts, Resektion des rechten Iliopsoasmuskels, partielle Peritonektomie |
| Baba | NA | 1995 | Anhangsdrüsenschleimzystadenom | NA |
| Mor | 65 M | 1996 | Wurmfortsatzzystenkarzinom | Debulking und Appendektomie |
| Ben-Hur | 65 M | 1996 | Appendix | Exzision |
| Stevens | 56 M | 1997 | Appendizitis muzinöses Adenokarzinom | Entnahme, Strahlentherapie |
| Tsai | 69 M | 1998 | Adenom der Blinddarmschleimhaut | Entleerung |
| Matsuoka | 58 F | 1999 | Muzinöses Zystadenom (primär oder sekundär | NA |
| Koizumi | 46 M | 1999 | Adenokarzinom des Blinddarms | Hemikolektomie rechts |
| Edrees | 53 F | 1999 | Adenokarzinom des Blinddarms Adenokarzinom | Hemikolektomie rechts und systemische Chemotherapie |
| Peek | 38 M | 1999 | Appendix | Exzision, Chemotherapie |
| Koizumi | 53 M | 1999 | Anhang | NA |
| Al-Bozom | 75 M | 2000 | Anhang | Chemotherapie |
| Kojima | 78 F | 2001 | Appendixzystadenokarzinom | Rechte Hemikolektomie |
| Angelescu | NA M | 2001 | Schleimige paraenterische Zyste | NA |
| Liu | 68 F | 2001 | Muzinöses Adenokarzinom des Blinddarms | Appendektomie Debulking der Schleimhaut, intraoperative Chemotherapie, systemische Chemotherapie |
| Solkar | 57 M | 2004 | NA | Exzision der Zyste Strahlentherapie Chemotherapie |
| Hirokawa | 55 F | 2004 | Aufsteigender Dickdarmkrebs | Rechte Hemikolektomie Oophorektomie, Schleimhautentfernung. Systematische Chemotherapie A |
| Niwa | 80 F | 2007 | Schleimhaut-Adenokarzinom des Blinddarms | Resektion von Schleimhaut und Ileum, Zökum, beide Eierstöcke und Gebärmutter |
| Cakmak | 51 F | 2009 | Appendizitis muzinöses Adenokarzinom | En-Block-Resektion mit einem Teil des Darmbeins Appendektomie, systemische Chemo- und Strahlentherapie |
| Chamisa | 48 F | 2011 | Ovar | Debulking rechte Oophorektomie und Chemotherapie |
| Ioannidis | 74 M | 2012 | Adenokarzinom der Blinddarmschleimhaut | Debulking rechts Hemikolektomie Chemotherapie |
| Ioannidis | 68 F | 2012 | Adenokarzinom der Wurmfortsätze | Entbullen Hemikolektomie rechts Chemotherapie |
| Lim | 53 F | 2014 | Appendix | Totale abdominale Hysterektomie, bilaterale Salpingo-Oophorektomie, Omentektomie, Appendektomie und nicht optimales Debulking |
| Mavrodin | 56 F | 2014 | Appendix | Appendektomie, totale Hysterektomie mit Adnexektomie rechts, Omentektomie |
| Spyropoulos | 70 F | 2014 | Appendix | Rechte Hemikolektomie |
| 84 M | 2014 | NA | Inspektiert und abgetastet ohne Erkennung des Blinddarms | |
| Joo | 80 F | 2015 | Ovar | Bilaterale Salpingooophorektomie mit massiver Adhäsiolyse und Entfernung einer Masse im Retroperitonealraum |
| Martins | 66 F | 2015 | Appendix | Peritoneallavage, Hysterektomie, bilaterale Salpingo-Oophorektomie, Omentektomie und Appendektomie |
Tabelle 1: 37 berichtete Fälle Blinddarm.
Tabelle 1
37 gemeldete Fälle Blinddarm.
Abbildung 2
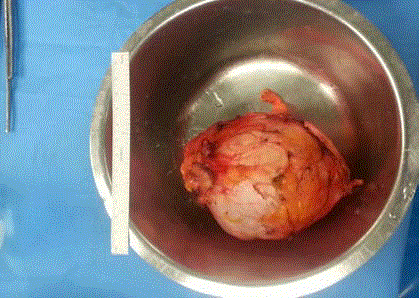
Abbildung 2
Chirurgisches Präparat.
Diskussion
Werth beschrieb das Pseudomyxoma peritonei erstmals 1884 als Vorhandensein von schleimigem und gallertartigem Material in der Bauchhöhle. Im Jahr 1948 berichtete Bonann über ein Pseudomyxom, das nur das Retroperitoneum betraf und 1950 von Coppini dargestellt wurde. Zwanzig Jahre später beschrieb Early eine retroperitoneale Mukozele des Wurmfortsatzes, die 10 Liter Schleim enthielt und nicht geplatzt war, so dass eine vollständige kurative Exzision durchgeführt werden konnte; dies wurde 1988 von Moran als Pseudomyxoma extra peritonei (PE) bezeichnet. Shelton et al. nannten es später Pseudomyxoma retroperitonei. Das Pseudomyxomaretroperitoneal ist eine seltene Erkrankung, von der in der Literatur nur 37 Fälle beschrieben sind; die häufigste Ursache ist die Ruptur einer Amukozele des Wurmfortsatzes in das Retroperitoneum (Tabelle 1). Sie betrifft beide Geschlechter in gleichem Maße und tritt vor allem nach dem 60. Lebensjahr auf, wobei auch ein Schleimneoplasma des Eierstocks oder des Darms oder ein primäres retroperitoneales schleimiges Zystadenom/Zystadenkarzinom als primäre Ursache in Frage kommen; bei der histopathologischen Analyse finden sich Aggregate aus Schleim- und Epithelzellen mit unterschiedlichem Atypie- und Differenzierungsgrad. Die Zellen sind im Allgemeinen positiv für CK20 und negativ für CK7. Das Pseudomyxom kann als Grad I oder gutartige disseminierte Peritonealadenomukinose, als Grad II oder intermediärer Subtyp und als Grad III oder bösartige schleimige Peritonealkarzinose klassifiziert werden. In der Mehrzahl der Fälle wird die Pathogenese des Pseudomyxoma retroperitonei durch ein Leck im Peritoneum erklärt (retroperitoneale Darstellung in Verbindung mit einem intraperitonealen Pseudomyxom). Liegt kein peritoneales Pseudomyxom vor, kann eine Variante der Anatomie des Wurmfortsatzes (retroperitoneale Lage) das extraperitoneale Pseudomyxom erklären, obwohl diese Hypothese noch spekulativ ist. Eine präoperative Diagnose ist sehr selten; Symptome wie Müdigkeit, verminderter Appetit mit Gewichtsverlust, das Vorhandensein einer tastbaren Masse und langsam fortschreitende abdominelle oder lumbale Schmerzen sind häufig. CEA und CA 19.9 sind Berichten zufolge bei 56% – 75% bzw. 58% – 67% der Patienten erhöht. Ultraschall kann die Schleimhaut als retroperitoneale Flüssigkeit nachweisen und durch Nadelaspiration zur Diagnose beitragen, während CT mit intravenösem, oralem und rektalem Kontrastmittel die schleimige Substanz durch Analyse der Dichteeigenschaften (5-20 Hounsfield-Einheiten für Schleim gegenüber 0 Hounsfield-Einheiten für Wasser) von der normalen wässrigen Flüssigkeit unterscheiden kann. In der CT erscheint Pseudomyxomaretroperitonei als eine Masse, die oft multizystisch ist, Septen oder dicke Wände hat und durch Wandverkalkungen gekennzeichnet sein kann, die benachbarte Strukturen verdrängen. ChirurgieDie Behandlung von Pseudomyxomen unterscheidet sich erheblich, je nachdem, ob sie intraperitoneal oder extraperitoneal auftreten. Für intraperitoneale Pseudomyxome empfahlen Sugarbaker et al. ein aggressives, komplexes chirurgisches Verfahren, das die Exstirpation des muzinösen Materials, die Entfernung des Peritoneums und die Peritonektomie umfasst, um so viel makroskopische Krankheit wie möglich zu entfernen (zytoreduktive Chirurgie, CRS), wobei eine erhitzte intraperitoneale hyperthermische Chemotherapie (HIPEC) eingesetzt wird.Im Gegensatz dazu besteht die empfohlene Behandlung für extraperitoneale Pseudomyxome, wie bei gutartigen Erkrankungen, in der Resektion des Entstehungsortes, manchmal gefolgt von einer systematischen Chemotherapie. Glehen et al. berichteten über ein medianes Überleben von 156 Monaten mit 5- und 10-Jahres-Überlebensraten von 72 % bzw. 55 % bei 501 Pseudomyxomaperitonei-Patienten, die sich einer CRS (vollständig oder unvollständig) gefolgt von einer HIPEC unterzogen hatten. Die Mehrheit der Patienten (~70 %) unterzog sich einer vollständigen Zytoreduktion. Dieser einheitliche Behandlungsansatz hat zu einer besseren 10-Jahres-Überlebensrate geführt als bei historischen Kontrollen. Obwohl keine Daten über den Einsatz einer hyperthermischen retroperitonealen Chemotherapie vorliegen, sollte diese Behandlung aufgrund der hohen Rezidivrate in Betracht gezogen werden. ChirurgieDas Rezidivrisiko ist so hoch, dass eine Nachsorge auf der Grundlage einer körperlichen Untersuchung, einer CT-Untersuchung und von Serummarkern unerlässlich ist. Die kombinierte Behandlung von Pseudomyxoma retroperitonei ist mit einer 20-Jahres-Überlebensrate von bis zu 70 % der Patienten verbunden, während die Überlebensrate bei Pseudomyxoma intra-peritonei, bei dem lebenswichtige Bauchstrukturen betroffen sind, geringer ist.
- Werth R. Pseudomyxomaperitonei. Arch Gynaecol. 1884; 24: 100-118.
- Bonnan LJ, Davis JG. Retroperitoneale Mucocoele des Wurmfortsatzes. Ein Fallbericht mit charakteristischen röntgenologischen Merkmalen. Radiology. 1948; 51: 375-382.
- Coppini B. Su di un rarissimo caso di pseudomixoma retroperitoneale di probabile origine appendicolare. G Clin Med. 1950; 31: 601-612.
- Early KS, Stephenson DV, Davis WC. Giant retroperitoneal mucocele simulating pseudomyxomaperitonei and mucinous adenocarcinoma. Am J Surg. 1968; 116: 439-443.
- Moran CJ, Morgan RH. Pseudomyxoma extraperitonei. J Roy Soc Med. 1988; 81: 668-669.
- Shelton MW, Morian JP, Radford DM. Pseudomyxoma retroperitonei in Verbindung mit einem Appendizitiszystadenom. Am Surg. 1994; 60: 958-960.
- Ioannidis O, Cheva A, Paraskevas G, Papadimitriou N, Konstantara A, Chatzopoulos S, et al. Pseudomyxomaretroperitonei: Bericht über 2 Fälle und Überblick über die Literatur. Rev Esp Enferm Dig. 2012; 104: 268-275.
- Pai RK, Longacre TA. Appendiceal mucinous tumors and pseudomy- xomaperitonei: histologic features, diagnostic problems, and proposed classification. Adv Anat Pathol. 2005; 12: 291-311.
- Smeenk RM, Verwaal VJ, Zoetmulder FA. Pseudomyxoma peritonei. Cancer Treat Rev. 2007; 33: 138-145.
- Smeenk RM, Bruin SC, van Velthuysen ML, Verwaal VJ. Pseudomy- xoma peritonei. Curr Probl Surg. 2008; 45: 527-575.
- Al-Bozom IA. Extraperitoneale Präsentation von Pseudomyxoma peritonei als skrotale Masse: Fallbericht und Überprüfung der Literatur. Ann Saudi Med. 2000; 20: 297-299.
- Lee NK, Kim S, Kim HS, Jeon TY, Kim GH, Kim DU, et al. Spectrum of mucin-producing neoplastic conditions of the abdomen and pelvis: crosssectional imaging evaluation. World J Gastroenterol. 2011; 17: 4757-4771.
- Sugarbaker PH. Pseudomyxomaperitonei. Ein Krebs, dessen Biologie durch ein Umverteilungsphänomen gekennzeichnet ist. Ann Surg. 1994; 219: 109-111.
- Glehen O, Mohamed F, Sugarbaker PH. Incomplete cytoreduction in 174 patients with peritoneal carcinomatosis from appendiceal malignancy. Ann Surg. 2004; 240: 278-285.
- Gonzalez-Moreno S, Sugarbaker PH. Right hemicolectomy does not confer a survival advantage in patients with mucinous carcinoma of the appendix and peritoneal seeding. Br J Surg. 2004; 91: 304-311.
- Hinson FL, Ambrose NS. Pseudomyxoma peritonei. Br J Surg. 1998; 85: 1332-1339.
- Sugarbaker PH. New standard of care for appendiceal epithelial neo- plasms and pseudomyxomaperitonei syndrome? Lancet Oncol. 2006; 7: 69-76.