Einführung
ß-Amyloid und phosphorylierte Tau-Proteine sind pathologische Kennzeichen der Alzheimer-Krankheit (AD), die sich in verteilten neuronalen Netzwerken ansammeln und vorhersehbar ausbreiten und fortschreitende Stoffwechselanomalien, neuronale Schädigungen und Zelltod verursachen. Die Neurobildgebung ermöglicht eine detaillierte Bewertung dieser pathologischen Veränderungen bei Patienten, die sich einer Untersuchung auf kognitiven Abbau unterziehen. Früher war eine definitive Diagnose der Alzheimer-Krankheit nur durch postmortale Beobachtung und neuroanatomische Einstufung dieser Proteinaggregate möglich. Jüngste Fortschritte in der molekularen Bildgebung ermöglichen jedoch die Visualisierung von Amyloid- und Tau-Ablagerungen im lebenden menschlichen Gehirn und haben uns einer definitiven In-vivo-Diagnose der Alzheimer-Krankheit näher gebracht.
Strukturelle Bildgebung
Die Richtlinien der American Academy of Neurology (AAN) für die diagnostische Abklärung von Menschen mit kognitiven Beschwerden1 empfehlen die strukturelle Bildgebung des Gehirns mit kontrastfreier CT oder MRT bei allen Personen mit positiver klinischer Vorgeschichte und objektiven kognitiven Veränderungen. In diesem Zusammenhang dient die Bildgebung des Gehirns in erster Linie dazu, nicht-degenerative strukturelle Läsionen auszuschließen, von denen 5 % in der klinischen Anamnese oder bei der körperlichen Untersuchung nicht erkennbar sind2 und die potenziell behandelbar sind. Die AAN empfiehlt außerdem, vaskuläre Demenz (VaD), Demenz mit Lewy-Körperchen (DLB) und frontotemporale Demenz (FTD) klinisch auszuschließen. Strukturelle Bildgebung kann die diagnostische Sicherheit verbessern und die klinische Diagnose in 19 % bis 28 % sowie das Management von 15 % der klinischen Fälle verändern.2
Die Bildgebungsmodalitäten der Wahl bei der Beurteilung struktureller Atrophie sind CT und MRT. Die krankheitsspezifischen Atrophiemuster sind mit Hilfe dieser Modalitäten gründlich beschrieben und validiert worden. Obwohl eine Atrophie auf der CT beobachtet werden kann, führen die geringere räumliche Auflösung und der geringere Kontrast zwischen grauer und weißer Substanz dazu, dass potenziell nützliche, subtile Beobachtungen neurodegenerativer Veränderungen verloren gehen. Daher verlassen sich Kliniker häufig auf die MRT, um das Muster und den Schweregrad der strukturellen Veränderungen zu beurteilen, um nicht-neurodegenerative Ursachen des kognitiven Verfalls auszuschließen und um den Schweregrad und das Ausmaß der Veränderungen der weißen Substanz zu bewerten, wie im Folgenden näher erläutert wird.
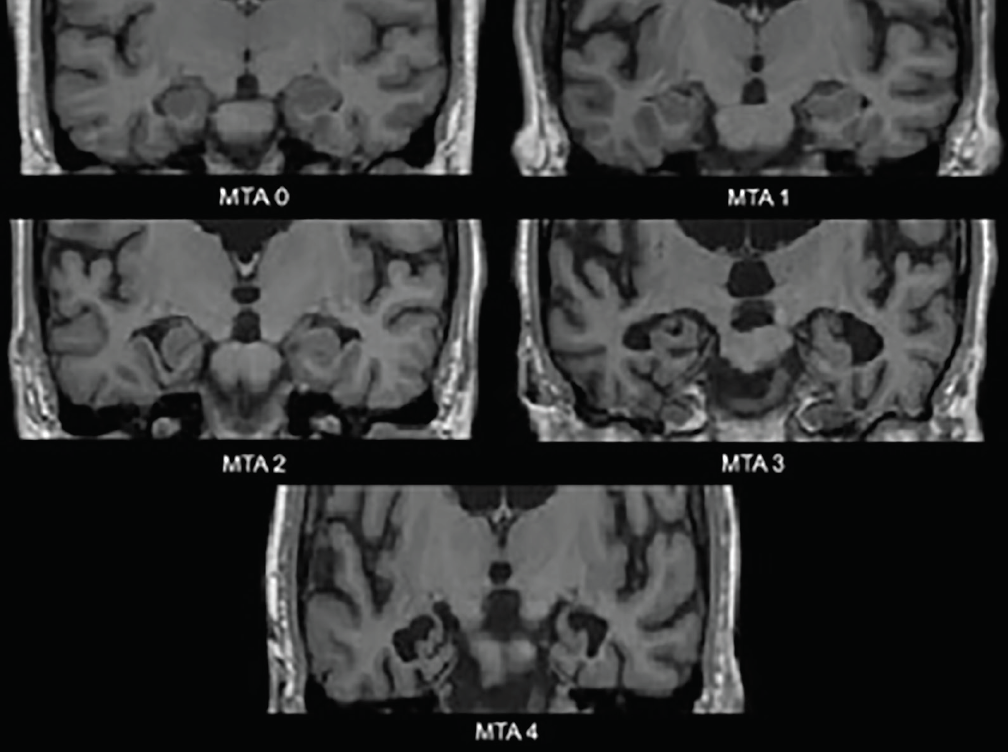
Die frühesten neurodegenerativen Veränderungen bei Alzheimer treten in den medialen Temporallappen auf – dem Hippocampus, dem entorhinalen Kortex und dem parahippocampalen Gyrus. Mit der einsetzenden Atrophie erweitern sich die Aderhautspalte und das temporale Horn des Seitenventrikels; diese Veränderungen lassen sich am besten in der koronalen Ebene beurteilen. Eine häufig verwendete visuelle Bewertungsskala, die auf diesen Strukturen basiert – die Skala der medialen temporalen Atrophie (MTA) (Abbildung 1) – wurde klinisch3 und neuropathologisch4 validiert. Verschiedene Studien, in denen diese Skala oder die von ihr erfassten Strukturen verwendet wurden, haben gezeigt, dass sie in signifikanter Weise in der Lage sind, Menschen mit Alzheimer von altersgleichen Kontrollen4 oder von Menschen mit DLB4 oder vaskulärer kognitiver Beeinträchtigung (VCI) zu unterscheiden.5 Die mediale temporale Atrophie ist auch prädiktiv für die Umwandlung von amnestischer leichter kognitiver Beeinträchtigung (MCI) in Alzheimer-Demenz.3
Klick für größere Ansicht
Abbildung 1. Einstufung der medialen Temporalatrophie (MTA) auf der Skala. MTA 0 – keine bis minimale Lückenbildung der Aderhautspalte; MTA 1 – leichte Verbreiterung der Aderhautspalte; MTA 2 – weitere Verbreiterung der Aderhautspalte, die in das temporale Horn des lateralen Ventrikels übergeht, leichte Abnahme der Höhe der Hippocampusformation; MTA 3-mäßige Abnahme der Höhe der Hippocampusformation, deutliche Vergrößerung des Schläfenhorns des Seitenventrikels; MTA 4-schwere Abnahme der Höhe der Hippocampusformation, deutliche Vergrößerung des Schläfenhorns des Seitenventrikels.
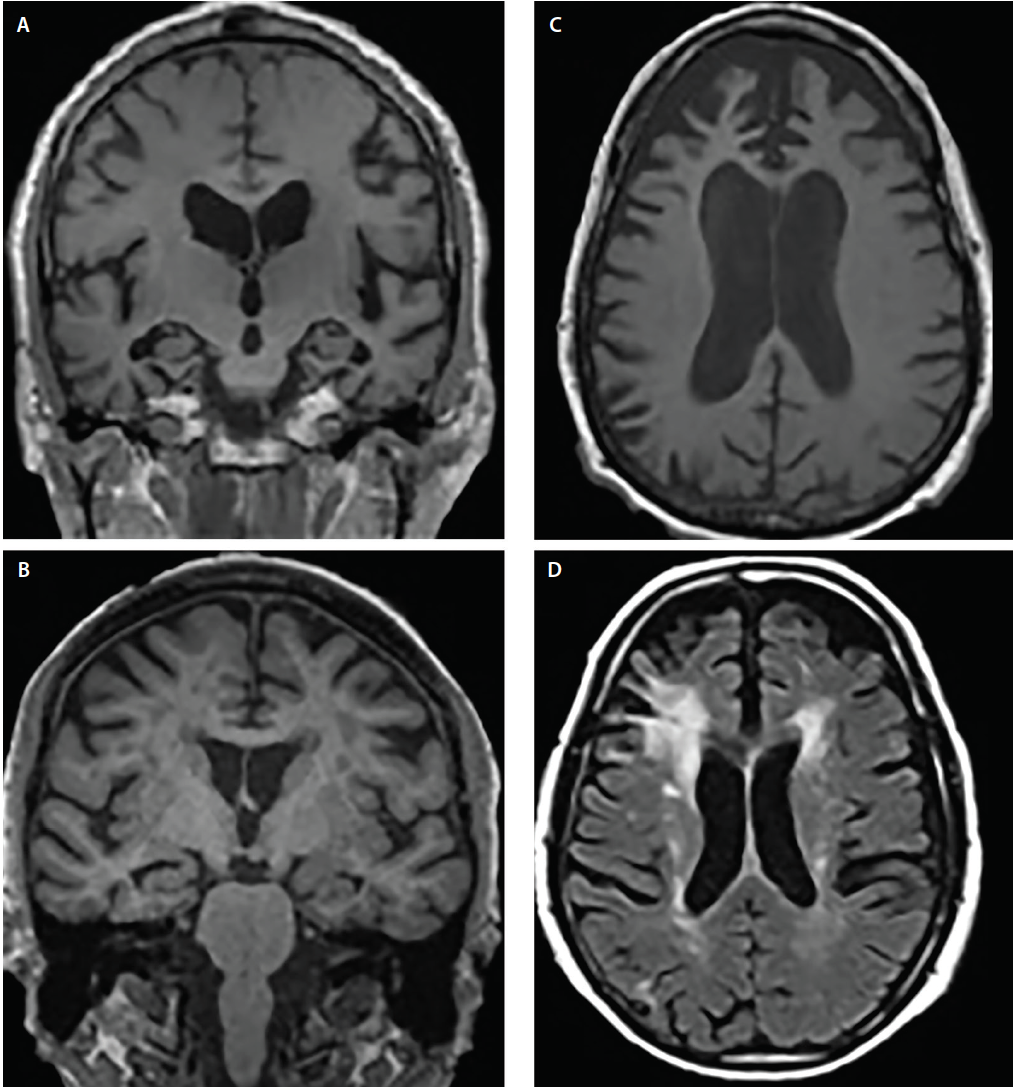
Demenzsyndrome weisen typischerweise kanonische Atrophiemuster6 auf, die mit kognitiven und Verhaltenssymptomen korrespondieren; die betroffenen Strukturen können sich jedoch überschneiden. So zeigen beispielsweise sowohl die Alzheimer-Krankheit als auch die DLB eine Beteiligung des medialen Temporallappens, aber mehrere bildgebende und neuropathologische Studien haben gezeigt, dass die DLB im Vergleich zur Alzheimer-Krankheit eine deutlich geringere Vorliebe für mediale Temporalstrukturen aufweist4,5 (Abbildung 2).
Klick für größere Ansicht
Abbildung 2. Strukturelle Atrophiemuster bei Alzheimer-Krankheit (AD) (A), Demenz mit Lewy-Körperchen (DLB) (B), frontotemporaler Demenz (FTD) (C) und vaskulärer Demenz (VaD) (D). Die koronale T1-gewichtete MRT zeigt eine generalisierte kortikale Atrophie, aber einen unterschiedlichen Grad an Hippocampus-Atrophie bei AD (A) und DLB (B). Die axiale T1-gewichtete MRT zeigt eine bvFTD-Atrophie mit einer fokalen Prädilektion für den medialen und lateralen präfrontalen Kortex (C). Die axiale T2-gewichtete MRT zeigt konfluierende periventrikuläre Kappen- und Halo-Hypointensitäten der weißen Substanz (WMHs), die die Corona radiata einbeziehen und sich bis in den lateralen präfrontalen Neokortex erstrecken, milde verstreute WMHs und WMHs der subependymalen Ventrikelauskleidung und des Septum pellucidum bei VaD (D).
Bei der AD und der frontotemporalen Lobärdegeneration (FTLD) gibt es überlappende Atrophieregionen, darunter Bereiche des präfrontalen, orbitofrontalen und anterioren insulären Kortex sowie der anterioren und medialen Temporallappen.6 Im Vergleich zueinander zeigt die AD jedoch deutlich mehr Atrophie im lateralen parietalen und okzipitalen Kortex, während die FTLD mehr Atrophie in den Frontallappen aufweist (Abbildung 2).6
Es ist wichtig, alle Hirnareale systematisch zu untersuchen und dabei sowohl Regionen mit struktureller Atrophie als auch mit anatomischer Sparsamkeit zu beachten, um die diagnostische Bildgebung optimal nutzen zu können. In einer großen, multizentrischen Studie wurde kürzlich die Fähigkeit von 6 visuellen Bewertungsskalen zur korrekten Klassifizierung von 186 pathologisch bestätigten Fällen von AD, DLB und FTLD bewertet.6 Diese Studie zeigte, dass die gleichzeitige Bewertung mehrerer krankheitsspezifischer Regionen eine deutlich bessere Unterscheidung ermöglicht als die Konzentration auf einen einzigen Bereich.4
Gefäßschäden sind ein wichtiger Aspekt bei der Bewertung von Personen mit kognitiven Beeinträchtigungen. Ischämische Veränderungen sind beim normalen Alterungsprozess häufig und werden durch häufige Begleiterkrankungen (z. B. Bluthochdruck, Diabetes und Hypercholesterinämie) beschleunigt. Auf einen vaskulären Beitrag zur kognitiven Beeinträchtigung wird häufig geschlossen, wenn signifikante Hyperintensitäten der weißen Substanz (WMH), kortikale Schlaganfälle oder strategisch gelegene Lakunen in T2-gewichteten oder FLAIR-Sequenzen (fluid attenuated inversion recovery) nachgewiesen werden. Lakunäre Schlaganfälle in den Basalganglien und WMH im Centrum semiovale und in der Corona radiata sind Indikatoren für chronische ischämische Schäden in kleinen Gefäßen (Abbildung 2). Im Gegensatz dazu sind periventrikuläre Kappen oft nicht-ischämischen Ursprungs und spiegeln eine subependymale Gliose wider.7 Es gibt mehrere Skalen für den Schweregrad der WMH (z. B. die Fazekas-Skala)7 , die im klinischen Umfeld verwendet werden können. Diese Bewertungsalgorithmen stimmen alle darin überein, dass weit verbreitete konfluente WMH und subkortikale lakunäre Infarkte zumindest teilweise wahrscheinlich zum kognitiven Verfall beitragen.7
Diffusion Tensor Imaging (DTI) ist eine neue MRT-Sequenz, die für die Diffusion von Wasser durch Gewebe empfindlich ist und die Integrität der weißen Substanz bewertet, da die Architektur der Axone den Wasserfluss einschränkt. Die mittlere Diffusivität und die fraktionierte Anisotropie werden häufig verwendet, um neurodegenerative Veränderungen mit DTI zu charakterisieren. Ersteres misst das Ausmaß der Diffusion und letzteres, ob das Wasser bevorzugt in eine einzige Richtung fließt, wie es bei gesunden Axonen zu erwarten ist. Eine verringerte mittlere Diffusivität und eine verringerte fraktionierte Anisotropie wurden durchweg sowohl bei MCI- als auch bei AD-Demenz-Populationen festgestellt.8 Mehrere Studien haben auch DTI-Veränderungen bei asymptomatischen Personen mit einem Risiko für die Entwicklung einer Alzheimer-Krankheit festgestellt9 , was darauf hindeutet, dass diese Veränderungen schon früh im Krankheitsverlauf auftreten. Neben der Bewertung der Integrität der weißen Substanz kann DTI auch zur Modellierung der groben strukturellen Konnektivität zwischen kortikalen Regionen unter Verwendung von Traktographie-Algorithmen verwendet werden. Dies hat auf dem Gebiet der Alzheimer-Krankheit an Bedeutung gewonnen, da es Hinweise darauf gibt, dass sich die Amyloid- und Tau-Pathologie über Gehirnverbindungen ausbreiten kann.10 Obwohl DTI ein Potenzial zur Messung der Integrität der weißen Substanz aufweist, schränken seine Empfindlichkeit gegenüber Bewegungen und andere technische Einschränkungen zumindest derzeit seine klinische Anwendung ein.
Funktionelle Bildgebung
Hirnhypometabolismus ist bei neurodegenerativen Erkrankungen leicht zu beobachten und kann bei der Differentialdiagnose helfen. Die Funktion der Neuronen hängt von der Zufuhr von Sauerstoff und Glukose aus dem Blut ab, die durch regionale Gefäßerweiterung erleichtert wird. Die 18F-Fluordesoxyglukose-Positronenemissionstomographie (FDG-PET) spiegelt indirekt den Grad der kortikalen Aktivität wider und kann leicht zur Visualisierung neurodegenerativer Veränderungen eingesetzt werden, indem diese metabolische Abhängigkeit von Glukose ausgenutzt wird.
Die charakteristische hypometabole kortikale Signatur der Alzheimer-Krankheit besteht aus frühen Veränderungen im posterioren Cingulum (PCC), im Precuneus, im Temporal- und Parietalkortex und, in späteren Stadien, im Frontalkortex. Dieses Muster manifestiert sich früh, sogar präsymptomatisch,11 und ist klinisch hilfreich bei der Unterscheidung von AD und FTD.12 Im Gegensatz zu AD zeigt die metabolische Signatur von FTD einen frontalen, anterioren temporalen, basalen gangliären und thalamischen Hypometabolismus, wobei die posterioren Assoziationskortizes relativ verschont bleiben.13 In klinisch unsicheren Situationen können Kliniker diese Stoffwechselsignaturen verwenden, um AD von FTD zu unterscheiden.12 In ähnlicher Weise kann die neokortikale Stoffwechselsignatur von DLB zwar eine verwirrende Überschneidung mit der von AD aufweisen, aber DLB-Fälle können auch einen okzipitalen Hypometabolismus zeigen.14
Das Center for Medicare & Medicaid Services erachtet FDG-PET nur für diejenigen als „angemessen und notwendig“, die sowohl die Kriterien für AD als auch für FTD erfüllen und bei denen eine vollständige diagnostische Abklärung gemäß den AAN-Richtlinien1 keine definitive Ätiologie ergeben hat.15
Funktionelle MRT (fMRI) kann auch die Hirnaktivität messen, indem sie Sequenzen verwendet, die empfindlich auf zeitliche Veränderungen des sauerstoffhaltigen/deoxygenierten Hämoglobins aufgrund der Hirnaktivität reagieren. Auf diese Weise ist die fMRI mit der FDG-PET verwandt, da die Veränderungen des Hämoglobins durch den für die Hirnaktivität erforderlichen Glukosestoffwechsel bedingt sind. Aus den zeitlichen Abhängigkeiten zwischen den Regionen kann auf die funktionelle Konnektivität geschlossen werden (d. h. welche Regionen aktiv miteinander kommunizieren). Im Vergleich zur FDG-PET bietet die fMRI eine bessere räumliche Auflösung, so dass die Konnektivität genauer abgebildet werden kann. Ein weiterer Vorteil der fMRT besteht darin, dass sie während der Ausführung einer Aufgabe oder in Ruhe durchgeführt werden kann. Im ersten Fall werden Konnektivitätsmuster identifiziert, die durch bestimmte aktive Zustände gesteuert werden, während im zweiten Fall Konnektivitätsmuster identifiziert werden, die im Ruhezustand vorhanden sind und als Standardmodus-Netzwerk (DMN) bekannt sind. Das DMN wird durch funktionelle Knotenpunkte, den PCC und den Precuneus, definiert, die mit einem dorsalen medialen Subsystem und einem medialen temporalen Subsystem verbunden sind.16 Es wird angenommen, dass die Amyloidablagerung in den funktionellen Knotenpunkten des DMN beginnt. Es ist bekannt, dass das DMN bei Alzheimer betroffen ist.16 Im Gegensatz dazu bleibt das DMN bei FTD verschont, während das Aufmerksamkeitsnetz betroffen ist.17 Gegenwärtig ist die fMRT-Technologie auf Forschungsanwendungen beschränkt, aber es wird aktiv nach Möglichkeiten gesucht, relevante klinisch anwendbare Algorithmen zu entwickeln.
Molekulare Bildgebung
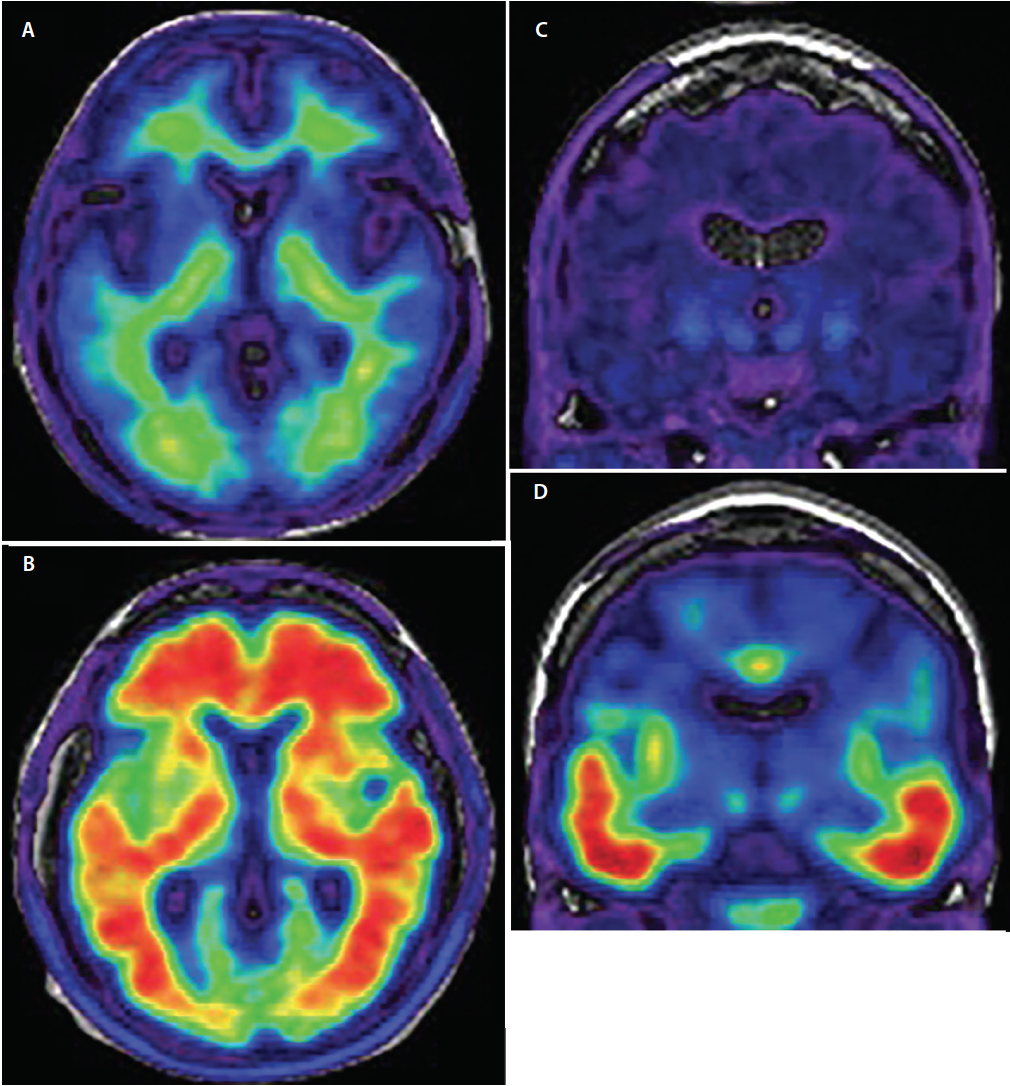
Das Standardkriterium für eine definitive Diagnose von Alzheimer ist die postmortale neuropathologische Gehirnuntersuchung. Selbst in den Händen erfahrener Demenzexperten erreicht die klinische Diagnose von Alzheimer nur eine beunruhigende Sensitivität von 70,9 bis 87,3 % und eine Spezifität von 44,3 bis 70,8 %.18 Von größter Bedeutung für die Verbesserung der klinischen Diagnosegenauigkeit von AD war die Entwicklung von radioaktiv markierten PET-Bildgebungs-Tracern mit spezifischer Affinität für AD-bedingte ß-Amyloid- und phosphorylierte Tau-Aggregate (Abbildung 3), die einen In-vivo-Nachweis der zugrunde liegenden Neuropathologie (Tabelle) ermöglichen, der früher nur postmortal möglich war.
Klicken Sie, um es größer zu sehen
Abbildung 3. Axiales Amyloid-PET mit Amyloid-negativen (A) und Amyloid-positiven Scans (B). In den Amyloid-negativen Aufnahmen (A) ist das Radiotracersignal von geringer Intensität und beschränkt sich auf eine unspezifische Bindung an die weiße Substanz. Die Grenze zwischen grauer und weißer Substanz ist erhalten. In Amyloid-positiven Bildern (B) ist das Radiotracer-Signal von hoher Intensität und erstreckt sich diffus in kortikale Regionen der grauen Substanz und verdeckt die Grenze zwischen grauer und weißer Substanz. Koronales Tau-PET mit tau-negativen (C) und tau-positiven (D) Scans. Bei tau-negativen Scans gibt es ein minimales, unspezifisches Radiotracer-Signal von geringer Intensität in den Regionen des medialen Temporalraums, des basalen Vorderhirns und der Basalganglien. In tau-positiven Scans (D) ist das Radiotracer-Signal von höherer Intensität und umfasst die inferioren und lateralen Schläfenrinden, die dem bekannten Verlauf der neurofibrillären Tangles folgen.
Amyloid-Positronen-Emissions-Tomographie
Amyloid und in jüngerer Zeit die Tau-Bildgebung haben unsere Fähigkeit revolutioniert, die AD-Pathologie selbst in präsymptomatischen Stadien sichtbar zu machen.19 Amyloid-PET-Imaging-Tracer sind valide und zuverlässig für den Nachweis der AD-Pathologie in vivo in verschiedenen Krankheitsstadien. Diese bildgebenden Tracer binden spezifische Konformationsmotive des Amyloidproteins und führen zu einer Traceraufnahme, die eng mit der postmortalen Amyloidablagerung korreliert.20
Im Vergleich zu Tau beginnt die Amyloidpathologie in einem diffuseren regionalen Muster, das sich von den basalen Teilen des Frontal-, Temporal- und Okzipitallappens bis zu den dorsalen neokortikalen Assoziationsbereichen ausbreitet und erst im Spätstadium die primären sensorischen und motorischen Kortizes betrifft.21 Die auffälligsten Bereiche mit Tracer-Aufnahme sind die frontalen, parietalen und lateralen Schläfenrinden (Abbildung 3), wobei die Aufnahme bei Menschen mit Alzheimer im Vergleich zu Kontrollgruppen22 oder Menschen mit anderen Demenzerkrankungen 1,5- bis 2-mal höher ist.23
Amyloid-PET-Bilder werden auf kortikale Tracer-Aufnahme in charakteristischen Bereichen der Amyloidverteilung bei Alzheimer untersucht. Positive Scans zeigen einen Verlust der Unterscheidung zwischen grauer und weißer Substanz, da sich die Traceraufnahme in den Neokortex ausdehnt. Bei negativen Scans wird die Unterscheidung zwischen grauer und weißer Substanz beibehalten, wobei nur die Bindung in der weißen Substanz außerhalb des Zielgebiets sichtbar ist.24 Amyloid-PET-Bildgebungsmuster können sowohl bei gesunden Menschen als auch bei Menschen mit MCI zuverlässig den kognitiven Abbau vorhersagen.20
18F-Florbetapir, 18F-Florbetaben und 18F-Flutemetamol sind von der Food and Drug Administration (FDA) für den klinischen Einsatz zugelassen.20 Die Versicherungsträger haben die Technologie jedoch aufgrund der Kosten und des Risikos einer klinischen Überbeanspruchung in Ermangelung krankheitsmodifizierender Therapien und eines nachgewiesenen Kostenvorteils nicht angenommen. Eine Meta-Analyse ergab eine 95-prozentige Sensitivität und 57-prozentige Spezifität eines positiven Amyloid-PET-Scans für die Vorhersage der Umwandlung von MCI in Alzheimer.25
Das unsichere Verhältnis zwischen Kosten, Risiko und Nutzen hat zur Entwicklung von Kriterien für den angemessenen Einsatz der Amyloid-Bildgebung geführt, die die Notwendigkeit einer Amyloid-PET-Untersuchung Personen mit ungeklärtem MCI, atypischen Alzheimer-Erscheinungen und früh einsetzender Demenz zuschreiben.26 Experten haben auch unangemessene Indikationen für die Amyloid-Bildgebung identifiziert, darunter die alleinige Bewertung von kognitiven Bedenken vor einer gründlichen klinischen, kognitiven, labortechnischen und strukturellen Neurobildgebung; bei Fehlen einer objektiven kognitiven Beeinträchtigung; bei hoher Wahrscheinlichkeit einer Alzheimer-Erkrankung (d. h. bei Fehlen eines klinischen Gleichgewichts); und für die Einstufung des Schweregrads einer Demenz.
Die IDEAS-Studie (Imaging Dementia-Evidence for Amyloid Scanning) – eine laufende Studie des Center for Medicare and Medicaid Services – validiert derzeit die Kriterien für den angemessenen Einsatz und bewertet die Auswirkungen des durch PET ermittelten Amyloid-Status auf das Krankheitsmanagement und die langfristigen Ergebnisse für Medicare-Empfänger mit MCI oder atypischen Präsentationen. Eine Zwischenanalyse ergab, dass die Einbeziehung der Amyloid-PET in die klinische Untersuchung bei 60,2 % der Menschen mit MCI und 63,5 % der Menschen mit Demenz zu einer Änderung des Krankheitsmanagements führte.27 Die Langzeitergebnisse werden noch ermittelt.
Tau-Positronen-Emissions-Tomographie
Tau ist das zweite Protein, das sich im Gehirn von Menschen mit Alzheimer ablagert. Tau-PET-Imaging-Tracer befinden sich derzeit in der Entwicklung und sind bereits vielversprechend. Ähnlich wie beim Amyloid-PET zielen die Tau-PET-Tracer auf bestimmte Konformationsmotive des phosphorylierten Tau ab. Die Spezifität von Tau-Tracern wurde postmortal validiert28 , und das beobachtete Tau-PET-Signal stimmt gut mit der anatomischen Verteilung der neurofibrillären Tangles überein, die derzeit für die neuropathologische Diagnose der Alzheimer-Krankheit verwendet werden.29 Die frühesten Stadien der Tau-Pathologie, die mit der Tau-PET-Bildgebung sichtbar gemacht werden können, sind die Ablagerungen neurofibrillärer Tangles im entorhinalen Kortex und im Hippocampus. Als Nächstes werden Tau-Ablagerungen im inferioren und lateralen Temporallappen nachweisbar (Abbildung 3), gefolgt vom parietalen und okzipitalen und schließlich vom frontalen Kortex, entsprechend der gut etablierten pathologischen Einteilung der Tau-Ablagerungen im Gehirn nach Braak und Braak.21 Tau-Tracer sind nicht ohne diagnostische Einschränkungen und werden weiter entwickelt, um ihre klinische Rolle besser zu definieren. Da sich die Tau-Tracer-Bindung jedoch während des gesamten klinischen Verlaufs der Alzheimer-Krankheit dynamisch verändert, wird diese Bildgebungsmethode wahrscheinlich eine wichtige Rolle bei der Einstufung des Schweregrads der Krankheit in vivo spielen.30
Future Directions
Angesichts der Tatsache, dass die AD-Pathologie bis zu 20 Jahre vor der Demenzdiagnose19 leicht erkannt werden kann und einer vorhersagbaren stufenweisen Verteilung folgt, konzentriert sich die Forschung jetzt auf die frühe präsymptomatische Erkennung und die Verbesserung der diagnostischen Genauigkeit durch den Einsatz von Biomarkern (Tabelle).31 Ein vorgeschlagener Amyloid-Tau-Neurodegeneration (ATN)-Forschungsrahmen, der sich auf die Erkennung von 3 Biomarker-Veränderungen im Gehirn konzentriert, prognostiziert die klinische Relevanz der multimodalen Bildgebung.31 Das ATN-Klassifizierungssystem ist unabhängig von klinischen Syndromen und erfasst das gesamte Spektrum neurodegenerativer Erkrankungen durch eine AD-Biomarker-Brille. Nach weiterer Entwicklung und Verfeinerung wird das ATN-System durch objektive In-vivo-Biomarker-Kategorisierung voraussichtlich die klinische Diagnosegenauigkeit und die Qualität der Versorgung erheblich verbessern.
Schlussfolgerung
Neuroimaging bietet einzigartige Informationen über die zugrunde liegende Ätiologie kognitiver Beeinträchtigungen und erleichtert Patienten und Familien die Orientierung in einer Zeit der Angst und Ungewissheit. Alle neurodegenerativen Erkrankungen weisen eine erhebliche klinische Heterogenität auf, und vor den jüngsten Fortschritten in der molekularen Bildgebung konnte keine davon vor dem Tod definitiv diagnostiziert werden. Die moderne bildgebende Hirntechnologie ist in der Lage, eine Vielzahl von Epiphänomenen zu erkennen, die die zugrundeliegende Neuropathologie widerspiegeln, von denen einige recht nahe am Krankheitsherd liegen. Die sicherste klinische Diagnose basiert derzeit auf einer Integration von Anamnese, ärztlichen Beobachtungen, körperlicher Untersuchung, medizinischer Abklärung, neuropsychologischen Tests und fundierter Interpretation der diagnostischen Neurobildgebung. In dem Maße, wie die ATN-Biomarker weiter verfeinert werden, werden klinische Diagnosen bei lebenden Patienten früher und eindeutiger gestellt werden, weniger auf der Klassifizierung von Symptomen beruhen und Möglichkeiten für ein früheres therapeutisches Eingreifen bieten, das den Verlauf neurodegenerativer Erkrankungen verändern kann.
1. Knopman DS, DeKosky ST, Cummings JL, et al. Practice parameter: diagnosis of dementia (an evidence-based review). Bericht des Unterkomitees für Qualitätsstandards der American Academy of Neurology. Neurology. 2001;56(9):1143-1153.
2. Chui H, Zhang Q. Evaluation of dementia: a systematic study of the usefulness of the American Academy of Neurology’s practice parameters. Neurology. 1997;49(4):925-935.
3. Apostolova LG, Thompson PM, Green AE, et al. 3D comparison of low, intermediate, and advanced hippocampal atrophy in MCI. Hum Brain Mapp. 2010;31(5):786-797.
4. Harper L, Fumagalli GG, Barkhof F, et al. MRI visual rating scales in the diagnosis of dementia: evaluation in 184 post-mortem confirmed cases. Gehirn. 2016;139(Pt 4):1211-1225.
5. Burton EJ, Barber R, Mukaetova-Ladinska EB, et al. Medial temporal lobe atrophy on MRI differentiates Alzheimer’s disease from dementia with Lewy bodies and vascular cognitive impairment: a prospective study with pathological verification of diagnosis. Brain. 2009;132(Pt 1):195-203.
6. Harper L, Bouwman F, Burton EJ, et al. Patterns of atrophy in pathologically confirmed dementias: a voxelwise analysis. J Neurol Neurosurg Psychiatry. 2017;88(11):908-916.
7. Fazekas F, Kleinert R, Offenbacher H, et al. Pathologic correlates of incidental MRI white matter signal hyperintensities. Neurology. 1993;43(9):1683-1689.
8. Huang J, Friedland RP, Auchus AP. Diffusion Tensor Imaging der normal erscheinenden weißen Substanz bei leichter kognitiver Beeinträchtigung und früher Alzheimer-Krankheit: vorläufige Hinweise auf axonale Degeneration im Temporallappen. AJNR Am J Neuroradiol. 2007;28(10):1943-1948.
9. Selnes P, Fjell AM, Gjerstad L, et al. White matter imaging changes in subjective and mild cognitive impairment. Alzheimers Dement. 2012;8(5 Suppl):S112-S121.
10. Jacobs HIL, Hedden T, Schultz AP, et al. Strukturelle Traktveränderungen sagen eine nachgeschaltete Tau-Akkumulation bei amyloid-positiven älteren Menschen voraus. Nat Neurosci. 2018;21(3):424-431.
11. Apostolova LG, Thompson PM, Rogers SA, et al. Surface feature-guided mapping of cerebral metabolic changes in cognitively normal and mildly impaired elderly. Mol Imaging Biol. 2010;12(2):218-224.
12. Foster NL, Heidebrink JL, Clark CM, et al. FDG-PET verbessert die Genauigkeit bei der Unterscheidung von frontotemporaler Demenz und Alzheimer-Krankheit. Brain. 2007;130(Pt 10):2616-2635.
13. Ishii K, Sakamoto S, Sasaki M, et al. Zerebraler Glukosestoffwechsel bei Patienten mit frontotemporaler Demenz. J Nucl Med. 1998;39(11):1875-1878.
14. Mosconi L, Tsui WH, Herholz K, et al. Multizentrische standardisierte 18F-FDG-PET-Diagnose von leichter kognitiver Beeinträchtigung, Alzheimer-Krankheit und anderen Demenzerkrankungen. J Nucl Med. 2008;49(3):390-398.
15 . Centers for Medicare & Medicaid Serivces. Decision Memo for Positron Emission Tomography (FDG) and Other Neuroimaging Devices for Suspected Dementia (CAG-00088R)https://www.cms.gov/medicare-coverage-database/details/nca-decision-memo.aspx?NCAId=104. Accessed May 4, 2019.
16. Buckner RL, Sepulcre J, Talukdar T, et al. Cortical hubs revealed by intrinsic functional connectivity: mapping, assessment of stability, and relation to Alzheimer’s disease. J Neurosci. 2009;29(6):1860-1873.
17. Seeley WW, Crawford RK, Zhou J, Miller BL, Greicius MD. Neurodegenerative Krankheiten zielen auf große menschliche Gehirnnetzwerke ab. Neuron. 2009;62(1):42-52.
18. Beach TG, Monsell SE, Phillips LE, Kukull W. Accuracy of the clinical diagnosis of Alzheimer disease at National Institute on Aging Alzheimer Disease Centers, 2005-2010. J Neuropathol Exp Neurol. 2012;71(4):266-273.
19. Jagust W. Imaging the evolution and pathophysiology of Alzheimer disease. Nat Rev Neurosci. 2018;19(11):687-700.
20. Rice L, Bisdas S. The diagnostic value of FDG and amyloid PET in Alzheimer’s disease-a systematic review. Eur J Radiol. 2017;94:16-24.
21. Braak H, Braak E. Neuropathological stageing of Alzheimer-related changes. Acta Neuropathol. 1991;82(4):239-259.
22. Klunk WE, Engler H, Nordberg A, et al. Imaging brain amyloid in Alzheimer’s disease with Pittsburgh Compound-B. Ann Neurol. 2004;55(3):306-319.
23. Ossenkoppele R, Jansen WJ, Rabinovici GD, et al. Prevalence of amyloid PET positivity in dementia syndromes: a meta-analysis. JAMA. 2015;313(19):1939-1949.
24. Minoshima S, Drzezga AE, Barthel H, et al. SNMMI procedure standard/EANM Practice Guideline for Amyloid PET Imaging of the Brain 1.0. J Nucl Med. 2016;57(8):1316-1322.
25. Ma Y, Zhang S, Li J, et al. Predictive accuracy of amyloid imaging for progression from mild cognitive impairment to Alzheimer disease with different lengths of follow-up: a meta-analysis. . Medicine (Baltimore). 2014;93(27):e150.
26. Johnson KA, Minoshima S, Bohnen NI, et al. Appropriate use criteria for amyloid PET: a report of the Amyloid Imaging Task Force, the Society of Nuclear Medicine and Molecular Imaging, and the Alzheimer’s Association. Alzheimers Dement. 2013;9(1):e1-e16.
27. Rabinovici GD, Gatsonis C, Apgar C, et al. Association of amyloid positron emission tomography with subsequent change in clinical management among medicare beneficiaries with mild cognitive impairment or dementia. JAMA. 2019;321(13):1286-1294.
28. Aguero C, Dhaynaut M, Normandin MD, et al. Autoradiography validation of novel tau PET tracer -MK-6240 on human postmortem brain tissue. Acta Neuropathol Commun. 2019;7(1):37.
29. Chien DT, Bahri S, Szardenings AK, et al. Early clinical PET imaging results with the novel PHF-tau radioligand -T807. J Alzheimers Dis. 2013;34(2):457-468.
30. Wang L, Benzinger TL, Su Y, et al. Evaluation of tau imaging in staging Alzheimer disease and revealing interactions between beta-amyloid and tauopathy. JAMA Neurol. 2016;73(9):1070-1077.
31. Jack CR, Jr., Bennett DA, Blennow K, et al. NIA-AA Research Framework: Toward a biological definition of Alzheimer’s disease. Alzheimers Dement. 2018;14(4):535-562.
MRA und DS berichten keine Offenlegungen.
LGA war Mitglied eines Beratungsgremiums für Eli Lilly.