Wenn Wasserstoff kovalent an ein stark elektronegatives Atom wie Fluor, Chlor, Sauerstoff oder Stickstoff gebunden ist, hat das H-Atom eine positive Teilladung, geschrieben Hδ+.
Hδ+ ist physikalisch sehr klein, so dass die Ladungsdichte an ihm ungewöhnlich hoch ist.
Stellen Sie sich vor, ein anderes negatives oder elektronegatives Atom, z. B. in einem anderen Molekül, nähert sich dem Hδ+; es kommt zu einer gegenseitigen Anziehung, was zu einer besonders starken Dipol-Dipol-Anziehung führt.Diese Anziehungskraft wird als Wasserstoffbindung bezeichnet.
Im Allgemeinen sind Wasserstoffbindungen schwächer als Ionen- und kovalente Bindungen, aber stärker als Van-der-Waals-Kräfte.

Wasserstoffbindungen in Wasser
Das bekannteste Beispiel für Wasserstoffbindungen ist Wasser:
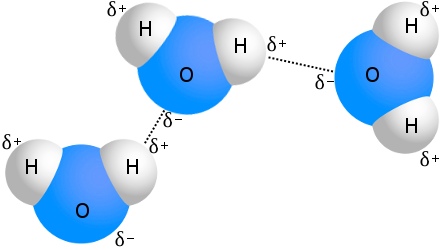
Jedes Wassermolekül kann mit bis zu vier anderen Wassermolekülen eine Wasserstoffbindung eingehen.In Wasser bei Raumtemperatur beträgt die durchschnittliche Anzahl der Wasserstoffbrückenbindungen pro Wassermolekül 3,6.
Die zufällige thermische Bewegung der Moleküle sorgt dafür, dass die Lebensdauer jeder einzelnen Wasserstoffbrückenbindung in Wasser kurz ist, im Durchschnitt nur 10 Pikosekunden.Die Zeit zur Bildung einer neuen Bindung ist jedoch noch kürzer.
Um eine einzelne Wasserstoffbindung in Wasser dauerhaft zu brechen, sind 21 kJ mol-1 erforderlich, ein erheblicher Energieaufwand, der dazu führt, dass die Schmelz- und Siedepunkte von Wasser viel höher sind, als man es bei einem Molekül mit so geringem Molekulargewicht erwarten würde.
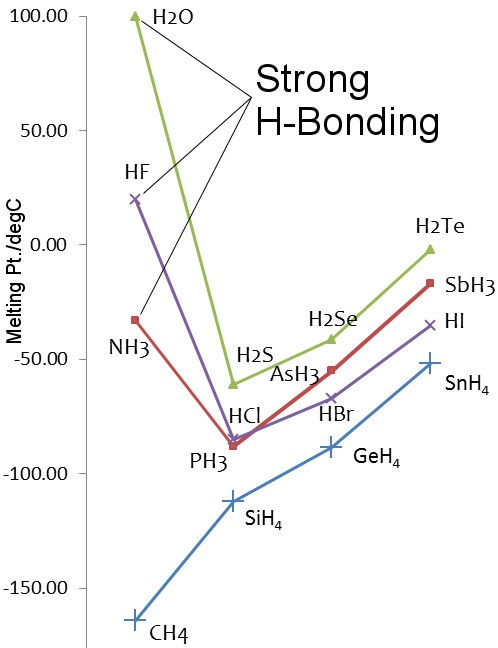
Betrachten wir Wasser vs. Methan: Wassermoleküle ziehen sich durch Wasserstoffbrückenbindungen stark an, während bei Methan die van-der-Waals-Kräfte überwiegen, so dass die physikalischen Eigenschaften trotz der ähnlichen Molekülmassen von 18 für Wasser und 16 für Methan sehr unterschiedlich sind.Zum Beispiel schmilzt Wasser bei 0,00 °C und siedet bei 99,98 °C; Methan schmilzt bei -182,5 °C und siedet bei -161,5 °C.
Wasserstoffbindung in Wasser und Schwefelwasserstoff
Schwefel befindet sich in Gruppe 16 des Periodensystems, genau wie Sauerstoff. Da Schwefel schwerer ist als Sauerstoff, sollte H2S einen höheren Schmelz- und Siedepunkt haben als H2O. Dies ist jedoch nicht der Fall, da Schwefel weniger elektronegativ ist als Sauerstoff und die Wasserstoffbrückenbindung in H2S daher schwach ist.

Mol. Masse: 16
Schmelzpunkt: 0,00 °C
Siedepunkt: 99,98 °C
Elektronegativität von O (Pauling): 3,44
Wasserstoffbindungsenthalpie: 21 kJ mol-1

Mol. Mass: 34
Schmelzpunkt: -82 °C
Siedepunkt: -60 °C
Elektronegativität von S (Pauling): 2.58
Wasserstoffbindungsenthalpie: ≅ 3 kJ mol-1
Wasserstoffbindung in Ammoniak und Fluorwasserstoff
Fluor und Stickstoff sind die elektronegativsten Elemente in ihren Gruppen des Periodensystems, und Wasserstoffbindung wird in Fluorwasserstoff und Ammoniak beobachtet.
Wie bei Wasser sind die Schmelz- und Siedepunkte von Fluorwasserstoff und Ammoniak höher als die der Hydride der schwereren Elemente in ihren Gruppen.
Schmelzpunkte der Hydride der Elemente der Gruppen 14-17
Wasserstoffbrückenbindungen in der DNS
Die Basenpaare der DNS verbinden die beiden Helixketten und tragen die genetische Information der DNS.
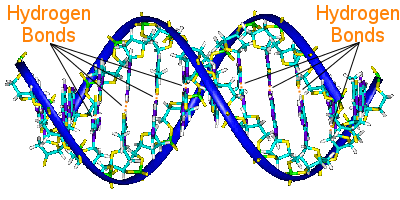
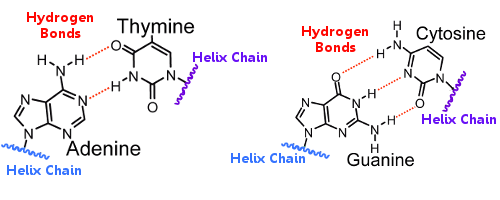
Die Basenpaare der einen Helix sind mit den Basenpaaren der anderen Helix durch Wasserstoffbrückenbindungen verbunden, die die Helixen zusammenhalten und die berühmte Doppelhelix bilden.
Bei der Replikation der DNA brechen die Wasserstoffbrückenbindungen auf, so dass sich die beiden Helixen trennen können, und die Wasserstoffbrückenbindungen spielen eine wichtige Rolle beim Schlüssel-Schloss-Mechanismus der DNA-Replikation.
Wasserstoffbindungen in Wolle
Wie andere Proteinfasern weist auch Wolle Wasserstoffbrückenbindungen auf. Die folgende Abbildung zeigt, wie Wasserstoffbrückenbindungen (orangefarbene Punkte) die Windungen der α-Helixkette der Wolle (grün) verbinden.
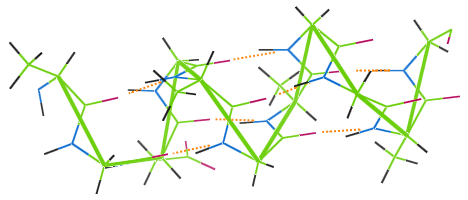
Wird ein Wollkleidungsstück bei hoher Temperatur gewaschen, werden die Wasserstoffbrücken zerstört, die Windungen verlieren ihre Elastizität, und das Kleidungsstück wird mangelhaft.
