WAS IST EINE KONGENITALE KORONARIÄRANOMALIE?
Es gibt eine anhaltende Debatte darüber, was als normal und was als Koronararterienanomalie (CAA) angesehen werden sollte. Nach Angelini1 werden CAA durch Ausschluss diagnostiziert, was bedeutet, dass in den Fällen, in denen die Morphologie der Koronararterien nicht normal ist, die Normalität nach einem statistischen Kriterium definiert wird (Intervall zwischen plus oder minus 2 Standardabweichungen vom Mittelwert). Somit wäre eine CAA diejenige Koronararterienmorphologie, die bei weniger als einem Prozent der Allgemeinbevölkerung beobachtet wird.1,2 CAA können während der normalen oder pathologischen Kardiogenese entstehen: Im ersten Fall handelt es sich um isolierte CAA, auf die wir uns in diesem Artikel konzentrieren, während sie im zweiten Fall mit anderen Herzfehlbildungen einhergehen.
KLASSIFIKATION
Es gibt mehrere Klassifikationen.1-3 Eine neue Klassifikation, die versucht, die diagnostischen Kriterien zu standardisieren und die CAA in 7 Kategorien einteilt, wurde kürzlich vorgeschlagen4 (Tabelle 1).


Internationale Gruppen fordern Register, in denen zumindest die Anomalien erfasst werden, die die Mehrheit der klinischen Ereignisse (plötzlicher Tod und Myokardischämie) verursachen, die auf CAA zurückzuführen sind,5-7, die aus dem kontralateralen oder „falschen“ Sinus Valsalva stammen. Zu dieser Gruppe gehören Eingefäß-Koronararterien („Hyperdominanz“ in der Klassifikation von Rigatelli et al.4), da sie das Myokard von einem einzigen Koronarostium aus mit Blut versorgen müssen und gelegentlich ähnliche Wege wie die CAA mit Ursprung im falschen Sinus Valsalva einschlagen (Abbildung 1).

Abbildung 1. Koronararteriographie in linker anteriorer Schrägprojektion, die eine eingefäßige rechte Koronararterie zeigt.
INZIDENZ
Die unterschiedlichen Definitionen oder Klassifizierungen und die Analyse sowohl von angiographischen8,9 als auch von Autopsieserien10 und, in den letzten Jahren, von echokardiographischen Serien11 führen zu einer gemeldeten Inzidenz von CAA, die zwischen 0,1 % und 8,4 % liegt,1,8,11 was es schwierig macht, das genaue Ausmaß des Problems zu bestimmen, das sie darstellen. Insgesamt dürfte die Inzidenz ähnlich hoch sein wie bei anderen Erkrankungen, die wir genauer definieren konnten, wie z. B. die hypertrophe Kardiomyopathie (0,2 %)12 oder das Wolff-Parkinson-White-Syndrom (0,1 % bis 0,3 %).13
Die Inzidenz anomaler Koronararterien mit Ursprung im falschen Sinus und Ein-Gefäß-Koronararterien in koronarangiographischen Studien liegt zwischen 0.28% und 1,74%.2,3,8,9,14-16 Angesichts ihrer klinischen Bedeutung konzentrieren wir uns in unserer Übersicht auf diese Anomalien.
KLINISCHE VORSTELLUNGEN
Anfänglich wurden diese Anomalien bei der Koronarangiographie von Patienten mit Herzklappenerkrankungen oder ischämischen Herzerkrankungen diagnostiziert und als klinisch unbedeutend angesehen. Später wurde über plötzliche Todesfälle bei jungen Sportlern berichtet, bei denen das einzige Krankheitszeichen eine Anomalie war, die ihren Ursprung in den Koronararterien hatte.8,17
Das klinische Spektrum bei der Präsentation ist variabel: Während einige Patienten asymptomatisch sind, zeigen andere Angina pectoris, Dyspnoe, Synkope, akuten Myokardinfarkt, Herzversagen und plötzlichen Tod.1,2,5,8,17-20 Gegenwärtig gilt das CAA als zweithäufigste Ursache für den plötzlichen Tod bei Sportlern in den Vereinigten Staaten.21
Bedeutet dies, dass alle CAA als Hinweis auf ein hohes Risiko betrachtet werden sollten? Auf keinen Fall, aber aus strategischer Sicht sollten sie als „potenziell bösartig“ betrachtet werden, bis zusätzliche Tests durchgeführt werden, um eine durch die Anomalie hervorgerufene Myokardischämie auszuschließen.
Das größte Problem besteht darin, festzustellen, welche CAA zum plötzlichen Tod führen können. Heute weiß man, dass diejenigen, die einen interarteriellen (oder intramuralen) Verlauf haben, bei denen die anomale Koronararterie die dominante ist und die bei Patienten unter 30 oder 35 Jahren klinische Symptome hervorrufen, die höchste Inzidenz des plötzlichen Todes aufweisen.22-26
Aus diesem Grund sollte unser Vorgehen bei einem CAA je nach Alter des Patienten unterschiedlich sein. Bei jungen Menschen unter 35 Jahren werden wir uns darauf „konzentrieren“, den plötzlichen Tod zu verhindern, während bei über 35-Jährigen das Hauptziel die Behandlung der Myokardischämie sein wird (Abbildung 2).
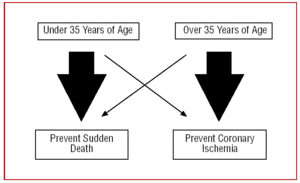
Abbildung 2. Unterschiedliches Vorgehen je nach Alter des Patienten.
Gelegentlich können CAA aufgrund ihres Ursprungs und anomalen Verlaufs bei der Operation zum Klappenersatz beschädigt werden, aber auch beim perkutanen Foramen ovale-Verschluss kann dies vorkommen. Aus diesem Grund sollte das Vorhandensein von CAA vor derartigen Eingriffen ausgeschlossen werden.27-30
PATHOPHYSIOLOGIE DER ISCHEMIE BEI KORONAREN ANOMALIEN
Es gibt eine Reihe von Theorien31 zur Erklärung der Mechanismen, die zu einer Ischämie bei CAA führen, aber keine davon konnte eindeutig nachgewiesen werden. In einer Theorie wird die Ursache in der starken Abwinkelung der anomalen Arterie an der Stelle gesehen, an der sie aus der Aorta austritt. Im Gegensatz zu einer normalen Koronararterie, die an ihrem Ursprung senkrecht zur Aorta steht, muss sich die anomale Koronararterie über sich selbst beugen, um vom gegenüberliegenden Sinus Valsalva ihr normales Versorgungsgebiet zu erreichen. Aus diesem Grund wäre das Ostium der anomalen Koronararterie im Vergleich zum normalen kreisförmigen Ostium kleiner, mit klappenähnlichen Rippen, und könnte bei einer starken Ausdehnung der Aorta, wie sie bei anstrengender körperlicher Betätigung zu beobachten ist, komprimiert werden.32
Eine weitere Theorie bezieht sich auf den ursprünglichen Verlauf der CAA. Wenn sie interarteriell, zwischen Aorta und Pulmonalarterie, verläuft, würde der Druckanstieg in den beiden Gefäßen, der bei Anstrengung auftritt, eine Kompression der anomalen Koronararterie bewirken.33 Wenn der anfängliche Verlauf intramural ist, kann die Obstruktion außerdem verstärkt werden, da sich die Koronararterie in Zeiten des Bluthochdrucks innerhalb der Aortenwand verformen kann.34
Einige Autoren sind der Ansicht, dass der Mechanismus, der zur Ischämie führt, die Erzeugung eines Spasmus in der anomalen Koronararterie als Folge der Endothelschädigung durch den anomalen Pfad beinhaltet,35 und andere, dass eine Intussuszeption des proximalen Teils der CAA in der Aortenwand erzeugt würde.31
Schließlich können alle besprochenen Mechanismen eine akute oder chronische Ischämie (kleine ischämische Ereignisse) hervorrufen, die eine Myokardfibrose provozieren, die wiederum die Ursache für die Entstehung tödlicher Arrhythmien sein könnte.36
WIE WIRD EINE KORONARE ANOMALIE DIAGNOSIERT?
Die Diagnose erfordert einen hohen Verdachtsindex und die Beurteilung ihres Vorhandenseins unter bestimmten Umständen. Wie bereits erwähnt, werden die meisten CAA zufällig bei Koronarangiographien entdeckt, die bei Patienten mit ischämischer Herzerkrankung oder Klappenerkrankung durchgeführt werden, die sich dieser Untersuchung vor einer Operation zum Klappenersatz unterziehen.
Die größte diagnostische Herausforderung stellen junge Menschen dar, die keine koronaren Risikofaktoren oder eine assoziierte Klappenerkrankung aufweisen. Bei Belastungssynkopen, Dyspnoe oder Brustschmerzen, die auf eine Angina pectoris hindeuten, sollten wir eine CAA vermuten.24,26,35 Der erste diagnostische Test, den wir alle durchführen, ist natürlich die Standardergometrie. Diese hat sich jedoch bei dieser Art von Patienten als nicht sehr nützlich erwiesen, da sie in der Regel negativ ausfällt, was darauf hindeutet, dass eine Ischämie aufgrund von CAA nur gelegentlich auftritt.35,36
Da die „funktionellen“ Tests also nicht sehr hilfreich sind, müssen wir uns für eine bildgebende Untersuchung entscheiden, die es uns ermöglicht, die Koronaranatomie zu untersuchen. Die ursprünglich empfohlene nichtinvasive Untersuchung ist die transthorakale Echokardiographie (TTE).7,26,37-40 Bei den meisten dieser Patienten ermöglicht die Durchführung einer einfachen TTE in der parasternalen Kurzachsenprojektion in der Ebene der Aortenwurzel die Unterscheidung der beiden Koronarostien und sogar die Bestimmung des ursprünglichen Verlaufs der CAA. Pellicia et al. untersuchten 1360 Spitzensportler mittels Echokardiographie und konnten in 97 % der Fälle das Ostium und den proximalen Anteil der linken Hauptkoronararterie und in 80 % der Fälle die rechte Hauptkoronararterie darstellen.41
Kürzlich führten Frommelt et al34 eine Echokardiographie bei allen Kindern und Jugendlichen (Alter zwischen 3 Monaten und 20 Jahren) durch, die mit Symptomen einer myokardialen Ischämie, dem Verdacht auf eine angeborene Herzerkrankung oder muskuloskelettalen Schmerzen in ihr Krankenhaus überwiesen wurden (1997-2002). Bei allen wurde eine konventionelle TTE mit Hilfe der Doppler-Farbflusskartierung durchgeführt, um die Richtung des Blutflusses zu bestimmen. Sie identifizierten 10 Patienten mit anomalem Ursprung einer Koronararterie im falschen Sinus (6 Patienten mit linker Koronararterie, die im rechten Sinus Valsalva entspringt, und 4 mit rechter Koronararterie, die im linken Sinus Valsalva entspringt). Unter Verwendung von TTE mit Farbdopplertechniken beobachteten sie bei neun der Patienten einen intramuralen Verlauf innerhalb der Aortenwand und bei dem verbleibenden Patienten einen intramyokardialen Verlauf. Wenn der Verlauf einer CAA, die aus dem falschen Sinus stammt, intramural ist, kann es so aussehen, als würde sie aus ihrem normalen Ostium austreten. Daher empfehlen die Autoren die Verwendung von Farbdoppler zur Bestimmung der Flussrichtung, wenn es notwendig ist, das Vorhandensein einer Anomalie auszuschließen.
Verbesserte echokardiographische Bildgebungsverfahren ermöglichen es uns, den Ursprung einer CAA zu bestimmen und den anfänglichen Verlauf bei bestimmten Patientengruppen zu verfolgen. Es wurden bereits Studien bei Kindern, Jugendlichen und Leistungssportlern durchgeführt, aber große Serien mit der normalen erwachsenen Bevölkerung müssen noch untersucht werden. Daher sollte die Identifizierung der Koronarostien bei jungen Patienten mit dieser Symptomatik systematisch in der TTE-Untersuchung durchgeführt werden.7,26
Bei Patienten mit einem schlechten echokardiographischen Fenster oder wenn trotz der klinischen Indikationen diagnostische Zweifel bestehen, kann zur Darstellung des Ursprungs und des anfänglichen Verlaufs der CAA eine transösophageale Echokardiographie (TEE),7,26,42,43 eine Computertomographie (CT)26,44-46 – mit Elektronenstrahl oder Multislice – (Abbildung 3) oder eine kardiale Magnetresonanztomographie (CMRI)26,47,48 durchgeführt werden (Abbildung 4).

Abbildung 3. Multidetektor-Computertomographie-Bild, das die Zirkumflex-Koronararterie (Cx) zeigt, die aus der rechten Koronararterie (CD) entspringt und einem retroaortalen Verlauf folgt, um in ihr normales Verteilungsgebiet zu gelangen. Ao steht für Aorta; AP für Pulmonalarterie. Mit freundlicher Genehmigung von Dr. Gabriel C. Fernández, Servicio de Radiología, Hospital Povisa, Vigo, Spanien.
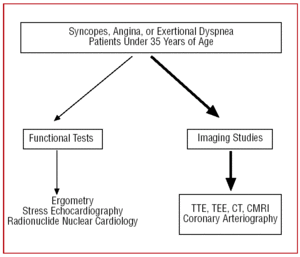
Abbildung 4. Vorgeschlagenes Diagnoseprotokoll bei Patienten unter 35 Jahren mit Verdacht auf eine Koronararterienanomalie. CMRI steht für kardiale Magnetresonanztomographie; CT für Computertomographie; TEE für transösophageale Echokardiographie; TTE für transthorakale Echokardiographie.
Welche Technik sollten wir in welcher Reihenfolge anwenden? Jedes Ärzteteam sollte diese Frage entsprechend den verfügbaren Techniken und seiner Erfahrung beantworten. Wir sollten die CAA und ihren anfänglichen Verlauf mit der am wenigsten invasiven Technik identifizieren, die uns zur Verfügung steht. Obwohl die TEE bei der Diagnose und Identifizierung des anfänglichen Verlaufs einiger CAA eingesetzt wurde, sind wir der Ansicht, dass sie aufgrund ihres semi-invasiven Charakters erst dann eingesetzt werden sollte, wenn andere Techniken versagt haben. Aufgrund der zunehmenden Verfügbarkeit und der ausgezeichneten dreidimensionalen Bilder, die damit gewonnen werden können, erscheint es heute ratsam, sich für die Multidetektor-CT (Abbildung 5) oder für die CMRI zu entscheiden.49,50 Die Standard-Koronararteriographie ist dann angezeigt, wenn die anderen Untersuchungen nicht zu einer definitiven Diagnose führen. Bethesda-Konferenz51 für die Auswahl von Leistungssportlern mit kardiovaskulären Anomalien, die im April 2005 veröffentlicht wurde, empfohlen: „Koronaranomalien sollten bei Sportlern mit Belastungssynkopen oder symptomatischen ventrikulären Arrhythmien in Betracht gezogen und durch geeignete Untersuchungen wie Echokardiographie, CMR oder ultraschnelle Computertomographie untersucht werden. Eine Koronarangiographie ist indiziert, wenn andere Untersuchungen nicht diagnostisch sind“. Kurz gesagt, sie entscheiden sich nicht für die eine oder andere diagnostische Studie.
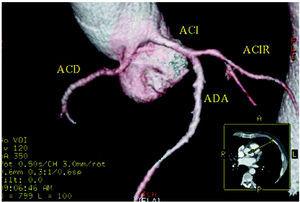
Abbildung 5. Mehrschicht-Computertomographie (16 Schichten); dreidimensional gerenderte Rekonstruktion der rechten Koronararterie (ACD) mit Ursprung im linken Sinus Valsalva. ACI ist die linke Koronararterie; ACIR ist die zirkumflexe Koronararterie; ADA ist die anteriore deszendierende Koronararterie. Mit freundlicher Genehmigung von Dr. Joaquín Alonso, Servicio de Cardiología y Servicio de Diagnóstico por Imagen, Hospital de Fuenlabrada, Madrid, Spanien.
Bei Patienten über 35 Jahren, die sich mit klinischen Anzeichen von Angina pectoris oder wiederholten Synkopen vorstellen, wird nach einem Funktionstest (Ergometrie, Belastungsechokardiographie usw.) in der Regel eine Katheteruntersuchung durchgeführt, da die höhere Inzidenz von Atherosklerose den Verdacht auf eine koronare Herzkrankheit nahelegt. In bestimmten Zentren, die über die entsprechende Technologie verfügen, können Patienten mit einem atypischen klinischen Bild einem ersten Screening mit Multidetektor-CT oder CRMI unterzogen werden. In beiden Fällen wäre ein CAA ein Befund (Abbildung 6).
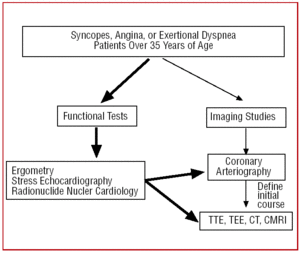
Abbildung 6. Vorgeschlagenes Diagnoseprotokoll bei Patienten über 35 Jahren mit Verdacht auf eine Koronararterienanomalie. CRM bedeutet kardiale Magnetresonanztomographie; CT, Computertomographie; TEE, transösophageale Echokardiographie; TTE, transthorakale Echokardiographie.
Wie wird der anfängliche Verlauf einer koronaren Anomalie erkannt?
Dies ist einer der komplexesten Punkte bei der Untersuchung von CAA und stellt einen grundlegenden Aspekt bei der Risikoidentifizierung dar.
Zunächst müssen wir die Tatsache berücksichtigen, dass der Name und die Art einer Koronararterie durch das Gebiet definiert werden, das sie versorgt, und nicht durch ihren Ursprung. So ist eine Koronararterie, die aus dem rechten Sinus Valsalva entspringt und sich verzweigt, um die Gebiete der vorderen absteigenden Arterie und der Zirkumflexarterie (Cx) zu versorgen, keine rechte Koronararterie, sondern eine linke Hauptkoronararterie mit Ursprung im falschen Sinus. Wenn eine Koronararterie aus dem falschen Sinus entspringt, bleiben der Name, die Art und sogar die Funktion gleich; nur ihr Ursprung und ihr anfänglicher Verlauf sind anomal.2
Nach dem Austritt aus dem falschen Sinus Valsalva kann eine anomale Koronararterie ihr normales Versorgungsgebiet über mindestens fünf verschiedene Wege erreichen2,52:
1. Retrokardial, hinter den Mitral- und Trikuspidalklappen.
2. Retroaortal, in der Regel gefolgt vom Cx mit Ursprung im rechten Sinus Valsalva oder in der rechten Koronararterie, angrenzend an die hintere Aortenwand, in der Furche zwischen dem Vorhof und der Aorta (Quersinus) (Abbildung 3).
3. präaortal oder interarteriell (zwischen Aorta und Pulmonalarterie), wobei die anomale rechte Koronararterie, die linke anteriore deszendierende Koronararterie oder die linke Hauptkoronararterie das Septum oder den aortopulmonalen Raum kreuzen. Dies ist der Verlauf, der am häufigsten mit Anzeichen von Ischämie und/oder plötzlichem Tod in Verbindung gebracht wurde (Abbildungen 7 und 8).
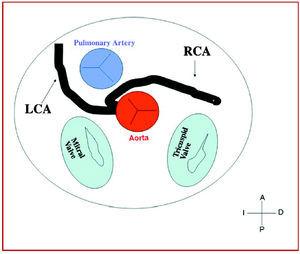
Abbildung 7. Schema des interarteriellen Verlaufs einer rechten Koronararterie (RCA) mit Ursprung im Sinus Controlateralis.
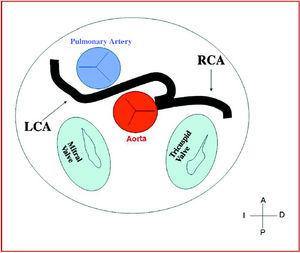
Abbildung 8. Schematische Darstellung des interarteriellen Verlaufs einer linken Koronararterie (LCA) mit Ursprung im Sinus Controlateralis.
4. Intraseptal, durch den oberen Teil des intraventrikulären Septums. Sie ist in den meisten Fällen intramyokardial und wird in der Angiographie an der systolischen Verengung erkannt, die einer Myokardbrücke ähnelt, und daran, dass sich in dieser Zone in der Regel 1 oder 2 septale Perforatoräste befinden (Abbildung 9).

Abbildung 9. Schematische Darstellung des intraseptalen Verlaufs einer linken Koronararterie (CI) mit Ursprung im rechten Sinus Valsalva.
5. Präkardial oder präpulmonal, gekennzeichnet durch seine subepikardiale Lage in der Vorderwand des Ausflusstraktes der rechten Herzkammer oder des Infundibulums. Dieser Passage folgt in der Regel eine anomale rechte Koronararterie, ein linker Hauptstamm oder eine linke anteriore deszendierende Koronararterie.
Weitere mögliche Verläufe oder sogar mehrere Verläufe bei einem bestimmten Patienten sind berichtet worden.2
Wie können diese anfänglichen Verläufe durch Koronarangiographie identifiziert werden? Ursprünglich ging man davon aus, dass die Einführung eines Führungsdrahtes in die Lungenarterie und die anschließende Koronararteriographie in Seitenprojektion ausreichen würden, um die Beziehung zwischen der Anomalie und den großen Gefäßen zu bestimmen. Diese Technik ist jedoch nur von begrenztem Wert, da z. B. in der seitlichen Ansicht sowohl der septale als auch der interarterielle Verlauf posterior zur Pulmonalarterie und anterior zur Aorta zu liegen scheinen, während der septale Verlauf in Wirklichkeit kaudal zu beiden Gefäßen liegt.53
Es wurde auch über verschiedene koronarangiographische Merkmale zur Erkennung der Anomalie und ihres anfänglichen Verlaufs, sogar vor der Visualisierung, berichtet. In diesem Zusammenhang schlagen Page et al.54 zwei Zeichen vor, die es uns ermöglichen, einen anomalen Ursprung des Cx und seinen anfänglichen Verlauf zu erkennen:
1. Das Zeichen des „unperfundierten Myokards“. Bei der selektiven Eintrübung der linken Koronararterie kann ein avaskulärer Bereich in der posterolateralen Zone des linken Ventrikels beobachtet werden, der auf einen anomalen Ursprung des Cx hinweist. Zunächst muss ein Kontrastmittel in den linken Koronarsinus injiziert werden, um die Beteiligung von Ostien auszuschließen, die unabhängig von den anterioren absteigenden Arterien und dem Cx sind. Wenn die Identifizierung der Cx jedoch nicht eindeutig ist, sollte man bedenken, dass es häufiger vorkommt, dass die Cx aus dem rechten Koronarsinus oder der rechten Koronararterie stammt, als dass separate Ostien im linken Koronarsinus vorhanden sind.55
2. Das „Aortenwurzelzeichen“. In der Ventrikulographie zeigt die rechte anteriore Schrägprojektion die Kontur der anomalen Cx und folgt ihrem Verlauf hinter dem rechten Koronarsinus (Abbildung 10).
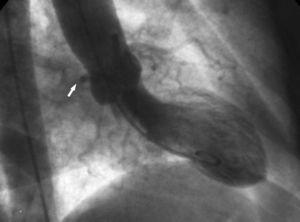
Abbildung 10. Ventrikulographie in der rechten anterioren Schrägprojektion, die die Kontur der anomalen Zirkumflexarterie (Pfeil) zeigt, die hinter dem rechten Koronarsinus verläuft; dies ist als Aortenwurzelzeichen oder Page-Zeichen bekannt.
Im Jahr 1985 schlugen Ishikawa et al.56 , gefolgt von Serota et al. im Jahr 1990,57 eine Reihe von koronararteriographischen Kriterien vor, die die Beziehung zwischen dem anomalen Gefäß und der Aorta und der Pulmonalarterie entlang des anfänglichen Verlaufs definieren sollten (Abbildung 11). Diese Autoren versuchten, die verschiedenen Verläufe anhand der Ausrichtung der von der anomalen Koronararterie gebildeten „Schleife“ mit dem Rest des Koronarbaums56 oder durch Anwendung des Konzepts des „Punktes“ (Visualisierung der Kontrastmittelsäule der CAA, die aufgrund der von ihr vollzogenen Drehung die Morphologie eines Punktes annimmt57) zu identifizieren.
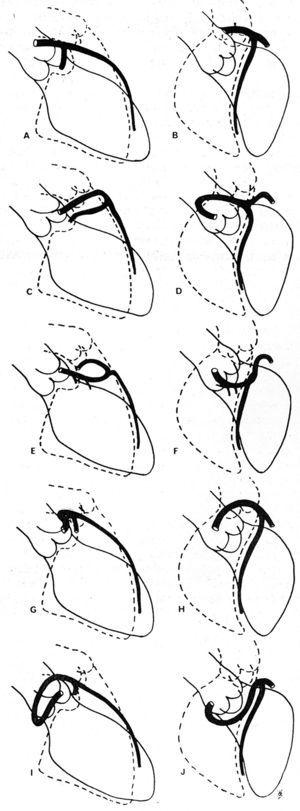
Abbildung 11. Illustrationen von Koronarangiographiec-Bildern der linken anterioren absteigenden und proximalen zirkumflexen Koronararterien in rechter anteriorer Schrägprojektion (A, C, E, G, I) und in linker anteriorer Schrägprojektion (B, D, F, H, J), die die verschiedenen möglichen Anfangsverläufe einer linken Koronararterie mit Ursprung im rechten Sinus Valsalva zeigen. A und B stellen eine normale Koronararterie dar; C und D zeigen eine anterokraniale „Schleife“, beschrieben im anterioren Verlauf; E und F: anterokaudale „Schleife“, septaler Verlauf; G und H: posterokraniale „Schleife“, interarterieller Verlauf; I und J: posterokaudale „Schleife“, retroaortaler Verlauf. Entnommen aus Ishikawa et al.56
In vielen Fällen ist die Identifizierung des ursprünglichen Verlaufs der CAA mittels Koronarangiographie schwierig, da diese Technik eine zweidimensionale Ansicht des Koronarbaums liefert, der eine komplexe dreidimensionale Struktur ist. Für einen in der Diagnose von CAA erfahrenen interventionellen Kardiologen kann die Koronarangiographie zur korrekten Identifizierung des Verlaufs ausreichend sein. Angesichts ihrer geringen Häufigkeit haben die meisten interventionellen Kardiologen jedoch nur begrenzte Erfahrung mit der Untersuchung von CAA. Daher werden sie in der überwiegenden Mehrheit der Fälle nicht richtig beschrieben. In einem kürzlich erstellten Register, an dem 13 spanische Krankenhäuser beteiligt waren, wurde der anfängliche Verlauf der gemeldeten CAA in der Mehrzahl der Fälle nicht identifiziert.16
Die Identifizierung des anfänglichen Verlaufs einer CAA mit Ursprung im falschen Sinus erfordert daher in vielen Fällen ein zusätzliches bildgebendes Verfahren. Wie bereits erwähnt, können sowohl TTE als auch TEE zu diesem Zweck eingesetzt werden, aber angesichts der zunehmenden Verfügbarkeit nichtinvasiver Techniken in unseren Krankenhäusern, die eine korrektere und genauere Definition der Koronaranatomie und ihrer Beziehung zu den angrenzenden Strukturen bei Patienten, die für eine Operation in Frage kommen, ermöglichen, entscheiden wir uns für CMRI oder Multidetektor-CT.35,37,47,49
WAS IST DER BESTE THERAPEUTISCHE ANSATZ?
Dies ist einer der umstrittensten Aspekte dieser Erkrankung, da es diesbezüglich keine offiziellen Leitlinien gibt.
Wenn die CAA diagnostiziert und charakterisiert ist, erscheint es logisch, zu versuchen festzustellen, ob sie eine Myokardischämie verursacht oder nicht. Wenn der Patient einen Myokardinfarkt hatte (ohne nachweisbaren Zusammenhang mit Atherosklerose) oder wegen eines plötzlichen Todes, der auf die Anomalie zurückzuführen ist, reanimiert wurde und unter 35 Jahre alt ist, empfehlen die meisten Autoren eine Revaskularisation.24,26,35
Ein Thallium-Belastungstest oder eine Echokardiographie unter medikamentöser oder körperlicher Belastung, die eine reversible Ischämie im Gebiet der Anomalie nachweist, hilft bei der Entscheidungsfindung.36
Was ist bei jungen, asymptomatischen Personen zu tun, bei denen ein CAA zufällig entdeckt wird, wenn die Risikokriterien erfüllt sind, der Belastungstest aber keinen Hinweis auf eine Ischämie ergibt? Zunächst sollte der Patient einen sitzenden Lebensstil pflegen.26,35
Corrado et al. verglichen plötzliche Todesfälle bei jungen Sportlern und Nicht-Sportlern, und nur diejenigen, die auf ein CAA oder eine arrhythmogene rechtsventrikuläre Dysplasie zurückgeführt wurden, waren mit der Belastung assoziiert.58 Was die Behandlung anbelangt, so ist die Revaskularisierung umstritten, aber es gibt Autoren, die sich für diesen Ansatz entscheiden, da der plötzliche Tod bei diesen Patienten unvorhersehbar ist und das erste Anzeichen eines CAA sein kann.24,26,34,35 Einige Autoren befürworten in diesen Fällen jährliche Kontrolluntersuchungen mit Echokardiogrammen oder Thallium-Belastungstests und stützen ihre Entscheidungen auf die Ergebnisse.7,36 Nach der chirurgischen Behandlung können die Patienten ein normales Leben führen und Sport treiben.25,34,49
Bei Patienten, die älter als 35 Jahre sind, müssen die Entscheidungen auf individueller Basis getroffen werden. Das Risiko eines plötzlichen Todes ist geringer, aber da CAA eine symptomatische Myokardischämie hervorrufen kann, wird in einigen Fällen eine Revaskularisierung durchgeführt (Abbildung 12).24,26
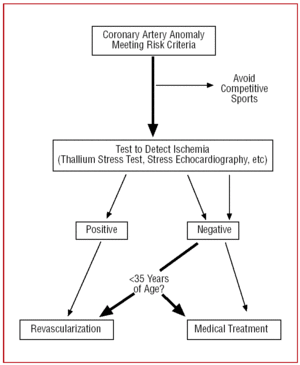
Abbildung 12. Vorgeschlagenes Therapieprotokoll für Koronaranomalien mit Ursprung im kontralateralen Sinus Valsalva bei Vorhandensein von Risikofaktoren.
Einige Gruppen untersuchen den Einsatz bestimmter Diagnoseprotokolle (intrakoronare Echokardiographie zur Beurteilung des anomalen Koronarostiums in Ruhe und nach Dobutamininfusion oder Flüssigkeitsüberlastung)59 oder den Einsatz intrakoronarer Druckdrähte zur Erkennung einer Ischämie.60
Wie zu beobachten ist, scheint der vernünftigste Ansatz darin zu bestehen, erstens zu bestätigen, ob das Alter des Patienten und die Anatomie des CAA mit dem Risiko assoziiert sind, und zweitens zu überprüfen, ob die (vom Patienten dargestellte oder nachgewiesene) koronare Ischämie eindeutig durch die Anomalie provoziert wird.
WIE WIRD DIE REVASKULARISIERUNG DURCHGEFÜHRT?
Logischerweise muss jeder Fall individuell entsprechend der Koronaranatomie behandelt werden; daher kann die Revaskularisierung entweder chirurgisch oder perkutan erfolgen.
Die chirurgische Revaskularisation umfasst den aortokoronaren Bypass, die ostiale Reimplantation oder die Unroofing-Technik, bei der das intramurale Segment der CAA durch einen Schnitt in der gemeinsamen Wand von CAA und Aorta freigelegt wird und so eine neue, größere Öffnung im entsprechenden Sinus entsteht.61,62 Die chirurgische Revaskularisation bei diesen Patienten, insbesondere bei jungen Menschen, ist sehr umstritten. Aortokoronare Bypass-Transplantationen wurden wegen ihrer „begrenzten“ Durchgängigkeit und der unvermeidlichen Konkurrenz zwischen Bypass und CAA stark kritisiert7,63. Daher wird zunehmend die Technik des „unroofing“ angewandt, die physiologischer zu sein scheint62.
Die perkutane Intervention mit Implantation von Stents im Bereich der Kompression zwischen den großen Gefäßen und im anomalen Ostium wurde in mehreren Fällen bei Erwachsenen mit kurzfristigem Erfolg durchgeführt.64 Bis heute wird die chirurgische Revaskularisation bei jungen Patienten bevorzugt und das perkutane Verfahren nur bei Erwachsenen durchgeführt.26,62-64 Offensichtlich ist in beiden Fällen eine langfristige Nachbeobachtung erforderlich.
Ist die medikamentöse Behandlung eine Option?
Das Fehlen von Serien und kontrollierten Studien macht es schwierig, diese Frage zu beantworten. Es gibt Berichte über die 2-Jahres- und 5-Jahres-Nachbeobachtung bei Patienten, die eine Operation ablehnten, bei denen entweder ein Erwartungsmanagement oder eine Behandlung mit Betablockern durchgeführt wurde, und bei denen keine Fälle von plötzlichem Tod auftraten.65-68 Einige Autoren sprechen sich jedoch gegen die Entscheidung aus, bei Kindern und Jugendlichen eine „lebenslange“ Behandlung einzuleiten.7
GRÖSSERE UNGELÖSTE PROBLEME
Das tatsächliche Risiko eines plötzlichen Todes bei jeder Anomalie ist unbekannt.5 Der Grund dafür ist, dass das Risiko auf der Grundlage von Autopsiestudien berechnet wird, die nicht das tatsächliche Risiko einer Person angeben, an den Folgen eines CAA zu sterben, sondern die Möglichkeit nahelegen, dass eine Person, die einen plötzlichen Tod erlitten hat, ein CAA hat.7 Darüber hinaus können die berechneten Risiken im Vergleich zur Allgemeinbevölkerung überschätzt werden, da sie aus Serien von Leistungssportlern stammen, die, wie berichtet wurde, ein zweifach höheres Risiko für einen plötzlichen Tod haben als eine sitzende Person.69 Wir wissen, dass das Risiko eines plötzlichen Todes aufgrund eines KHK bei jungen Menschen größer ist; tatsächlich wird der eine oder andere therapeutische Ansatz empfohlen, je nachdem, ob der Patient jünger als 30 oder 35 Jahre alt ist. Diese Grenzwerte beruhen auf den wenigen Studien, die sich mit diesem Thema befassen23,25 , und sind daher nur als Richtwerte zu betrachten. Aus diesem Grund sollte das therapeutische Vorgehen immer individuell entschieden werden.
Wenn die oben beschriebene chirurgische Lösung gewählt wird, muss berücksichtigt werden, dass es keine Serien gibt, in denen der Verlauf der Patienten über mehr als zwei Jahre untersucht wurde. Zu der Ungewissheit über die Durchgängigkeit des Bypasses kommt die mögliche Schädigung der Aortenklappe hinzu, die durch die Aufhebung des Daches entstehen kann. Diesbezüglich gibt es Berichte über Aorteninsuffizienz oder sogar Aortenklappenersatz nach diesem Eingriff.7,70 Es ist zu bedenken, dass Herzoperationen immer das Risiko neurologischer Komplikationen mit sich bringen, deren Häufigkeit bei Jugendlichen auf etwa 2,3 % geschätzt wird.71
Schließlich empfehlen die Leitlinien für die Auswahl von Leistungssportlern mit kardiovaskulären Anomalien den Ausschluss von Patienten mit CAA von allen Leistungssportarten.51 Auch hier wurden die Daten einer Sportlerpopulation auf die Allgemeinbevölkerung extrapoliert. Bei einem Heranwachsenden ist der Begriff „Leistungssport“ möglicherweise schwer zu definieren. Außerdem kann es mehr schaden als nutzen, einem Jugendlichen oder jungen Erwachsenen die Teilnahme am Sportunterricht oder an der Sportart zu verbieten, die er oder sie gerne betreibt. Vielleicht sollte anstrengender Sport vermieden werden, nicht aber eine weniger anspruchsvolle Sportart.7
ZUSAMMENFASSUNG
Koronararterien, die ihren Ursprung im falschen Sinus Valsalva haben, stellen die Gruppe der CAA dar, die am häufigsten mit Myokardischämie und insbesondere mit plötzlichem Tod in Verbindung gebracht werden.
Der Verdachtsindex für diese Anomalie sollte bei jungen Patienten mit klinischen Anzeichen von Angina pectoris, Dyspnoe oder Belastungssynkopen hoch sein. In diesen Fällen sollte eine TTE durchgeführt werden, um die Ostien und den anfänglichen Verlauf beider Koronararterien zu identifizieren.
Wir sollten den anfänglichen Verlauf jeder anomalen Koronararterie klar definieren, indem wir bildgebende Verfahren wie TTE, TEE oder vorzugsweise Multidetektor-CT oder CMRI entsprechend den Merkmalen unseres Krankenhauses einsetzen.
Wir müssen der Einrichtung von nationalen und internationalen Registern Vorrang einräumen, die es uns ermöglichen, die Häufigkeit dieser Anomalien sowie die damit verbundenen Morbiditäts- und Mortalitätsraten, die Prognose, die Behandlung, mögliche genetische oder umweltbedingte Einflüsse zu bestimmen und, kurz gesagt, so viel wie möglich darüber zu erfahren.
Es ist notwendig, eine langfristige Nachbeobachtung von Patienten durchzuführen, die wegen CAA operiert wurden, insbesondere von jungen Menschen. In jedem Fall kann eine Revaskularisierung (chirurgisch oder perkutan) für Patienten mit dieser Art von Erkrankung sinnvoll sein.
DANKSAGUNG
Wir danken Dr. Joaquín Alonso und Dr. Gabriel C. Fernández für ihre Hilfe bei der Beschaffung der Multidetektor-Computertomographie-Bilder.