Das Immunsystem
Das Immunsystem besteht aus Geweben, Zellen und Molekülen, deren Hauptfunktion darin besteht, Krankheitserreger und veränderte Zellen zu erkennen, auf sie zu reagieren und sie zu eliminieren.
Anlagebedingte und adaptive Immunantwort
Es gibt zwei Hauptkomponenten des Immunsystems: 1) das angeborene Immunsystem und 2) das adaptive Immunsystem. Das angeborene Immunsystem fungiert als erste Verteidigungslinie und erkennt Krankheitserreger über keimbahnkodierte Mustererkennungsrezeptoren, bildet kein Gedächtnis und reagiert schnell (innerhalb von Minuten bis Stunden). Das adaptive Immunsystem reagiert langsam (über Tage), verwendet antigenspezifische Rezeptoren, die während der Entwicklung mehrere Genumstellungen durchlaufen, und bildet ein immunologisches Gedächtnis – es „lernt“ aus der ersten Beleidigung und bereitet den Körper darauf vor, künftige Belastungen durch ähnliche Schadstoffe zu bekämpfen. Beide Arten von Immunreaktionen können entweder durch Makromoleküle in der extrazellulären Flüssigkeit oder durch die Aktivierung spezifischer Immunzellen ausgelöst werden. Diese Reaktionen werden als humorale Immunität bzw. zellvermittelte Immunität bezeichnet.
Im Rahmen der zellvermittelten Immunantwort werden die Immunzellen meist danach geschichtet, ob es sich um eine angeborene oder eine adaptive Reaktion handelt. Das angeborene Immunsystem besteht hauptsächlich aus phagozytischen Zellen wie Neutrophilen, Makrophagen, natürlichen Killerzellen, Basophilen und anderen, die sich gegen gefährliche eindringende Organismen richten. Die Zellen des adaptiven Immunsystems sind T-Zellen und B-Zellen. Natürliche Killer-T-Zellen (NK-Zellen) weisen Merkmale sowohl der angeborenen als auch der adaptiven Immunzellen auf. Darüber hinaus können die meisten anderen Zelltypen, die nicht spezifisch für das Immunsystem sind, intrinsische Funktionen des angeborenen Immunsystems in Form von zytoplasmatischen Rezeptoren und Signal- und Effektormolekülen wie Mitglieder der RIG-I-, STING- und NLR-Familien beherbergen. Wie wir weiter ausführen werden, entstehen die Zellen beider Systeme aus verschiedenen myeloischen und lymphoiden Linien hämatopoetischer Stammzellen.
Komponenten des Immunsystems
Reife Immunzellen differenzieren sich aus so genannten hämatopoetischen Stammzellen. Das sind pluripotente, undifferenzierte Vorläuferzellen, die im Knochenmark, im peripheren Blut und in der Plazenta vorkommen. Diese hämatopoetischen Stammzellen können sich in die gemeinsame myeloide Vorläuferzelle oder die gemeinsame lymphoide Vorläuferzelle differenzieren.
Lymphoide Zellen
Gemeinsame lymphoide Vorläuferzellen können sich in vier Hauptpopulationen von Lymphozyten differenzieren, die sich durch die Expression von Zelloberflächenrezeptoren unterscheiden lassen: T-Zellen, B-Zellen, natürliche Killerzellen (NK) und NK-T-Zellen.
T-Zellen
T-Zellen spielen eine entscheidende Rolle bei der zellvermittelten Immunität. Diese Zellen sind durch die Expression von CD3-T-Zell-Signalketten gekennzeichnet.
T-Zellen entstehen aus lymphoiden Vorläuferzellen, die sich ursprünglich aus hämatopoetischen Stammzellen im Knochenmark entwickeln. Sobald sich die lymphoide Vorläuferzelle entschlossen hat, eine T-Zelle zu werden, wandert sie vom Knochenmark in den Thymus (daher der Name T-Zelle). Der Thymus bietet die geeignete Mikroumgebung, in der sich T-Zellen zu ihren verschiedenen Subtypen entwickeln können, die durch die spezifischen Rezeptoren auf der Zelloberfläche definiert sind. Den reifenden T-Zellen im Frühstadium, den Thymozyten, fehlen Rezeptoren sowohl für CD4 als auch für CD8, weshalb sie als doppelt negative (DN) Zellen bezeichnet werden. Die DN-Zellen durchlaufen dann genetische Umlagerungen und Mutationen in den Genen, die für die Alpha- und Beta-T-Zellrezeptoren (TCR) kodieren, wodurch sie einen Weg der Abstammungsbindung einschlagen, dessen Endergebnis ein T-Zellrezeptor mit spezifischer Affinität für ein bestimmtes Antigen ist.
Die Thymozyten werden dann sowohl positiv als auch negativ selektiert, um sicherzustellen, dass sie „fremde“ Antigene erkennen, nicht aber Wirtsantigene, die als Peptide über den MHC auf der Zelloberfläche präsentiert werden. Nur Zellen, die beide Tests bestehen, werden dann zur Expression von CD4 und CD8 angeregt und werden so zu doppelt-positiven Zellen. Am Ende der Reifung exprimieren die T-Zellen entweder CD4 oder CD8 (und verlieren die Expression des jeweils anderen) und werden so zu einfach-positiven Zellen. Diese reifen CD4- oder CD8-positiven T-Zellen werden dann in den Blutkreislauf entlassen und befinden sich zunächst im naiven Zustand, was bedeutet, dass sie sich noch nicht auf einen bestimmten T-Zell-Subtyp festgelegt haben.
Zeigt der reifende Thymozyt während der Reifung eine mittlere Affinität zu Selbst-MHC-Peptiden, kann er aufgrund seiner Fähigkeit, schädliche „Selbst“-Antigene zu erkennen, zu einer regulatorischen T-Zelle (Treg) selektiert werden. T-Zellen im Blut oder in peripheren Geweben können auch lokal dazu gebracht werden, zu Tregs zu werden. Die Hauptaufgabe der Tregs besteht darin, die Toleranz gegenüber Selbstantigenen aufrechtzuerhalten und die Funktion und Vermehrung der T-Effektorzellen zu begrenzen.
Sobald sie im Blut oder im peripheren Gewebe angekommen sind, können naive T-Zellen dazu veranlasst werden, zu T-Helferzellen zu werden. Antigen-präsentierende Zellen (APCs) wie Makrophagen, dendritische Zellen und B-Zellen zeigen der T-Zelle das Antigen, und wenn ihr Rezeptor eine Affinität hat, erkennt die T-Zelle das Antigen. Typischerweise sind CD4+ T-Zellen in der Lage, an MHC-Proteine der Klasse II gebundene Peptidantigene zu erkennen. Sobald der Peptid-MHC-Komplex erkannt wurde, aktiviert die T-Zelle eine Reihe interner Signalwege, die eine Überprüfung der Antigenerkennung ermöglichen. Erst dann vermehrt sich die T-Helferzelle und vergrößert den Pool der verfügbaren Zellen, die spezifisch für das schädliche Antigen sind, z. B. verschiedene Bakterien und Parasiten.
Sobald die T-Helferzellen ihr Antigen erkannt haben und aktiviert werden, setzen sie eine Vielzahl von Zytokinen frei, d. h. Moleküle, die anderen Immunzellen signalisieren, wie sie angemessen auf das schädliche Molekül reagieren sollen. Es gibt mehrere Untergruppen von T-Helferzellen, darunter Th1, Th2 und Th17. Diese Untergruppen produzieren und sezernieren unterschiedliche Zytokine, die dazu beitragen, die Immunantwort je nach Art des Krankheitserregers zu steuern. So sind Th1-Zellen beispielsweise auf das Effektor-Zytokin IFN-γ angewiesen, um Makrophagen zu signalisieren, das schädliche Material zu verdauen und zu zerstören, während Th2-Zellen eine Kombination aus IL-4, IL-5, IL-9, IL-10 und IL-13 absondern, um Basophile, Eosinophile und andere Zellen zur Bekämpfung der Infektion zu veranlassen. Die spezifische Menge und Art der Zytokine bestimmt die angemessene Reaktion auf die Infektion oder die schädliche Zelle. T-Zellen können auch auf körpereigene Zellen reagieren, indem sie zu zytotoxischen T-Zellen (oder natürlichen Killer-T-Zellen) werden. Dabei handelt es sich in der Regel um CD8+-Zellen, die virusinfizierte Zellen oder Tumorzellen erkennen. Natürliche Killer-T-Zellen (NKTs) werden in einem späteren Abschnitt ausführlicher behandelt. Diese und andere Arten von T-Zellen erfüllen ihre verschiedenen Aufgaben oder Effektorfunktionen auf unterschiedliche Weise, um schädliches Material zu erkennen und andere Immunzellen zu dessen Zerstörung zu rekrutieren sowie eine dauerhafte Immunantwort auf dieselbe Art von Beleidigung aufzubauen.
Der interaktive Weg der T-Zell-Rezeptor-Signalübertragung wird hier im Detail beschrieben.
CD3ε (D7A6E™) XP® Rabbit mAb #85061: IHC-Analyse eines in Paraffin eingebetteten menschlichen Mammakarzinoms mit #85061.
CD3ε (D7A6E™) XP® Rabbit mAb #85061: IHC-Analyse eines in Paraffin eingebetteten menschlichen Mammakarzinoms unter Verwendung von #85061.
CD4 (D7D2Z) Kaninchen-mAb #25229: IHC-Analyse eines in Paraffin eingebetteten metastatischen 4T1-Tumors in der Mauslunge unter Verwendung von #25229.
CD4 (D7D2Z) Kaninchen-mAb #25229: IHC-Analyse eines in Paraffin eingebetteten metastatischen 4T1-Tumors in der Lunge einer Maus unter Verwendung von #25229.
CD8α (D4W2Z) XP® Rabbit mAb (Mouse Specific) #98941: IHC-Analyse einer in Paraffin eingebetteten Mauslunge unter Verwendung von #98941.
CD8α (D4W2Z) XP® Rabbit mAb (Mouse Specific) #98941: IHC-Analyse einer in Paraffin eingebetteten Mauslunge unter Verwendung von #98941.
FoxP3 (D6O8R) Kaninchen-mAb #12653: IHC-Analyse eines in Paraffin eingebetteten metastatischen 4T1-Tumors in der Mauslunge unter Verwendung von #12653.
FoxP3 (D6O8R) Kaninchen-mAbk #12653: IHC-Analyse eines in Paraffin eingebetteten metastatischen 4T1-Tumors in der Lunge einer Maus unter Verwendung von #12653.
B-Zellen
B-Zellen sind die entscheidenden Zellen im Blut, die die Antikörperproduktion vermitteln. Wenn schädliches Material im Blutkreislauf vorhanden ist, wird es von spezifischen Rezeptoren auf den B-Zellen als Antigen erkannt. Nach der Verarbeitung des Antigens und mit Hilfe von T-Zellen reifen die B-Zellen zu Plasmazellen heran, die Antikörper absondern. B-Zellen können auch bei der Präsentation von Antigenen und der Zytokinsekretion eine Rolle spielen. Es werden sowohl die Entwicklung als auch die verschiedenen Funktionen der B-Zelle besprochen.
15 % der im peripheren Blut vorkommenden Leukozyten sind B-Zellen. B-Zellen produzieren Immunglobuline (Ig), das sind antigenbindende Proteine (auch Antikörper genannt), die aus zwei identischen schweren Ketten und zwei identischen leichten Ketten bestehen. Diese Immunglobuline enthalten spezifische Antigenbindungsstellen, die sich in der Aminosäuresequenz von einem Antikörpermolekül zum anderen unterscheiden. Diese Stellen verleihen jedem Antikörper die Spezifität für die Erkennung eines bestimmten Antigens.
Wie bereits erwähnt, differenzieren sich B-Zellen aus hämatopoetischen Zellen im Knochenmark. Im Knochenmark werden die Oberflächen-Ig-Rezeptoren (Antikörper) durch einen Prozess der Genumlagerung aufgebaut. B-Zellen nutzen die somatische Verbindung verschiedener Gene auf einer Vielzahl von Chromosomen, die für die verschiedenen Teile der schweren und leichten Ketten kodieren, aus denen die Ig bestehen. Die B-Zellen werden durch die Produktion von IL-7 durch die Stromazellen des Knochenmarks zur Differenzierung angeregt. Diese sich entwickelnden B-Zellen folgen einem Programm aufeinander folgender Umlagerungen der schweren und leichten Ketten, die durch eine unterschiedliche Expression von Rezeptoren an der Zelloberfläche vermittelt werden. So verhindert die Expression eines bestimmten Prä-B-Zellrezeptors bestimmte Genumlagerungen auf nicht verwandten Chromosomen, um sicherzustellen, dass die reife B-Zelle einen bestimmten Ig-Oberflächenrezeptor exprimieren kann, der in der Lage ist, ein einzelnes Antigen spezifisch zu erkennen. Dieser Vorgang wird als allelischer Ausschluss bezeichnet. Ein fehlerhafter Zusammenbau der schweren und leichten Ig-Ketten kann eine sekundäre Umlagerung zur Rezeptorbearbeitung auslösen.
Neben der Expression eines Ig-Rezeptors an der Zelloberfläche enthalten B-Zellen auch Transmembranproteine, die intrazelluläre Signale auslösen können, nachdem ein Antigen an den extrazellulären Teil des Ig-Rezeptors gebunden hat. B-Zellen nutzen ähnliche intrazelluläre Signalkaskaden wie T-Zellen, die Transkriptionsveränderungen hervorrufen, die zu Proliferation und Reifung führen. Insbesondere können die intrazellulären Domänen des Ig-Rezeptors durch die src-Familie von Kinasen phosphoryliert werden, wodurch eine Kaskade in Gang gesetzt wird, die von der Tyrosinkinase Syk und einem als BLINK bekannten Linkerprotein an die Phospholipase C und Guanin-Austauschfaktoren weitergegeben wird und schließlich die Proteinkinase C aktiviert, Kalzium mobilisiert und die MAP-Kinase in einer Ras/Rac-abhängigen Weise aktiviert.
Ein einzigartiges Merkmal von B-Zellen ist ihre Fähigkeit, einen Isotypwechsel vorzunehmen. Dies bezieht sich speziell auf einen Prozess der DNA-Umordnung, der leicht unterschiedliche schwere Ketten erzeugen kann. Darüber hinaus kann das alternative Spleißen von Exons der schweren Kette es dem Ig ermöglichen, an der Zelloberfläche gebunden zu bleiben oder sezerniert zu werden, wenn das Transmembran-Exon abgespalten wird. Alternatives Spleißen und Isotypwechsel werden durch von T-Zellen stammende Zytokine induziert. Darüber hinaus können T-Zellen somatische Mutationen induzieren, die zu Veränderungen innerhalb der Antigenbindungsstellen der Ig der B-Zellen führen. Eine selbstkorrigierende B-Zellfunktion kann erkennen, ob diese scheinbar zufälligen Mutationen zu einem Verlust der Affinität für das Antigen führen und ein Programm zum Zelltod einleiten. So lösen Antigene, die sowohl T-Zellen als auch B-Zellen aktivieren, eine T-Zell-vermittelte B-Zell-Reifung durch Isotyp-Switching und somatische Mutationen aus, die beide in hohem Maße mit dem B-Zell-Gedächtnis verbunden sind.
Gedächtnisreaktionen sind durch eine schnelle und umfangreiche Produktion von Ig mit hoher Affinität zu solchen Antigenen gekennzeichnet. Die Entwicklung dieser Gedächtnisreaktionen ist entscheidend für den Erfolg einer Impfung. Sie können aber auch Autoimmunität und allergische Reaktionen verstärken.
Eine T-Zell-unabhängige B-Zell-Aktivierung durch ein Antigen kann ebenfalls stattfinden; diese Art der Aktivierung ist jedoch mit einem schwachen Immungedächtnis verbunden. Außerdem müssen diese Antigene polymer sein, um B-Zellen zu aktivieren.
NB: Zytokine oder Interleukine (ILs) sind sezernierte Moleküle, die auf Transmembranrezeptoren an der Zelloberfläche wirken. Nach der Bindung aktivieren diese Zytokine intrazelluläre Signaltransduktionswege, die typischerweise von der Jak-STAT-Signalübertragung abhängen.
Der interaktive Signalweg der B-Zell-Rezeptoren wird hier im Detail beschrieben.
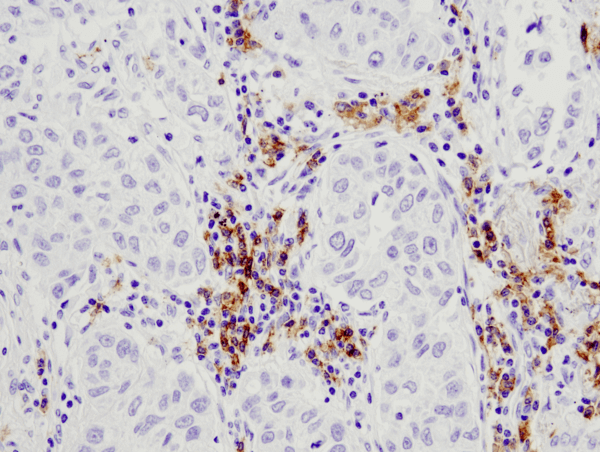
CD19 (D4V4B) XP® Rabbit mAb #90176: IHC-Analyse eines in Paraffin eingebetteten menschlichen Lungenkarzinoms unter Verwendung von #90176.
CD19 (D4V4B) XP® Rabbit mAb #90176: IHC-Analyse eines in Paraffin eingebetteten menschlichen Lungenkarzinoms unter Verwendung von #90176.
NK-Zellen
Natürliche Killer- oder NK-Zellen sind ein weiterer Zelltyp, der aus der lymphoiden Linie stammt. Ähnlich wie die B-Zellen entwickeln sie sich im Knochenmark in Abhängigkeit von Zytokinen und Stromazellen des Knochenmarks. Sie machen nur einen kleinen Teil des peripheren Blutes aus und haben keine antigenspezifischen Rezeptoren. Stattdessen sind NK-Zellen auf einen komplexen Satz von Transmembranrezeptoren angewiesen. Insbesondere enthalten sie hemmende Zelloberflächenrezeptoren, die HLA-Moleküle der Klasse I erkennen und somit durch Selbst-MHC-Moleküle gehemmt werden, so dass sie nur Zellen abtöten, die eine herunterregulierte Klasse-I-HLA-Expression aufweisen. Daher erfüllen sie den wichtigen Zweck, virusinfizierte Zellen und Tumorzellen zu bekämpfen, deren Klasse-I-HLA-Expression herunterreguliert ist, um dem Tod durch CD8+ natürliche Killer-T-Zellen (NK-T) zu entgehen. NK-Zellen können auch antikörper-, interferon- oder zytokinabhängig aktiviert werden und daher eine wichtige Rolle bei der Tumorbekämpfung spielen. Der Wirkmechanismus von NK-Zellen beruht auf der Freisetzung kleiner Granula, die Granzyme und Perforin enthalten, aus ihrem Zytoplasma. Nach ihrer Freisetzung können diese Proteine Poren bilden und intrazelluläre Proteine abbauen, um die Apoptose einzuleiten. Daher werden NK-Zellen als zytotoxisch bezeichnet.
NK-T-Zellen sind ein spezieller Subtyp von T-Zellen, die bestimmte Rezeptoren und Marker exprimieren, die typischerweise von NK-Zellen in Kombination mit einem begrenzten Repertoire von T-Zell-Rezeptoren exprimiert werden. Daher hat dieser einzigartige Subtyp Eigenschaften sowohl von T-Zellen als auch von NK-Zellen. Im Gegensatz zu NK-Zellen, die sich im Knochenmark entwickeln, entstehen NK-T-Zellen im Thymus.
Myeloide Zellen
Gemeinsame myeloide Vorläuferzellen, die von hämatopoetischen Stammzellen abstammen, lassen mehrere verschiedene Arten von myeloiden Zellen entstehen, darunter Makrophagen, dendritische Zellen und verschiedene andere angeborene Immunzellen und Blutzellen.
Makrophagen
Makrophagen können ausgelöst werden, um Antigene, wie geschädigte Zellen oder Fremdmaterial, zu erkennen und bei Bedarf zu zerstören. Makrophagen sind in den meisten Geweben vorhanden und reagieren bei Bedarf auf Infektionen und absterbende Zellen. Das erkannte Material wird durch Phagozytose im Makrophagen zerstört, was den Zellen ihren Namen gibt („großer Fresser“ auf Griechisch). Makrophagen nehmen an verschiedenen Orten unterschiedliche Formen an und können neben der Phagozytose weitere Funktionen erfüllen.
Nach einer Gewebeverletzung oder einer Infektion mit einem Krankheitserreger werden Monozyten aus dem Blut in das betroffene Gewebe rekrutiert und differenzieren sich zu Makrophagen. Je nach Gewebelokalisation gibt es verschiedene Arten von Makrophagen, z. B. Kupffer-Zellen in der Leber, alveoläre Makrophagen in der Lunge, Mikroglia im Gehirn usw. Diese verschiedenen Arten von Makrophagen stammen alle von Monozyten ab, sind aber in ihrer Funktion auf das jeweilige Gewebe spezialisiert. Der Großteil der allgemeinen Phagozytosefunktion wird von gewebeansässigen Makrophagen ausgeführt. Neben der Phagozytose von toten Zellen und Fremdmaterial können Makrophagen auch über Zytokine Signale an andere Immunzellen senden. Bis zu einem gewissen Grad übernehmen Makrophagen die kritische Funktion der Antigenpräsentation und arbeiten daher mit T-Zellen zusammen, um die adaptive Immunität zu unterstützen. Darüber hinaus können Makrophagen Zytokine wie IL-12 absondern und eine Rolle bei lokalen Immunreaktionen spielen, während andere große Mengen von IL-10 absondern, das ihre Rolle bei der Gewebereparatur vermittelt. Die „großen Fresser“ spielen also neben ihrer Hauptaufgabe der Phagozytose eine Vielzahl von Rollen im Immunsystem.
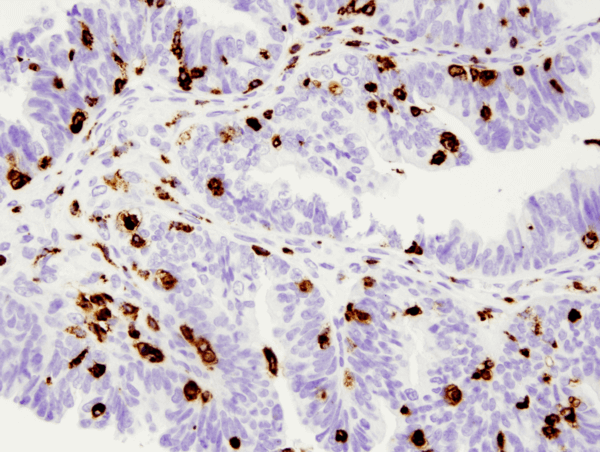
CD68 (D4B9C) XP® Rabbit mAb #76437: IHC-Analyse von in Paraffin eingebetteten menschlichen serösen Papillarkarzinomen des Eierstocks unter Verwendung von #76437.
CD68 (D4B9C) XP® Rabbit mAb #76437: IHC-Analyse eines in Paraffin eingebetteten humanen serösen Papillarkarzinoms des Ovars unter Verwendung von #76437.
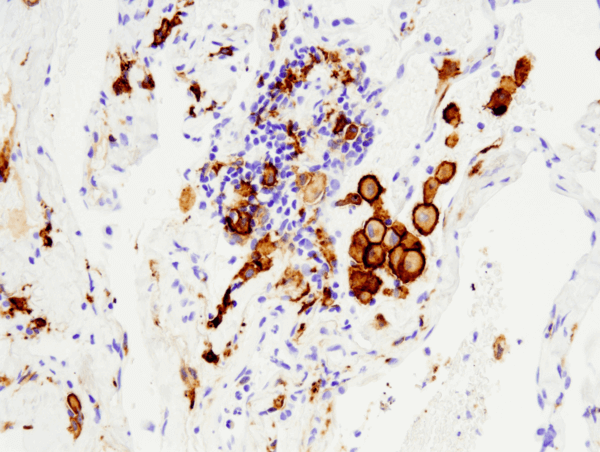
CD163 (D6U1J) Kaninchen-mAb #93498: IHC-Analyse eines in Paraffin eingebetteten humanen nicht-kleinzelligen Lungenkarzinoms unter Verwendung von #93498, durchgeführt auf dem Leica® Bond™ Rx.
CD163 (D6U1J) Rabbit mAb #93498: IHC-Analyse eines in Paraffin eingebetteten menschlichen nicht-kleinzelligen Lungenkarzinoms unter Verwendung von #93498, durchgeführt mit dem Leica® Bond™ Rx.
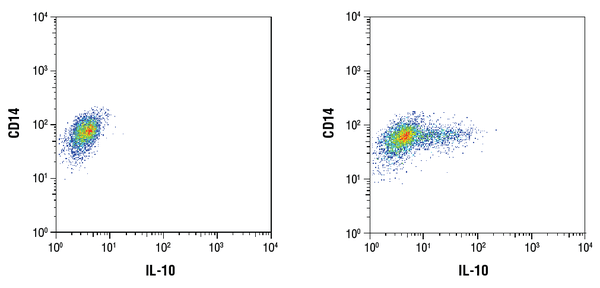
IL-10 (D13A11) XP® Rabbit mAb #12163: Durchflusszytometrische Analyse von gereinigten CD14+ humanen peripheren mononukleären Blutzellen unbehandelt (links) oder behandelt mit LPS (100ng/mL, 16 Std.; rechts) unter Verwendung eines CD14-Antikörpers und #12163. Brefeldin A #9972 (300ng/mL) wurde den unbehandelten und behandelten Zellen nach 1 Stunde LPS-Stimulation zugesetzt. Als Sekundärantikörper wurde Anti-Kaninchen-IgG (H+L), F(ab‘)2-Fragment (Alexa Fluor® 647 Konjugat) #4414 verwendet.
IL-10 (D13A11) XP® Rabbit mAb #12163: Durchflusszytometrische Analyse von gereinigten CD14+ humanen peripheren mononukleären Blutzellen unbehandelt (links) oder behandelt mit LPS (100ng/mL, 16 h; rechts) unter Verwendung eines CD14-Antikörpers und #12163. Brefeldin A #9972 (300ng/mL) wurde den unbehandelten und behandelten Zellen nach 1 Stunde LPS-Stimulation zugesetzt. Als Sekundärantikörper wurde Anti-Kaninchen-IgG (H+L), F(ab‘)2-Fragment (Alexa Fluor® 647 Konjugat) #4414 verwendet.
Dendritische Zellen
Ähnlich wie Makrophagen haben dendritische Zellen die Fähigkeit, zelluläres und fremdes Material zu verschlingen, aber anstatt es zu verdauen und zu entfernen, verarbeiten dendritische Zellen das Material und präsentieren es T-Zellen als Antigene. Als solche dienen dendritische Zellen als Antigen-präsentierende Zellen oder akzessorische Zellen und vermitteln somit Informationen über Krankheitserreger zwischen dem angeborenen und dem adaptiven Immunsystem. Dendritische Zellen haben ihren Namen von ihren ausgeprägten zellulären Fortsätzen, die nach außen ragen und schädliches Material aufnehmen, um es zu verdauen.
Unreife dendritische Zellen, die aus hämatopoetischen Vorläuferzellen des Knochenmarks hervorgehen, durchlaufen zunächst eine „Lernphase“, in der sie ihre Umgebung nach Fremdmaterial absuchen und über Mustererkennungsrezeptoren eine Erkennungsreaktion einleiten (eine gemeinsame Gruppe dieser Rezeptoren sind die Toll-like-Rezeptoren). Diese unreifen dendritischen Zellen können sich an verschiedenen Orten befinden, die Zugang zur äußeren Umgebung haben, z. B. in der Nasenschleimhaut, im Magen, in der Lunge und sogar in der Haut. Nach der Erkennung des Antigens wandern die dendritischen Zellen dann in den Lymphknoten, wo sie die T-Zellen darauf trainieren, das Antigen zu erkennen und entsprechend zu reagieren. Dendritische Zellen sind die einzigen antigenpräsentierenden Zellen, die sowohl Gedächtnis- als auch naive T-Zellen aktivieren. Toll-like-Rezeptoren sind eine gut untersuchte Klasse von Rezeptoren auf Makrophagen und dendritischen Zellen, die die Erkennung und Reaktion auf fremde Krankheitserreger vermitteln. Neben der direkten Interaktion mit T-Zellen können dendritische Zellen auch über Zytokine wie IL-12 Signale aussenden, die das Immunsystem auf den nachfolgenden Angriff auf das schädliche Material vorbereiten. Andere Arten von dendritischen Zellen können Zytokine absondern, die signalisieren, dass mehr Makrophagen rekrutiert werden sollen, um eine Überladung mit Abfallstoffen zu beseitigen. Als wichtigste Zellvermittler für die Antigenpräsentation spielen die dendritischen Zellen somit eine unverzichtbare Rolle beim Zusammenspiel zwischen dem angeborenen und dem adaptiven Immunsystem.
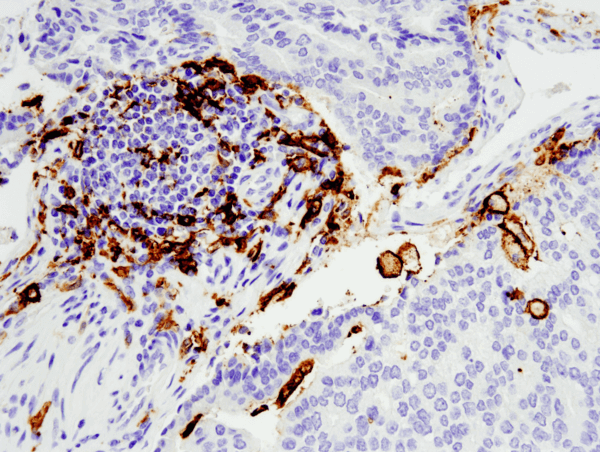
CD11c (D3V1E) XP® Rabbit mAb #45581: IHC-Analyse eines in Paraffin eingebetteten menschlichen Prostata-Adenokarzinoms unter Verwendung von #455812, durchgeführt auf dem Leica® Bond™ Rx.
CD11c (D3V1E) XP® Kaninchen mAb #45581: IHC-Analyse eines in Paraffin eingebetteten humanen Prostata-Adenokarzinoms unter Verwendung von #455812, durchgeführt mit dem Leica® Bond™ Rx.
Andere angeborene Immunzellen und Signalübertragung
Zu den anderen Zellen des angeborenen Immunsystems gehören Mastzellen, die bei der Wundheilung und zum Schutz vor Krankheitserregern beitragen. Wenn sie durch einen Krankheitserreger ausgelöst werden, können Mastzellen Zytokine sowie histamin- und heparinhaltige Granula absondern, die weitere Immunreaktionen wie die Rekrutierung von Makrophagen und die Erweiterung von Blutgefäßen bewirken. Neutrophile, Eosinophile und Basophile werden aufgrund der charakteristischen Granula in ihrem Zytoplasma als Granulozyten bezeichnet. Bei Neutrophilen setzen die Granula toxische Verbindungen frei, die sich gegen Krankheitserreger wie Pilze und Bakterien richten.
Immunologie in Gesundheit und Krankheit
Krebsimmunologie
Die Nutzung von Immunzellen zur Krebsbekämpfung ist aufgrund der Erfolge in der Klinik ein sehr aktuelles Forschungsthema geworden. Ein aktueller Schwerpunkt der Immuntherapie ist die Bekämpfung von Checkpoint-Proteinen wie PD-1, die normalerweise die Aktivierung und Reaktion von T-Zellen verhindern. Die adoptive Zelltherapie ist ein weiterer spannender Ansatz, bei dem T-Zellen, die dem Patienten entnommen wurden, immunoeditiert werden. Die T-Zellen werden so verändert, dass sie einen spezifischen chimären Antigenrezeptor exprimieren, der für die Krebszellen des Patienten spezifisch ist. Die T-Zellen werden dann dem Patienten reinfundiert und sind nun so programmiert, dass sie die Krebszellen aufspüren und abtöten, wie es der normalen T-Zell-Funktion entspricht. Diese und andere Ansätze zur Manipulation des Immunsystems, um die schädlichen Krebszellen des Patienten anzugreifen, stellen eine bahnbrechende Klasse von Therapien zur Behandlung von Krebs dar.