Vandkemi 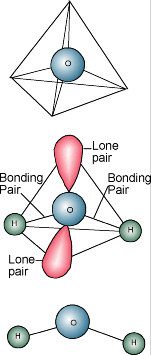 Du ved sikkert, at vands kemiske betegnelse er H2O. Et vandmolekyle består af et oxygenatom bundet til to hydrogenatomer. Brintatomerne er “knyttet” til den ene side af iltatomet, hvilket resulterer i et vandmolekyle, der har en positiv ladning på den side, hvor brintatomerne er, og en negativ ladning på den anden side, hvor iltatomet er. Da modsatrettede elektriske ladninger tiltrækker hinanden, har vandmolekyler en tendens til at tiltrække hinanden, hvilket gør vand til en slags “klæbrig”. Den side med brintatomerne (positiv ladning) tiltrækker iltsiden (negativ ladning) af et andet vandmolekyle.
Du ved sikkert, at vands kemiske betegnelse er H2O. Et vandmolekyle består af et oxygenatom bundet til to hydrogenatomer. Brintatomerne er “knyttet” til den ene side af iltatomet, hvilket resulterer i et vandmolekyle, der har en positiv ladning på den side, hvor brintatomerne er, og en negativ ladning på den anden side, hvor iltatomet er. Da modsatrettede elektriske ladninger tiltrækker hinanden, har vandmolekyler en tendens til at tiltrække hinanden, hvilket gør vand til en slags “klæbrig”. Den side med brintatomerne (positiv ladning) tiltrækker iltsiden (negativ ladning) af et andet vandmolekyle.
Alle disse vandmolekyler, der tiltrækker hinanden, betyder, at de har en tendens til at klumpe sammen. Det er derfor, at vanddråber rent faktisk er dråber! Hvis det ikke var for nogle af jordens kræfter, f.eks. tyngdekraften, ville en vanddråbe være kugleformet – en perfekt kugle. Selv om det ikke danner en perfekt kugle på Jorden, bør vi være glade for, at vand er klæbrigt.
Vand kaldes det “universelle opløsningsmiddel”, fordi det opløser flere stoffer end nogen anden væske. Det betyder, at uanset hvor vand bevæger sig hen, enten gennem jorden eller gennem vores kroppe, tager det værdifulde kemikalier, mineraler og næringsstoffer med sig.
Rent vand har en neutral pH-værdi. Rent vand har en pH, på omkring 7, som hverken er surt eller basisk.
Vandets fysiske egenskaber:
Vand er unikt, idet det er det eneste naturlige stof, der findes i alle tre tilstande – flydende, fast stof (is) og gas (damp) – ved de temperaturer, der normalt findes på Jorden. Jordens vand er konstant i vekselvirkning, forandring og bevægelse.
 Vand fryser ved 32° Fahrenheit (F) og koger ved 212° F. Faktisk er vands fryse- og kogepunkt det udgangspunkt, hvormed temperaturen måles: 0° på celsiusskalaen er vands frysepunkt, og 100° er vands kogepunkt. Vand er usædvanligt, fordi den faste form, is, er mindre tæt end den flydende form, hvilket er grunden til, at is flyder.
Vand fryser ved 32° Fahrenheit (F) og koger ved 212° F. Faktisk er vands fryse- og kogepunkt det udgangspunkt, hvormed temperaturen måles: 0° på celsiusskalaen er vands frysepunkt, og 100° er vands kogepunkt. Vand er usædvanligt, fordi den faste form, is, er mindre tæt end den flydende form, hvilket er grunden til, at is flyder.
Vand har et højt specifikt varmeindeks. Det betyder, at vand kan optage meget varme, før det begynder at blive varmt. Det er derfor, at vand er værdifuldt for industrier og i din bils køler som kølemiddel. Vandets høje specifikke varmeindeks er også med til at regulere den hastighed, hvormed luften ændrer temperatur, hvilket er grunden til, at temperaturændringerne mellem årstiderne er gradvise snarere end pludselige, især i nærheden af havene.
Vand har en meget høj overfladespænding. Med andre ord er vand klæbrigt og elastisk og har en tendens til at klumpe sig sammen i dråber i stedet for at sprede sig ud i en tynd film. Overfladespændingen er ansvarlig for den kapillære virkning, som gør det muligt for vand (og dets opløste stoffer) at bevæge sig gennem planternes rødder og gennem de små blodkar i vores kroppe.
Vandtemperatur:
Vandtemperaturen er ikke kun vigtig for svømmere og fiskere, men også for industrier og endda for fisk og alger. Der bruges meget vand til køleformål i kraftværker, der producerer elektricitet. De har brug for koldt vand til at starte med, og de frigiver generelt varmere vand tilbage til miljøet. Temperaturen på det frigivne vand kan påvirke levestederne nedstrøms. Temperaturen kan også påvirke vandets evne til at holde på ilt samt organismernes evne til at modstå visse forurenende stoffer.
pH:
pH er et mål for, hvor surt/baseholdigt vand er. Intervallet går fra 0 – 14, hvor 7 er neutralt. pH-værdier på under 7 indikerer surhed, mens en pH-værdi på over 7 indikerer base. pH er i virkeligheden et mål for den relative mængde af frie hydrogen- og hydroxylioner i vandet. Vand, der har flere frie hydrogenioner, er surt, mens vand, der har flere frie hydroxylioner, er basisk. Da pH kan påvirkes af kemikalier i vandet, er pH en vigtig indikator for vand, der ændrer sig kemisk. pH angives i “logaritmiske enheder”, ligesom Richterskalaen, der måler jordskælv. Hvert tal repræsenterer en 10-dobbelt ændring i vandets surhedsgrad/basicitet. Vand med en pH-værdi på 5 er ti gange mere surt end vand med en pH-værdi på 6.
Forurening kan ændre et vands pH-værdi, hvilket igen kan skade de dyr og planter, der lever i vandet. For eksempel kan vand, der kommer ud af en nedlagt kulmine, have en pH-værdi på 2, hvilket er meget surt og helt sikkert ville påvirke enhver fisk, der er skør nok til at forsøge at leve i det! Hvis man bruger logaritmeskalaen, vil dette minevand være 100.000 gange mere surt end neutralt vand – så hold dig fra forladte miner.
Specifik ledningsevne:
Specifik ledningsevne er et mål for vandets evne til at lede en elektrisk strøm. Den er stærkt afhængig af mængden af opløste faste stoffer (f.eks. salt) i vandet. Rent vand, f.eks. destilleret vand, vil have en meget lav specifik ledningsevne, mens havvand vil have en høj specifik ledningsevne. Regnvand opløser ofte luftbårne gasser og luftbårent støv, mens det er i luften, og har derfor ofte en højere specifik ledningsevne end destilleret vand. Den specifikke konduktans er en vigtig måling af vandkvaliteten, fordi den giver et godt billede af mængden af opløst materiale i vandet.
I skolen har du sikkert lavet det eksperiment, hvor du tilslutter et batteri til en pære og fører to ledninger fra batteriet ind i et bægerglas med vand. Når ledningerne sættes ned i et bægerglas med destilleret vand, vil lyset ikke tænde. Men pæren lyser, når bægerglasset indeholder saltvand (saltvand). I saltvandet er saltet opløst, hvorved der frigives frie elektroner, og vandet vil lede en elektrisk strøm.
Turbiditet:
Turbiditet er et mål for vandets grumsethed. Den måles ved at lade en lysstråle passere gennem vandet og se, hvor meget der reflekteres af partikler i vandet. Vandets uklarhed skyldes materiale, som f.eks. snavs og rester fra blade, der er suspenderet (flyder) i vandet. Krystalklart vand, som f.eks. Lake Tahoe (hvor man arbejder hårdt for at forhindre, at sediment skylles ind i søen), har en meget lav turbiditet. Men se på en flod efter en storm – den er sandsynligvis brun. Du kan se al den suspenderede jord i vandet. Heldigvis for os falder de stoffer, der forårsager turbiditet i vores drikkevand, enten fra eller bliver filtreret, inden vandet kommer i vores drikkeglas derhjemme. Turbiditet måles i nefelometriske turbiditetsenheder (NTU).
opløst ilt:
Og selv om vandmolekyler indeholder et iltatom, er det ikke den ilt, som vandorganismer, der lever i vores naturlige vandområder, har brug for. En lille mængde ilt, op til omkring ti iltmolekyler pr. million vand, er faktisk opløst i vand. Denne opløste ilt indåndes af fisk og zooplankton og er nødvendig for, at de kan overleve.
Hurtigt bevægende vand, som f.eks. i en bjergbæk eller en stor flod, har tendens til at indeholde meget opløst ilt, mens stillestående vand indeholder lidt. Den proces, hvor bakterier i vandet hjælper organisk materiale, som f.eks. det, der kommer fra et rensningsanlæg, med at forfalde, forbruger ilt. Et overskud af organisk materiale i vores søer og floder kan således forårsage en situation med iltmangel. Vandlevende organismer kan have det svært i stillestående vand med en masse rådnende organisk materiale, især om sommeren, hvor indholdet af opløst ilt er lavt i løbet af sæsonen.
Hårdhed:
Mængden af opløst calcium og magnesium i vandet bestemmer dets “hårdhed”. Vandets hårdhed varierer i hele USA. Hvis du bor i et område, hvor vandet er “blødt”, har du måske aldrig hørt om vandets hårdhed. Men hvis du bor i Florida, New Mexico, Arizona, Utah, Wyoming, Nebraska, South Dakota, Iowa, Wisconsin eller Indiana, hvor vandet er relativt hårdt, vil du måske bemærke, at det er svært at få skummende vand op, når du vasker hænder eller tøj. Og industrier i dit område kan være nødt til at bruge penge på at blødgøre deres vand, da hårdt vand kan beskadige udstyr. Hårdt vand kan endda forkorte levetiden for tekstiler og tøj! Betyder det, at studerende, der bor i områder med hårdt vand, ikke kan følge med den seneste mode, da deres tøj bliver hurtigere slidt op?
Suspenderet sediment:
Suspenderet sediment er den mængde jord, der bevæger sig med i et vandløb. Det afhænger i høj grad af vandets strømningshastighed, da hurtigt strømmende vand kan opsamle og suspendere mere jord end roligt vand. Under storme skylles jord fra vandløbsbredderne ud i vandløbet. Den mængde, der skylles ud i et vandløb, afhænger af typen af jord i vandløbets afvandingsområde og vegetationen omkring vandløbet.
Hvis jorden forstyrres langs et vandløb, og der ikke træffes beskyttelsesforanstaltninger, kan overskydende sediment skade vandkvaliteten i et vandløb. Du har sikkert set de korte plastikhegn, som bygherrer sætter op i kanten af den ejendom, de er ved at udstykke. Disse hegn skal fange sediment under en regnbyge og forhindre det i at blive skyllet ud i et vandløb, da overskydende sediment kan skade bække, floder, søer og reservoirer.
Sediment, der kommer ind i et reservoir, er altid et problem; når det først er kommet ind, kan det ikke komme ud igen – det meste af det vil bundfælde sig på bunden. Reservoirer kan “slikke til”, hvis der kommer for meget sediment ind i dem. Reservoirets volumen reduceres, hvilket resulterer i mindre areal til sejlads, fiskeri og rekreation, og det reducerer også kraftværkets evne til at producere strøm i dæmningen.
Geokemi af vandig opløsning:
Se på et diagram over det hydrogeokemiske kredsløb.
- Syre = stof, der indeholder hydrogen, som giver frit hydrogen (H + ), når det opløses i vand
- Base = stof, der indeholder OH-gruppen, som giver frit (OH – ), når det opløses i vand
-
En syreopløsning er en opløsning, der indeholder et overskud af frit H + , og en base er en opløsning, der indeholder et overskud af frit OH – . En reaktion mellem en syre og en base kaldes normalt neutralisering.
For eksempel:
-
HCl (syre) + NaOH (base) ==> H 2 O + NaCl
som dissocieres til ioner:
H + + Cl – + Na + + OH – ==> H 2 O + Na + + Cl – - dvs. Na + og Cl – er upåvirket.
- pH = omvendt log af koncentrationen (aktiviteten) af frit H + , eller pH = -log
-
Vand dissocieres i H + og OH – ;
-
dissociationskonstanten er: K vand = = =10 -14
- Der skal altså være 10 -7 mol H+ og OH – hver i et kilogram neutral opløsning ved standardtemperaturen 25 °C. Et mol er 6,023 x 10 10 23 atomer (eller molekyler), og H 2 O har en molekylvægt på 18 gram pr. mol. Et kilogram vand indeholder ca. 1000/18 = 55,6 mol vand eller ca. 3,35 x 10 25 oxygenatomer og ca. det dobbelte antal (6,7 x 10 25 atomer) H + (mængden af frit H + eller frit OH – er relativt lille sammenlignet med mængden af ikke-dissocieret H 2 O).
- pH-værdien varierer ved 25 °C fra 0 til 14; pH < 7 = sur opløsning; pH > 7 = basisk opløsning. Hvis der tilsættes HCl eller en anden syre, falder pH-værdien; hvis der tilsættes NaOH eller en anden base, stiger pH-værdien.
- pH stiger, når kulsyre (en svag syre) dissocieres: Når kuldioxid kombineres med vand, som det f.eks. sker i atmosfæren, når fossile brændstoffer forbrændes, dannes der kulsyre: H 2 O + CO 2 ==> H 2 CO 3 . Ved de på hinanden følgende dissociationer bliver der frigivet frie H + :
-
H 2 CO 3 ==> H + + HCO 3- kulsyre til bicarbonat, forekommer ved pH ~6,4
-
HCO 3 ==> H + + + CO 32- bicarbonat til carbonat, forekommer ved pH ~10.3
Husk, at frit H + kun er tilgængeligt, når det er surt, eller når pH < ~7. Dissociationen af bicarbonat til carbonat sker, når der er for meget OH – i systemet, og H + “frigives” for at udligne basen.
- Opløste kationer og anioner i vand
Kationer = elektrondonorer, positivt ladede: Na + , K + , Mg ++ , Ca ++ , Fe ++ eller Fe +++ , Mn ++ , Al +++
Anioner = elektronacceptorer, neg. ladede: Cl – , F – , I – , Br – , SO 4– , CO 3– , HCO 3- , NO 3– , NO 2-
Metaller = opfører sig som kationer for det meste: Cu, Zn, Pb, Co, Ni, Cr, As, Se, Mo, osv.
- Vandanalyser – Behov for kation-anion-balance
milleækvivalent (MEQ) = molækvivalent ladning eller anion eller kation, mål for den samlede ladning som følge af den pågældende ion opløst i opløsningen. Start med koncentrationen, divideres med molvægt, multipliceres med ladning: XX mg/L / MW x CHG = MEQ
Eksempel: Eksempel: NaCl i opløsning, Na = 50 mg/L (50 ppm): 50/23 x 1 = 2,17 MEQ
Cl = 77 mg/L (77 ppm): 77/35,5 x -1 = -2,17 MEQ
Så hvis de samlede kation- og anion-MEQ’er ikke er afbalancerede, er der en vis fejl i analysen.