Intracellulære signaler, som f.eks. skader på cellens DNA, styrer apoptose primært gennem den intrinsiske vej. Den intrinsiske apoptosevej, som involverer konserverede signalproteiner, er fysisk forbundet med mitokondrier og er hos hvirveldyr følsom over for mitokondriel oxidativ stress. Vejen påvirkes af medlemmer af Bcl-familien, der er bundet til mitokondriemembranen, herunder Bax- og Bcl-2 genet, der fungerer som henholdsvis pro- eller anti-apoptotiske regulatoriske proteiner.
Overblik over intrinsisk apoptosevej
Den intrinsiske apoptosevej initieres af f.eks. kemoterapi og/eller strålebehandling. Den aktiveres af en række eksogene og endogene stimuli, såsom DNA-skader, iskæmi og oxidativ stress. Desuden spiller den en vigtig funktion i udviklingen og i elimineringen af beskadigede celler.
I den intrinsiske vej er den funktionelle konsekvens af proapoptotisk signalering mitokondriemembranforstyrrelser og frigivelse af cytochrom c i cytoplasmaet, hvor det danner et kompleks eller apoptosom med apoptotisk proteaseaktiverende faktor 1 (APAF1) og den inaktive form af caspase-9. Dette kompleks hydrolyserer adenosintrifosfat for at spalte og aktivere caspase-9. Den initierende caspase-9 kløver og aktiverer derefter de udøvende caspaser-3/6/7, hvilket resulterer i celleapoptose. Det er helt forskelligt fra de ekstracellulære signaler, som normalt genereres af cytotoksiske celler i immunsystemet og udløser apoptose hovedsageligt gennem den extrinsiske vej.
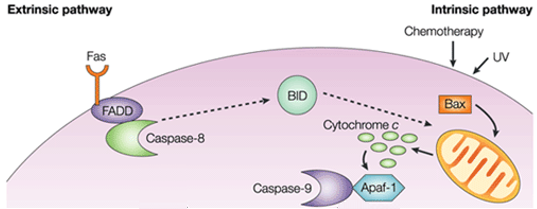
Figur 1. Forskel mellem extrinsisk vej og intrinsisk vej.
Proces og regulering af intrinsisk apoptosevej
Den intrinsiske apoptosevej inducerer apoptose ved direkte aktivering af caspase-3 eller ved at kløve bid (BH3-interagerende domæne-dødsagonist), hvilket resulterer i mitokondriel dysfunktion og efterfølgende frigivelse af cytochrom c og aktivering af caspase-9 og caspase-3. Caspase-3 fremmer de typiske apoptosekarakteristika, herunder DNA-fragmentering og celledød i flere væv.
B-celle lymfom 2 (Bcl-2)-proteinfamilien styrer nøje aktiveringen af den intrinsiske vej. Den findes i follikulært lymfom og blev først identificeret som et af de gener, der er involveret i celledøden ved enten at aktivere pro-apoptotisk eller hæmme anti-apoptotisk apoptose. Proteiner i en undergruppe, herunder Bid, Bad, Bim, Bmf, Puma og Noxa, indeholder et enkelt Bcl-2-homologi 3-domæne (BH3-only-proteiner) og har proapoptotisk aktivitet. To andre undergrupper af proteiner har flere BH-domæner. Den første undergruppe, der omfatter Bcl-2-associeret X-protein (Bax), Bcl-2 homolog antagonist/killer (Bak) og Bcl-2-familiens apoptoseregulator (Bok), er proapoptotisk; den anden undergruppe, der omfatter Bcl-2, Bcl-XL og Mcl-1, er antiapoptotisk. Den mitokondrielle vej påvirkes delvist af Bcl-familiemedlemmer, der er bundet til mitokondriemembranen, herunder både de proapoptotiske regulatoriske proteiner Bax og de antiapoptotiske regulatoriske proteiner Bcl-2.
De proapoptotiske molekyler forårsager permeabilisering af den ydre mitokondriemembran, hvilket fører til udstrømning af cytochrom c, som binder adaptoren Apaf-1 og initiatoren caspase-9 i cytosolen til dannelse af apoptosomkomplekset. Dette stimulerer caspase-9, som igen aktiverer effektorcaspaser. Mitokondriet frigiver også et protein kaldet Smac/DIABLO til cytosolen. Smac/DIABLO fremmer indirekte apoptose ved at blokere virkningerne af en gruppe anti-apoptotiske proteiner kaldet inhibitor of apoptosis proteins (IAPs).
De anti-apoptotiske proteiner Bcl-2 og Bcl-XL hæmmer frigivelsen af cytokrom c, mens Bax, Bak og Bid, der alle er pro-apoptotiske proteiner, fremmer dets frigivelse fra mitokondrier. Cytokrom c og deoxyadenosintrifosfat (dATP) binder sig til APAF-1 for at danne et multimerisk kompleks, der rekrutterer og aktiverer pro-caspase-9, en apoptosemedierende eksekutorprotease, som igen aktiverer caspase-kaskaden, hvilket resulterer i celleapoptose. Under denne proces er caspase-2, caspase-8, caspase-9 og caspase-10 involveret i initieringen af apoptose. Caspase-3, caspase-6 og caspase-7 er involveret i apoptose. Caspase-3 og caspase-7 regulerer hæmningen af DNA-reparation og påbegynder DNA-nedbrydning. Desuden regulerer caspase-6 opløsningen af lamina og cytoskelettet.
Intrinsisk apoptosevej i patofysiologi
De fleste kemoterapeutiske og målrettede kræftterapier dræber tumorceller ved at generere pro-dødssignalering, der initierer den intrinsiske apoptosevej for programmeret celledød. Point of no return i den apoptotiske kaskade er mitokondriel ydre membranpermeabilisering (MOMP); når det først er sket, fører mitokondriel permeabilisering til dannelse af et apoptosom, som letter caspaseaktivering og efterfølgende udløser de andre kendetegn ved apoptotisk celledød. Den cellulære beslutning om at indlede MOMP styres af en delikat balance mellem de pro- og anti-apoptotiske molekyler i BCL-2-familien.
En af årsagerne til kemoterapiresistens er tumorcellers manglende evne til at gå i apoptose på grund af defekter i den intrinsiske apoptosevej (f.eks. ændringer i p53). På trods af betydelige forbedringer i behandlingen er helbredelsesgraden for mange kræftformer fortsat suboptimal. Den stigende anvendelse af cytotoksisk kemoterapi har ført til kurativ behandling af en delmængde kræftformer, selv om intrinsisk behandlingsresistens er vanskelig at forudsige for den enkelte patient. Bølgen af molekylært målrettede terapier har fokuseret på lægemiddelaktiverende mutationer og er således begrænset til specifikke delmængder af patienter. Den intrinsiske mitokondrielle apoptosevej udgør et lovende mål for nye terapier, og en vellykket målretning af denne vej har potentiale til at ændre det terapeutiske landskab for behandling af en række forskellige kræftformer.