Immunsystemet
Immunsystemet består af væv, celler og molekyler, hvis primære funktion er at opdage, reagere på og fjerne patogener og transformerede celler.
Det medfødte og adaptive immunforsvar
Der er to hovedkomponenter i immunsystemet – 1) det medfødte immunsystem og 2) det adaptive immunsystem. Det medfødte immunsystem fungerer som første forsvarslinje og opdager patogener via kimlinjekodede mønstergenkendelsesreceptorer, danner ikke hukommelse og reagerer hurtigt (inden for minutter til timer). Det adaptive immunsystem reagerer langsomt (over flere dage), bruger antigenspecifikke receptorer, der gennemgår flere genomlægninger under udviklingen, og danner immunologisk hukommelse – det “lærer” af den første fornærmelse og gør kroppen klar til at bekæmpe fremtidig eksponering for lignende skadeligt materiale. Begge typer immunreaktioner kan enten være drevet af makromolekyler i den ekstracellulære væske eller af aktivering af specifikke immunceller. Disse reaktioner er kendt som henholdsvis humoral immunitet og cellemedieret immunitet.
Under paraplyen cellemedieret immunrespons stratificerer immuncellerne for det meste på baggrund af, om responsen er medfødt eller adaptiv. Det medfødte immunsystem består hovedsagelig af fagocytiske celler, såsom neutrofile, makrofager, naturlige dræberceller, basofile og andre, der er rettet mod farlige invaderende organismer. Cellerne i det adaptive immunsystem er T-celler og B-celler. Naturlige dræberceller (NK) T-celler har træk fra både medfødte og adaptive immunceller. Desuden kan de fleste andre celletyper, der ikke er specifikke for immunsystemet, rumme iboende medfødte immunfunktioner i form af cytoplasmatiske receptorer og signal- og effektormolekyler som f.eks. medlemmer af RIG-I-, STING- og NLR-familierne. Som vi vil gennemgå yderligere, opstår celler i begge systemer fra forskellige myeloide og lymfoide stamceller fra hæmatopoietiske stamceller.
Komponenter i immunsystemet
Modne immunceller differentierer sig fra det, der er kendt som hæmatopoietiske stamceller. Disse er pluripotente udifferentierede stamceller, der findes i knoglemarven, det perifere blod og placenta. Disse hæmatopoietiske stamceller kan differentiere sig til den almindelige myeloide stamcelle eller den almindelige lymfoide stamcelle.
Lymfoide celler
Almindelige lymfoide stamceller kan differentiere sig til fire hovedpopulationer af lymfocytter, der kan skelnes ved hjælp af ekspression af receptorer på celleoverfladen: T-celler, B-celler, naturlige dræberceller (NK-celler) og NK-T-celler.
T-celler
T-celler spiller en afgørende rolle i den cellemedierede immunitet. Disse celler identificeres ved udtrykket af CD3 T-celle-signalkæderne.
T-celler opstår fra lymfoide progenitorceller, der oprindeligt udvikles fra hæmatopoietiske stamceller i knoglemarven. Når den lymfoide progenitor forpligter sig til at blive en T-celle, migrerer den fra knoglemarven til thymus (deraf navnet T-celle). Thymus danner det rette mikromiljø, hvor T-cellerne kan udvikle sig til deres forskellige subtyper, der defineres af de specifikke receptorer, der udtrykkes på celleoverfladen. De modne T-celler i de tidlige stadier, eller thymocytter, mangler receptorer for både CD4 og CD8 og kaldes derfor dobbeltnegative (DN) celler. DN-cellerne gennemgår derefter genetiske omlægninger og mutationer i generne, der koder for alfa- og beta-T-celle-receptorerne (TCR), hvorved de begynder at bevæge sig i retning af lineage commitment, hvorved slutresultatet er en T-celle-receptor med specifik affinitet for et unikt antigen.
Thymocytterne udvælges derefter, både positivt og negativt, for at sikre, at de genkender “fremmede” antigener, men ikke værtsantigener, der præsenteres som peptider via MHC på celleoverfladen. Kun celler, der består begge test, vil derefter blive udløst til at udtrykke CD4 og CD8 og blive dobbelt-positive celler. Ved slutningen af modningen vil T-cellerne enten udtrykke CD4 eller CD8 (og miste udtrykket af det andet) og dermed blive enkelt-positive celler. Disse modne CD4- eller CD8-positive T-celler frigives derefter i blodbanen og er i begyndelsen i naiv tilstand, hvilket betyder, at de endnu ikke har forpligtet sig til en bestemt T-celle-subtype.
Hvis den modnende thymocyt viser en mellemliggende affinitet for selv-MHC-peptider under modningen, kan den udvælges til at blive en regulatorisk T-celle (Treg) på grund af dens evne til at genkende skadelige “selv”-antigener. T-celler i blodet eller i perifere væv kan også lokalt induceres til at blive til Tregceller. Tregs vigtigste opgave er at opretholde tolerance over for selvantigener samt at begrænse T-effektorcellers funktion og proliferation.
Når de først er ankommet til blodet eller det perifere væv, kan naive T-celler induceres til at blive til T-hjælperceller. Antigenpræsenterende celler (APC’er), såsom makrofager, dendritiske celler og B-celler, vil vise T-cellen antigenet, og hvis dens receptor har affinitet, vil T-cellen genkende antigenet. Typisk er CD4+ T-cellerne egnede til at genkende peptidantigener bundet til MHC-proteiner af klasse II. Når peptid-MHC-komplekset er genkendt, vil T-cellen aktivere en række interne veje, der gør det muligt at bekræfte antigengengenkendelsen. Først derefter vil T-hjælpercellen formere sig og udvide puljen af tilgængelige celler, der er specifikke for det skadelige antigen, f.eks. forskellige bakterier og parasitter.
Når T-helpercellerne har genkendt deres antigen og er blevet aktiveret, vil de frigive en række cytokiner, som er molekyler, der signalerer til andre immunceller, hvordan de skal reagere hensigtsmæssigt på det skadelige molekyle. Der findes flere undergrupper af T-hjælperceller, herunder Th1, Th2 og Th17. Disse undergrupper producerer og udskiller forskellige cytokiner, der hjælper med at skræddersy immunresponset afhængigt af typen af patogen. Th1-cellerne er f.eks. afhængige af effektorcytokinen IFN-γ for at signalere til makrofager, at de skal fordøje og ødelægge det skadelige materiale, mens Th2-cellerne udskiller en kombination af IL-4, IL-5, IL-9, IL-10 og IL-13 for at udløse basofile, eosinofile og andre celler til at angribe infektionen. Den specifikke mængde og de specifikke sorter af cytokiner bestemmer den passende reaktion på infektionen eller den skadelige celle. T-celler kan også reagere på celler fra selvet ved at blive cytotoksiske T-celler (eller naturlige dræber-T-celler). Typisk er der tale om CD8+ celler, som genkender virusinficerede celler eller tumorceller. Naturlige dræber-T-celler (NKT’er) vil blive diskuteret mere detaljeret i et senere afsnit. Disse og andre typer T-celler udfører deres forskellige opgaver eller effektorfunktioner på forskellige måder for at genkende skadeligt materiale og rekruttere andre immunceller til at ødelægge det samt opbygge et varigt immunrespons over for den samme type krænkelse.
T-celle-receptorens interaktive signalvej gennemgås i detaljer her.
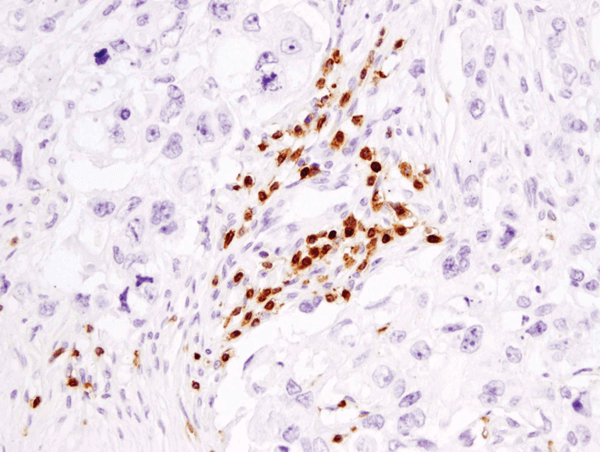
CD3ε (D7A6E™) XP® Rabbit mAb #85061: IHC-analyse af paraffinindlejret humant brystkarcinom ved hjælp af #85061.
CD3ε (D7A6E™) XP® kanin mAb #85061: IHC-analyse af paraffinindstøbt humant brystkarcinom ved brug af #85061.
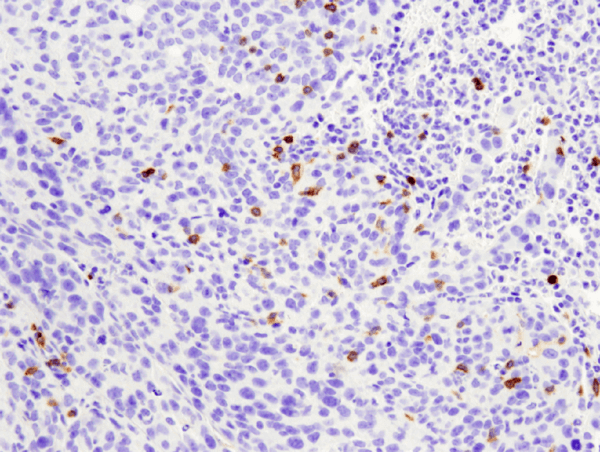
CD4 (D7D2Z) Kanin mAb #25229: IHC-analyse af paraffinindlejret 4T1 metastatisk tumor i muselunge ved brug af #25229.
CD4 (D7D2Z) Kanin mAb #25229: IHC-analyse af paraffin-embeddet 4T1 metastatisk tumor i muselunge ved brug af #25229.
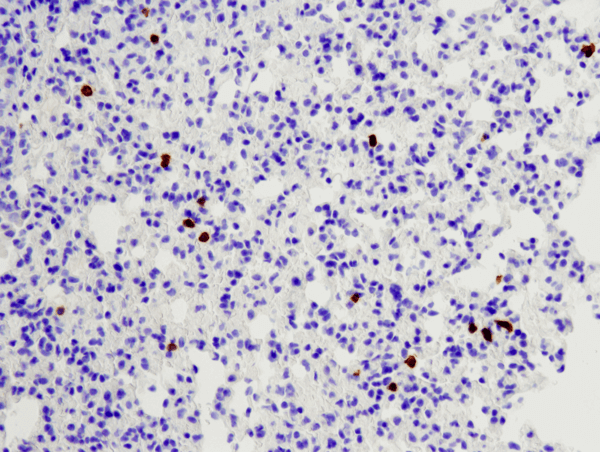
CD8α (D4W2Z) XP® Kanin mAb (musespecifik) #98941: IHC-analyse af paraffinindlejret muselunge ved hjælp af #98941.
CD8α (D4W2Z) XP® kanin mAb (musespecifik) #98941: IHC-analyse af paraffinindlejret muselunge ved hjælp af #98941.
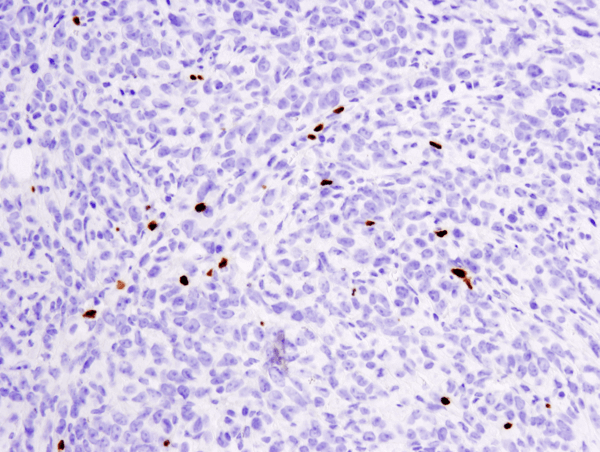
FoxP3 (D6O8R) Kanin mAb #12653: IHC-analyse af paraffinindlejret 4T1 metastatisk tumor i muselunge ved brug af #12653.
FoxP3 (D6O8R) Kanin mAb #12653: IHC-analyse af paraffin-embeddet 4T1 metastatisk tumor i muselunge ved brug af #12653.
B-celler
B-celler er de kritiske celler i blodet, der formidler produktionen af antistoffer. Når skadeligt materiale er til stede i blodstrømmen, genkendes det som et antigen af specifikke receptorer på B-cellerne. Efter at have behandlet antigenet og med hjælp fra T-celler modnes B-cellen derefter til plasmaceller, der udskiller antistoffer. B-celler kan også spille en rolle i forbindelse med præsentation af antigener og cytokinudskillelse. Både B-cellens udvikling og forskellige funktioner vil blive diskuteret.
15 % af de leukocytter, der findes i det perifere blod, er B-celler. B-celler producerer immunoglobuliner (Ig), som er antigenbindende proteiner (også kendt som antistoffer), der består af to identiske tunge kæder og to identiske lyskæder. Disse immunoglobuliner indeholder specifikke antigenbindingssteder, der varierer i aminosyresekvens fra det ene antistofmolekyle til det andet. Disse steder giver hvert antistof specificitet med hensyn til genkendelse af et bestemt antigen.
Som nævnt ovenfor differentieres B-celler fra hæmatopoietiske celler, der findes i knoglemarven. Det er i knoglemarven, at overflade-Ig-receptorer (antistoffer) samles gennem en genomlejringsproces. B-celler benytter somatisk sammenføjning af forskellige gener på en lang række kromosomer, som koder for de forskellige dele af de tunge og lette kæder, der udgør Ig. B-celler skubbes til differentiering gennem produktion af IL-7 fra knoglemarvsstromaceller. Disse B-celler under udvikling følger et program med sekventielle omlægninger af tunge og lette kæder, som formidles af forskellig receptorekspression på celleoverfladen. F.eks. forhindrer ekspression af en specifik præ-B-celle receptor visse genomlægninger på ubeslægtede kromosomer for at sikre, at den modne B-celle kan udtrykke en bestemt Ig-overfladereceptor, der er i stand til specifikt at genkende et enkelt antigen. Denne proces kaldes allelisk udelukkelse. Forkert samling af Ig-tungkæderne og de lette kæder kan fremkalde sekundær rearrangement med henblik på receptorredigering.
Ud over ekspressionen af en Ig-receptor på celleoverfladen indeholder B-celler også transmembranproteiner, der kan inducere intracellulære signaler, efter at et antigen har bundet sig til den ekstracellulære del af Ig-receptoren. B-celler anvender lignende intracellulære signalkaskader som T-celler, der fremkalder transkriptionelle ændringer, som fører til proliferation og modning. Især kan Ig-receptorens intracellulære domæner fosforyleres af src-familien af kinaser, hvorved der indledes en kaskade, som videreføres af tyrosinkinasen Syk og et linkerprotein kaldet BLINK til fosfolipase C og guaninudvekslingsfaktorer, der i sidste ende aktiverer proteinkinase C, mobiliserer calcium og aktiverer MAP-kinase på en Ras/Rac-afhængig måde.
Et unikt træk ved B-celler er deres evne til at undergå isotype-skift. Dette henviser specifikt til en proces med DNA-omlægning, der kan generere lidt forskellige tungkæder. Desuden kan alternativ splejsning af exonerne i den tunge kæde gøre det muligt for Ig’et at forblive bundet til celleoverfladen eller at blive udskilt, hvis transmembraneksonet splejses ud. Alternativ splejsning og isotype-skift induceres af T-celleafledte cytokiner. Desuden kan T-celler inducere somatiske mutationer, der fører til ændringer i de antigenbindende steder i B-cellernes Ig’er. En selvkorrigerende B-cellefunktion kan registrere, om disse tilsyneladende tilfældige mutationer fører til et tab af affinitet for antigenet og iværksætter et program for celledød. Antigener, der aktiverer både T-celler og B-celler, udløser således T-cellemedieret B-cellemodning gennem isotypeskift og somatiske mutationer, som begge er stærkt forbundet med B-cellehukommelse.
Hukommelsesresponser er karakteriseret ved en hurtig og omfattende Ig-produktion med høj affinitet over for sådanne antigener. Udviklingen af disse hukommelsesresponser er afgørende for, at vaccination kan lykkes. De kan imidlertid også øge autoimmunitet og allergiske reaktioner.
T-celle-uafhængig B-celleaktivering ved et antigen kan også finde sted; denne type aktivering er imidlertid forbundet med en svag immunhukommelse. Desuden skal disse antigener være polymere for at kunne aktivere B-celler.
NB: Cytokiner, eller interleukiner (IL’er), er sekreterede molekyler, der virker på transmembranreceptorer på celleoverfladen. Ved binding aktiverer disse cytokiner intracellulære signaltransduktionsveje, der typisk er afhængige af Jak-STAT-signalering.
B-celle-receptorens interaktive signalvej gennemgås i detaljer her.
CD19 (D4V4B) XP® Rabbit mAb #90176: IHC-analyse af paraffinindlejret humant lungekarcinom ved hjælp af #90176.
CD19 (D4V4B) XP® kanin mAb #90176: IHC-analyse af paraffinindlejret humant lungekarcinom ved brug af #90176.
NK-celler
Naturlige dræberceller, eller NK-celler, er en anden celletype, der stammer fra den lymfoide slægt. I lighed med B-cellerne udvikles de i knoglemarven på en cytokin- og knoglemarvsstromalcelleafhængig måde. De udgør en lille del af det perifere blod og har ingen antigenspecifikke receptorer. I stedet er NK-cellerne afhængige af et komplekst sæt transmembranreceptorer. De indeholder især hæmmende celleoverfladereceptorer, der genkender klasse I HLA-molekyler, og de hæmmes således af selv-MHC-molekyler og dræber kun celler, der har nedreguleret klasse I HLA-ekspression. De tjener derfor det vigtige formål at ramme viralt inficerede celler og tumorceller, hvis klasse I HLA-ekspression er nedreguleret for at undgå at blive dræbt af CD8+ naturlige dræber-T-celler (NK-T-celler). NK-celler kan også aktiveres på en antistof-, interferon- eller cytokinafhængig måde og kan derfor spille en stor rolle i bekæmpelsen af tumorer. NK-cellernes virkningsmekanisme er baseret på frigivelse af små granula, der indeholder granzymer og perforin, fra deres cytoplasma. Når disse proteiner frigives, kan de lave porer og nedbryde intracellulære proteiner for at fremkalde apoptose. NK-celler siges som sådan at være cytotoksiske.
NK-T-celler er en særlig undertype af T-celler, som udtrykker visse receptorer og markører, der typisk udtrykkes af NK-celler i kombination med et begrænset repertoire af T-celle-receptorer. Denne unikke undertype deler derfor egenskaber fra både T-celler og NK-celler. I modsætning til NK-celler, som udvikles i knoglemarven, udvikles NK-T-celler i thymus.
Myeloide celler
Fælles myeloide stamceller, som er efterkommere af hæmatopoietiske stamceller, giver anledning til flere forskellige typer myeloide celler, herunder makrofager, dendritiske celler og flere andre medfødte immunceller og blodceller.
Makrofager
Makrofager kan udløses til at genkende antigener, f.eks. beskadigede celler eller fremmed materiale, med henblik på destruktion efter behov. Makrofager er til stede i de fleste væv og reagerer efter behov på infektioner og døende celler. Det genkendte materiale destrueres via fagocytose i makrofagen, hvilket har givet cellerne deres navn (“stor æder” på græsk). Makrofager antager forskellige former, når de er til stede forskellige steder, og kan udføre yderligere funktioner ud over fagocytose.
Ved vævsskade eller patogeninfektion vil monocytter i blodet blive rekrutteret til det berørte væv og differentiere sig til makrofager. Afhængigt af vævslokaliseringen findes der forskellige typer makrofager, såsom Kupffer-celler i leveren, alveolære makrofager i lungerne, mikroglia i hjernen osv. Disse forskellige typer af makrofager stammer alle fra monocytter, men specialiserer deres funktion til det hjemmehørende væv. Det meste af den generelle fagocytosefunktion udføres af de residente vævsmakrofager. Ud over at fagocytose døde celler og fremmedlegemer kan makrofager også sende signaler til andre immunceller via cytokiner. Makrofager udfører til en vis grad den kritiske funktion af antigenpræsentation og arbejder således sammen med T-celler for at støtte den adaptive immunitet. Derudover kan makrofager udskille cytokiner som IL-12 og spille en rolle i lokale immunforsvar, mens andre udskiller store mængder IL-10, som formidler deres rolle i vævsreparation. Således spiller de “store ædere” en række forskellige roller i immunsystemet ud over deres hovedopgave, nemlig fagocytose.
CD68 (D4B9C) XP® Rabbit mAb #76437: IHC-analyse af paraffinindlejret humant serøst papillært karcinom i æggestokkene ved hjælp af #76437.
CD68 (D4B9C) XP® kanin mAb #76437: IHC-analyse af paraffin-embeddet humant serøst papillært karcinom af ovariet ved hjælp af #76437.
CD163 (D6U1J) Kanin mAb #93498: IHC-analyse af paraffinindlejret humant ikke-småcellet lungekarcinom ved brug af #93498 udført på Leica® Bond™ Rx.
CD163 (D6U1J) Kanin mAb #93498: IHC-analyse af paraffin-embeddet humant ikke-småcellet lungekarcinom ved hjælp af #93498 udført på Leica® Bond™ Rx.
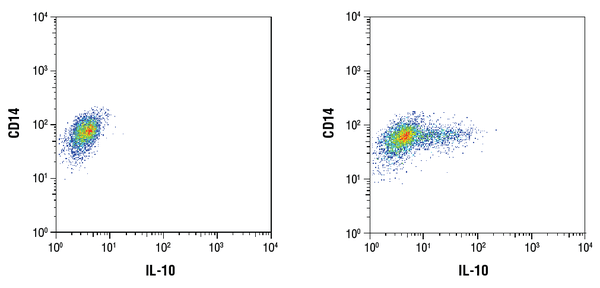
IL-10 (D13A11) XP® XP® kanin mAb #12163: Flowcytometrisk analyse af rensede CD14+ humane mononukleære celler fra perifert blod fra mennesker ubehandlet (venstre) eller behandlet med LPS (100ng/mL, 16 timer; højre) ved hjælp af et CD14-antistof og #12163. Brefeldin A #9972 (300ng/mL) blev tilsat til ubehandlede og behandlede celler efter 1 times LPS-stimulering. Anti-rabbit IgG (H+L), F(ab’)2-fragment (Alexa Fluor® 647-konjugat) #4414 blev anvendt som sekundært antistof.
IL-10 (D13A11) XP® Kanin mAb #12163: Flowcytometrisk analyse af rensede CD14+ humane mononukleære celler fra perifert blod fra mennesker ubehandlet (venstre) eller behandlet med LPS (100ng/mL, 16 timer; højre) ved hjælp af et CD14-antistof og #12163. Brefeldin A #9972 (300ng/mL) blev tilsat til ubehandlede og behandlede celler efter 1 times LPS-stimulering. Anti-rabbit IgG (H+L), F(ab’)2-fragment (Alexa Fluor® 647-konjugat) #4414 blev anvendt som sekundært antistof.
Dendritiske celler
I lighed med makrofager har dendritiske celler kapacitet til at opsluge cellulært og fremmed materiale, men i stedet for at fordøje det med henblik på fjernelse, bearbejder dendritiske celler materialet og præsenterer det som antigener for T-celler. Som sådan fungerer dendritiske celler som antigenpræsenterende celler eller accessoriske celler og videresender således information om patogener mellem det medfødte og det adaptive immunsystem. Dendritiske celler har fået deres navn efter deres tydelige celleprojektioner, som rækker ud og griber fat i skadeligt materiale, der skal fordøjes.
De umodne dendritiske celler, der stammer fra hæmatopoietiske knoglemarvsprogenitorer, gennemgår i begyndelsen en “indlæringsfase”, hvor de undersøger deres lokalområde for fremmed materiale og iværksætter et genkendelsesrespons via mønstergenkendelsesreceptorer (et almindeligt sæt af disse receptorer er de toll-like receptorer). Disse umodne dendritiske celler kan opholde sig forskellige steder med adgang til det ydre miljø, f.eks. i næse-, mave- og lungeslimhinden og endda i huden. Når de dendritiske celler genkender antigenet, vil de vandre til lymfeknuden, hvor de vil træne T-cellerne i at genkende antigenet og reagere i overensstemmelse hermed. Dendritiske celler er de eneste antigenpræsenterende celler, der kan aktivere både hukommelses- og naive T-celler. Toll-like-receptorer er en velundersøgt klasse af receptorer, der findes på makrofager og dendritiske celler, og som formidler genkendelse af og reaktion på fremmede patogener. Ud over at interagere direkte med T-celler kan dendritiske celler også sende signaler via cytokiner som f.eks. IL-12, som gør immunsystemet klar til det efterfølgende angreb på det skadelige materiale. Andre typer dendritiske celler kan udskille cytokiner, der signalerer, at de skal rekruttere flere makrofager til at rydde op i en overbelastning af affaldsmateriale. Som de vigtigste celleformidlere for antigenpræsentation spiller dendritiske celler således en uundværlig rolle i samspillet mellem det medfødte og det adaptive immunsystem.
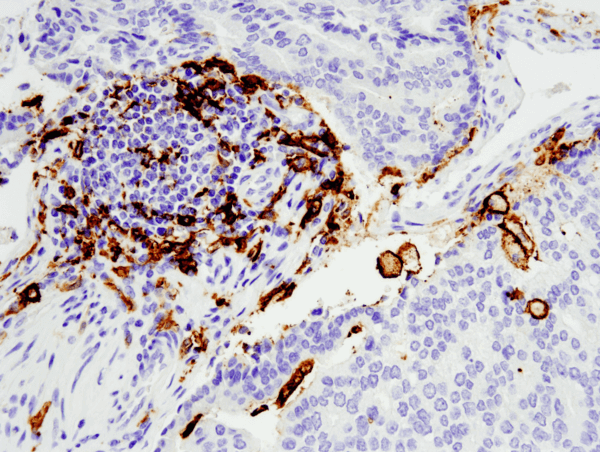
CD11c (D3V1E) XP® Rabbit mAb #45581: IHC-analyse af paraffinindlejret humant prostata adenocarcinom med #455812 udført på Leica® Bond™ Rx.
CD11c (D3V1E) XP® Kanin mAb #45581: IHC-analyse af paraffinindlejret humant prostata adenocarcinom med #455812 udført på Leica® Bond™ Rx.
Andre medfødte immunceller og signalering
Andre celler i det medfødte immunsystem omfatter mastceller, som fungerer i sårheling og hjælper med at yde en beskyttelse mod patogener. Når mastcellerne udløses af et patogen, kan de udskille cytokiner samt granula indeholdende histamin og heparin, som formidler yderligere immunrespons såsom rekruttering af makrofager og udvidelse af blodkar. Neutrofile, eosinofiler og basofiler betegnes samlet som granulocytter på grund af de karakteristiske granula i deres cytoplasma. I neutrofiler frigør granulerne giftige stoffer, som er rettet mod patogener som f.eks. svampe og bakterier.
Immunologi i sundhed og sygdom
Kræftimmunologi
At udnytte immuncellerne til at bekæmpe kræft er blevet et meget varmt forskningsemne på grund af succes i klinikken. Et nyligt fokus i den nuværende immunterapi omfatter målretning af de signalgivende checkpoint-proteiner, som f.eks. PD-1, der normalt forhindrer T-celleaktivering og -respons. Adoptiv celleterapi er en anden spændende tilgang, som indebærer immunoediting af T-celler, der er høstet fra patienten. T-cellerne er manipuleret til at udtrykke en specifik chimær antigenreceptor, som er specifik for patientens kræftceller. T-cellerne genindlægges derefter i patienten og er nu programmeret til at opsøge kræftcellerne og dræbe dem i overensstemmelse med den normale T-cellefunktion. Disse og andre metoder til at manipulere immunsystemet til at angribe patientens skadelige kræftceller udgør en banebrydende klasse af behandlingsformer til behandling af kræft.