Hvad er en kongenital koronararterieanomali?
Der er en løbende debat om, hvad der skal betragtes som normalt, og hvad der skal betragtes som en koronararterieanomali (CAA). Ifølge Angelini1 diagnosticeres CAA ved udelukkelse, hvilket betyder, at man i de tilfælde, hvor koronararteriernes morfologi ikke er normal, definerer normalitet i henhold til et statistisk kriterium (interval mellem plus eller minus 2 standardafvigelser fra middelværdien). Således vil en CAA være den koronararteriemorfologi, der observeres hos mindre end én procent af den almindelige befolkning.1,2 CAA kan opstå under normal eller patologisk kardiogenese: i det første tilfælde vil resultatet være isolerede CAA, som vi fokuserer på i denne artikel, mens de i det andet tilfælde vil være associeret med andre kardiale misdannelser.
KLASSIFIKATION
Der findes flere klassifikationer.1-3 En ny, der forsøger at standardisere de diagnostiske kriterier og grupperer CAA i 7 kategorier, er for nylig blevet foreslået4 (tabel 1).


Internationale grupper efterlyser registre, der som minimum omfatter de anomalier, der forårsager størstedelen af de kliniske hændelser (pludselig død og myokardieiskæmi), der tilskrives CAA,5-7 udgøres af dem, der har deres oprindelse i den kontralaterale eller “forkerte” sinus Valsalva. Denne gruppe omfatter koronararterier med et enkelt kar (“hyperdominans” i Rigatelli et al.s klassifikation4 ), da de skal forsyne myokardiet med blod fra et enkelt koronarostium og etablere ruter, der lejlighedsvis ligner dem for CAA med oprindelse i den forkerte sinus Valsalva (figur 1).

Figur 1. Koronararteriografía i venstre anterior oblique projektion, der viser en enkelt karret højre koronararterie.
INKIDENS
De forskellige definitioner eller klassifikationer og analysen af både angiografiske8,9 og obduktionsserier10 og i de senere år ekkokardiografiske serier11 resulterer i en rapporteret incidens af CAA, der varierer mellem 0,1 % og 8,4 %,1,8,11 hvilket gør det vanskeligt at fastslå det nøjagtige omfang af det problem, de repræsenterer. Samlet set kan incidensen være ganske lig incidensen for andre sygdomme, som vi har været i stand til at definere mere præcist, såsom
som hypertrofisk kardiomyopati (0,2 %)12 eller Wolff-Parkinson-White syndrom (0,1 % til 0,3 %)13
Incidensen af anomale koronararterier med oprindelse i den forkerte sinus og enkeltkarrene koronararterier i koronarangiografiske undersøgelser varierer mellem 0.28 % og 1,74 %.2,3,8,9,9,14-16 I betragtning af deres kliniske betydning vil vi fokusere vores gennemgang på disse anomalier.
KLINISKE PRÆSENTATIONER
I første omgang blev disse anomalier diagnosticeret under koronarangiografiske undersøgelser udført hos patienter med klapsygdom eller iskæmisk hjertesygdom, og de blev anset for at være uden klinisk betydning. Senere begyndte der at komme rapporter om pludselig død hos unge atleter, hvor det eneste tegn på sygdom var en anomali med oprindelse i kranspulsårerne.8,17
Det kliniske spektrum ved præsentationen er varierende: mens nogle patienter er asymptomatiske, viser andre angina pectoris, dyspnø, synkope, akut myokardieinfarkt, hjertesvigt og pludselig død.1,2,5,8,17-20 Aktuelt anses CAA for at være den næsthyppigste årsag til pludselig død hos atleter i USA.21
Betyder dette, at alle CAA bør anses for at indikere høj risiko? Absolut ikke, men ud fra et strategisk synspunkt bør de betragtes som “potentielt ondartede”, indtil der udføres yderligere undersøgelser for at udelukke myokardiskæmi fremkaldt af anomalien.
Den største bekymring ligger i at afgøre, hvilke CAA der kan præsentere pludselig død. I dag ved vi, at de, der følger et interarterielt (eller intramuralt) forløb, de, hvor den anomale koronararterie er den dominerende, og de, der giver kliniske tegn hos patienter under 30 eller 35 år, er dem, hvor incidensen af pludselig død er størst.22-26
Der er derfor vores tilgang til en CAA bør være forskellig alt efter patientens alder. Hos unge mennesker under 35 år vil vi “fokusere” på at forebygge pludselig død, mens vi hos dem over 35 år vil det vigtigste mål være at behandle myokardiskæmi (Figur 2).
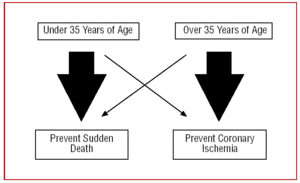
Figur 2. Forskellig fremgangsmåde alt efter patientens alder.
Fakuelt kan CAA på grund af deres oprindelse og anomale forløb blive beskadiget under operation med henblik på klapudskiftning, men dette kan også forekomme under perkutan lukning af foramen ovale. Af denne grund bør tilstedeværelsen af CAA udelukkes inden indgreb af denne type. 27-30
PATHOPHYSIOLOGI AF ISKEMI I CORONARY ANOMALIES
Der findes en række teorier31 til forklaring af de mekanismer, der frembringer iskæmi i CAA, men ingen af dem er blevet klart påvist. I en af dem anses årsagen for at være den markante vinkling af den anomale arterie, hvor den udmunder fra aorta. I modsætning til en normal koronararterie, som er vinkelret på aorta ved sit udspring, skal den anomale koronararterie bøje sig om sig selv for at nå sit normale forsyningsområde fra det modsatte sinus Valsalva fra det modsatte sinus Valsalva. På grund af dette vil den anomale koronararteries ostium være mindre, med ventillignende kamme, sammenlignet med det normale cirkulære ostium, og det kan blive komprimeret i tilfælde af en markant udvidelse af aorta, som f.eks. den, der observeres under anstrengende træning.32
En anden teori henviser til CAA’s oprindelige forløb. Når den er interarteriel, mellem aorta og pulmonalarterie, vil den stigning i trykket i de 2 kar, der opstår under anstrengelse, kunne medføre en kompression af den anomale koronararterie.33 Hvis det oprindelige forløb er intramuralt, kan obstruktionen desuden blive forstærket, da koronararterien kan blive deformeret i aortavæggen under perioder med hypertension.34
Nogle forfattere mener, at den mekanisme, der fører til iskæmi, indebærer produktion af en spasme i den anomale koronararterie som følge af endotelskader produceret af den anomale bane,35 og andre, at der ville blive produceret en intussusception af den proximale del af CAA i aortavæggen.31
Endeligt kan alle de diskuterede mekanismer producere akut eller kronisk iskæmi (mindre iskæmiske hændelser), der fremkalder myokardiefibrose, som igen kan være årsag til generering af dødelige arytmier.36
Hvordan diagnosticeres en koronar anomali?
Diagnosen kræver et højt mistænkeindeks og vurdering af dens tilstedeværelse under visse omstændigheder. Som vi nævnte ovenfor, opdages de fleste CAA tilfældigt under koronarangiografier udført hos patienter med iskæmisk hjertesygdom eller klapsygdom, der gennemgår denne undersøgelse forud for operation med henblik på klapudskiftning.
Unge mennesker, der ikke har nogen koronar risikofaktor eller associeret klapsygdom, udgør den største diagnostiske udfordring. Vi bør have mistanke om CAA ved tilstedeværelse af anstrengelsessynkope, dyspnø eller brystsmerter, der indikerer angina pectoris.24,26,35 Naturligvis er den første diagnostiske test, som vi alle udfører, standardergometri. Denne har imidlertid ikke vist sig at være særlig nyttig hos denne type patienter, da den normalt er negativ, hvilket tyder på, at iskæmi som følge af CAA kun forekommer lejlighedsvis.35,36
Da “funktionelle” test ikke er til megen hjælp, må vi derfor vælge en billeddiagnostisk undersøgelse, som gør det muligt at undersøge den koronare anatomi. Den ikke-invasive test, der i første omgang anbefales, er transthorakal ekkokardiografi (TTE).7,26,37-40 Hos størstedelen af disse patienter gør udførelsen af en simpel TTE i den parasternale kortakseprojektion i aortakroppens plan det muligt at skelne de to koronarostier og endda at bestemme CAA’s oprindelige forløb. Pellicia et al. undersøgte 1360 eliteatleter ved hjælp af ekkokardiografi og visualiserede ostium og den proximale del af venstre hovedkranspulsåren i 97 % af tilfældene og højre hovedkranspulsåren i 80 % af tilfældene.41
For nylig foretog Frommelt et al34 ekkokardiografi af alle børn og unge (aldersinterval, 3 måneder til 20 år), der blev henvist til deres hospital (1997-2002) med symptomer på myokardiskæmi, mistanke om medfødt hjertesygdom eller muskuloskeletale smerter. De gennemgik alle en konventionel TTE ved hjælp af Doppler farveflowkortlægning for at bestemme blodstrømmenes retning. De identificerede 10 patienter med anomal oprindelse af en koronararterie i den forkerte sinus (6 patienter med venstre koronararterie med oprindelse i højre sinus of Valsalva og 4 med højre koronararterie med oprindelse i venstre sinus of Valsalva). Ved hjælp af TTE med farvedopplerteknik observerede de et intramuralt forløb inden for aortavæggen hos ni af patienterne og et intramyokardialt forløb hos den resterende patient. Når forløbet af en CAA med oprindelse i den forkerte sinus er intramuralt, kan det se ud som om, at den kommer ud af sit normale ostium. Forfatterne anbefaler således anvendelse af farvedoppler til bestemmelse af strømningsretningen, når det er nødvendigt at udelukke tilstedeværelsen af en anomali.
Forbedringer i ekkokardiografiske billeddannelsesteknikker gør det muligt at bestemme oprindelsen og følge det oprindelige forløb af en CAA i visse grupper af patienter. Der er gennemført undersøgelser hos børn, unge og eliteatleter, men store serier, der omfatter den normale voksne befolkning, er endnu ikke blevet undersøgt. Identificering af koronarostierne hos unge patienter med denne symptomatologi bør således foretages systematisk ved TTE-undersøgelsen7,26 .
I patienter med et dårligt ekkokardiografisk vindue, eller når der fortsat er diagnostisk tvivl på trods af de kliniske indikationer, kan der for at gøre det muligt at visualisere CAA’s oprindelse og indledende forløb foretages transøsofageal ekkokardiografi (TEE)7,26,42,43 , computertomografi (CT)26,44-46–med elektronstråle eller multislice–(Figur 3) eller kardiel magnetisk resonansafbildning (CMRI)26,47,48 (Figur 4).

Figur 3. Multidetektor-computertomografibillede, der viser den circumflexe koronararterie (Cx), der har sit udspring i højre koronararterie (CD) og følger et retroaortisk forløb for at nå frem til sit normale fordelingsområde. Ao angiver aorta; AP, pulmonalarterie. Med venlig hilsen af Dr. Gabriel C. Fernández, Servicio de Radiología, Hospital Povisa, Vigo, Spanien.
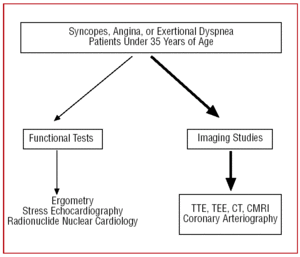
Figur 4. Diagnostisk protokol foreslået til patienter under 35 år med mistanke om koronararterieanomali. CMRI angiver kardiel magnetisk resonansbilleddannelse; CT, computertomografi; TEE, transøsofageal ekkokardiografi; TTE, transthorakal ekkokardiografi.
Hvilken teknik skal vi bruge og i hvilken rækkefølge? Hvert medicinsk team bør svare på dette spørgsmål i overensstemmelse med de tilgængelige teknikker og deres erfaring. Det, vi skal gøre, er at identificere CAA og dens indledende forløb ved hjælp af den mindst invasive teknik, vi har til rådighed. Selv om TEE er blevet anvendt til diagnosticering og identifikation af det indledende forløb af visse CAA’er, mener vi, at den på grund af dens semi-invasive karakter først bør anvendes, når andre teknikker har slået fejl. I dag synes det på grund af den stigende tilgængelighed og de fremragende tredimensionelle billeder, der kan opnås, at være klogt at vælge multidetektor CT (Figur 5) eller CMRI.49,50 Standard koronararteriografi vil være indiceret, hvis de andre undersøgelser ikke resulterer i en endelig diagnose. I denne henseende anbefalede den 36. Bethesda-konference51 for udvælgelse af konkurrenceatleter med kardiovaskulære anomalier, der blev offentliggjort i april 2005, følgende: “Koronaranomalier bør overvejes hos atleter med anstrengelsessynkope eller symptomatisk ventrikulær arytmi og bør undersøges ved hjælp af passende undersøgelser som f.eks. ekkokardiografi, CMR eller ultrahurtig computertomografi. Koronar angiografi er indiceret, hvis andre undersøgelser ikke er diagnostiske.” Kort sagt, de vælger ikke 1 diagnostisk undersøgelse eller en anden.
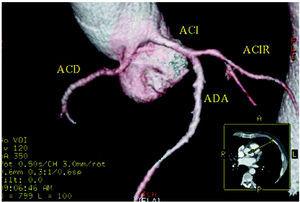
Figur 5. Multislice-computertomografi (16 skiver); tredimensionel renderet rekonstruktion, der viser højre koronararterie (ACD) med udspring i venstre sinus of Valsalva. ACI indikerer venstre koronararterie; ACIR, circumflex koronararterie; ADA, anterior descendens koronararterie. Med venlig hilsen af Dr. Joaquín Alonso, Servicio de Cardiología y Servicio de Diagnóstico por Imagen, Hospital de Fuenlabrada, Madrid, Spanien.
I patienter over 35 år, der præsenterer sig med kliniske tegn på angina pectoris eller gentagne synkoper, foretages der efter funktionstest (ergometri, anstrengelsesechokardiografi osv.) normalt en kateterundersøgelse, da den højere forekomst af åreforkalkning giver mistanke om koronararteriesygdom. I visse centre, der er udstyret med denne teknologi, kan patienter med et atypisk klinisk billede gennemgå en indledende screening med multidetector CT eller CRMI. Under begge omstændigheder vil CAA være et fund (figur 6).
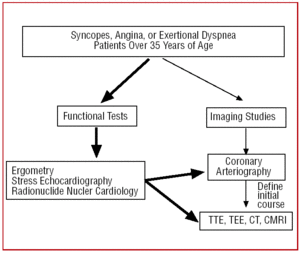
Figur 6. Diagnostisk protokol foreslået til patienter over 35 år med mistanke om koronararterieanomali. CRM angiver kardiel magnetisk resonansbilleddannelse; CT, computertomografi; TEE, transøsofageal ekkokardiografi; TTE, transthorakal ekkokardiografi.
Hvordan identificeres det indledende forløb af en koronaranomali?
Dette er et af de mest komplekse punkter i undersøgelsen af CAA, og det udgør et grundlæggende aspekt i risikoidentifikation.
For det første skal vi tage hensyn til, at navnet og arten af en koronararterie er defineret af det område, de forsyner, og ikke af deres oprindelse. Således er en koronararterie, der udspringer fra højre sinus Valsalva og forgrener sig for at forsyne territorierne for de forreste nedadgående arterier og arterier circumflex (Cx), ikke en højre koronararterie, men en venstre hovedkoronararterie med oprindelse i den forkerte sinus. Når en koronararterie udspringer fra den forkerte sinus, forbliver navnet, arten og endda funktionen den samme; kun dens oprindelse og indledende forløb er anomale2
Når den udspringer fra den forkerte sinus Valsalva, kan en anomal koronararterie nå sit normale forsyningsområde via mindst fem forskellige ruter2,52:
1. Retrokardialt, bag mitral- og trikuspidalklapperne.
2. Retroaortisk, sædvanligvis efterfulgt af Cx med udspring i højre sinus Valsalva eller i højre koronararterie, ved siden af den bageste aortavæg, i rillen mellem atrium og aorta (sinus transversus) (figur 3).
3. Præaortisk eller interarteriel (mellem aorta og pulmonalarterie), hvor den anomale højre koronararterie, venstre anterior descendens eller venstre hovedkoronararterie krydser septum eller det aortopulmonale rum. Dette er det forløb, der hyppigst har været forbundet med tegn på iskæmi og/eller pludselig død (figur 7 og 8).
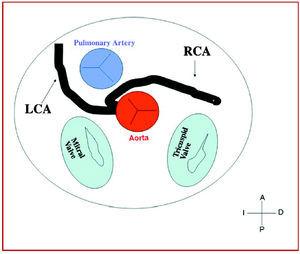
Figur 7. Diagram, der viser det interarterielle forløb af en højre koronararterie (RCA) med udspring i sinus controlateral.
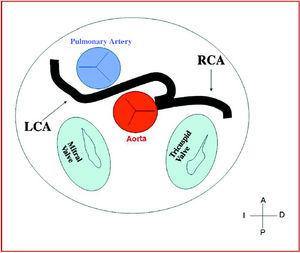
Figur 8. Diagram, der viser det interarterielle forløb af en venstre koronararterie (LCA) med udspring i sinus controlateral.
4. Intraseptalt, gennem den øverste del af det intraventrikulære septum. Den er intramyokardial i de fleste tilfælde og genkendes på angiografi på grund af den systoliske forsnævring, svarende til en myokardiebro, og fordi der normalt er 1 eller 2 septale perforatorforgreninger i denne zone (Figur 9).

Figur 9. Diagram, der viser det intraseptale forløb af en venstre koronararterie (CI), der har sit udspring i højre sinus Valsalva.
5. Prækardiel eller præpulmonal, kendetegnet ved sin subepikardiale placering, i den forreste væg af højre ventrikels udstrømningskanal eller infundibulum. Denne passage er normalt efterfulgt af en anomal højre koronararterie, venstre hovedstamme eller venstre forreste nedadgående koronararterie.
Der er rapporteret om andre mulige forløb eller endog flere forløb hos en given patient.2
Hvordan kan disse indledende forløb identificeres ved koronarangiografi? Oprindeligt mente man, at indføring af en guide wire i lungearterien efterfulgt af koronararteriografi i lateral projektion ville være tilstrækkeligt til at bestemme forholdet mellem anomalien og de store kar. Denne teknik er imidlertid af begrænset værdi, da f.eks. i en lateral visning både det septale og det interarterielle forløb synes at være placeret posteriort til lungearterien og anteriort til aorta, når det septale forløb i virkeligheden er placeret caudalt til begge kar.53
Der er også rapporteret om forskellige koronarangiografiske træk til genkendelse af anomalien og dens oprindelige forløb, selv før visualisering. I denne henseende foreslår Page et al54 to tegn, der gør det muligt at genkende en anomal oprindelse af Cx og dens indledende forløb:
1. Tegnet “uperfused myocardium”. Under den selektive opacificering af venstre koronararterie kan vi observere et avaskulært område i den posterolaterale zone af venstre ventrikel, der indikerer den anomale oprindelse af Cx. Det er først nødvendigt at injicere et kontrastmiddel i venstre koronar sinus for at udelukke involvering af ostier, der er uafhængige af de anterior descenderende arterier og Cx-arterierne. Hvis identifikationen af Cx imidlertid ikke er klar, skal vi huske, at det er mere almindeligt at observere Cx med oprindelse i højre koronar sinus eller i højre koronararterie end tilstedeværelsen af separate ostier i venstre koronar sinus.55
2. “Aortic root”-tegnet. Ved ventrikulografi viser den højre anterior oblique projektion konturen af den anomale Cx og følger dens forløb, når den passerer bag højre koronar sinus (Figur 10).
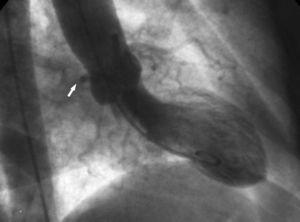
Figur 10. Ventrikulografi i højre anterior oblique projektion, der viser konturen af den anomale circumflexarterie (pil), der passerer bag højre koronar sinus; dette er kendt som aortic root sign eller Page’s sign.
I 1985 foreslog Ishikawa et al,56 efterfulgt af Serota et al i 1990,57 en række koronararteriografiske kriterier, der har til formål at definere forholdet, langs det indledende forløb, mellem det anomale kar og aorta og pulmonalarterien (Figur 11). Disse forfattere forsøgte at identificere de forskellige forløb på grundlag af orienteringen af den “løkke”, som den anomale koronararterie danner i forhold til resten af kranspulsåren56 , eller ved at anvende begrebet “prik” (visualisering af kontrastsøjlen i CAA, som på grund af den drejning, den foretager, antager morfologien af en prik57).
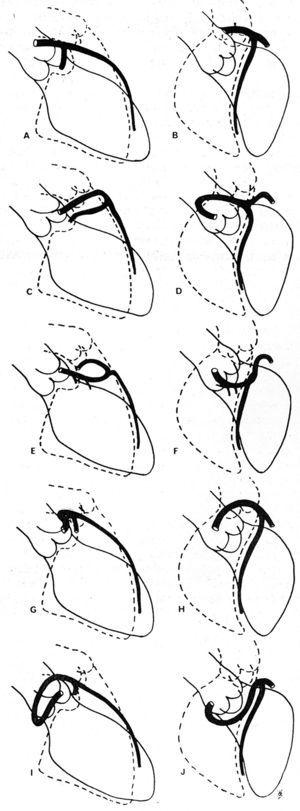
Figur 11. Illustrationer af koronarangiografibillederc af venstre anterior descenderende og proximale circumflexe koronararterier i højre anterior skrå projektion (A, C, E, G, I) og i venstre anterior skrå projektion (B, D, F, H, J), der viser de forskellige mulige indledende forløb af en venstre koronararterie, der har sit udspring i højre sinus of Valsalva. A og B repræsenterer en normal koronararterie; C og D viser anterokraniel “løkke”, beskrevet i det forreste forløb; E og F: anterokaudal “løkke”, septalt forløb; G og H: posterokraniel “løkke”, interarterielt forløb; I og J: posterokaudal “løkke”, retroaortikalt forløb. Taget fra Ishikawa et al.56
I mange tilfælde er det vanskeligt at identificere CAA’s oprindelige forløb ved hjælp af koronarangiografi, da denne teknik giver et todimensionelt billede af koronartræet, som er en kompleks tredimensionel struktur. Interventionel kardiolog med erfaring i diagnosticering af CAA, kan koronarangiografien være tilstrækkelig til korrekt identifikation af forløbet. På grund af den lave forekomst har de fleste interventionelle kardiologer dog kun begrænset erfaring med undersøgelse af CAA. Derfor er de i langt de fleste tilfælde ikke korrekt beskrevet. I et nyligt register, der omfattede 13 spanske hospitaler, blev det oprindelige forløb af den CAA, der blev rapporteret, ikke identificeret i de fleste tilfælde.16
Det er således i mange tilfælde nødvendigt med en yderligere billeddannelsesteknik for at identificere det oprindelige forløb af en CAA med oprindelse i den forkerte sinus. Som vi nævnte ovenfor, kan både TTE og TEE anvendes til dette formål, men i betragtning af den stigende tilgængelighed på vores hospitaler af ikke-invasive teknikker, der giver en mere korrekt og præcis definition af den koronare anatomi og dens forhold til de tilstødende strukturer hos patienter, der kan være kandidater til kirurgi, vælger vi CMRI eller multidetector CT.35,37,47,49
Hvad er den bedste terapeutiske fremgangsmåde?
Dette er et af de mest kontroversielle aspekter af denne tilstand, da der ikke er udarbejdet nogen officielle retningslinjer i denne henseende.
Når CAA er blevet diagnosticeret og karakteriseret, synes det logisk at forsøge at afgøre, om den fremkalder myokardiskæmi eller ej. Hvis patienten har haft et myokardieinfarkt (uden påviselig sammenhæng med åreforkalkning) eller har gennemgået genoplivning for pludselig død, der kan tilskrives anomalien, og er under 35 år, anbefaler de fleste forfattere revaskularisering.24,26,35
En thalliumstresstest eller ekkokardiografi under lægemiddel- eller træningsinduceret stress, der påviser reversibel iskæmi i anomaliens område, vil hjælpe i beslutningsprocessen.36
Hvad skal man gøre i tilfælde af unge, asymptomatiske personer, hos hvem CAA opdages tilfældigt, hvis risikokriterierne er opfyldt, men stresstest ikke giver tegn på iskæmi? For det første bør patienten indtage en stillesiddende livsstil.26,35
Corrado et al sammenlignede pludselig død hos unge atleter og ikke-atleter, og kun dem, der blev tilskrevet CAA eller arytmogen højrekventrikulær dysplasi, var forbundet med anstrengelse.58 Med hensyn til behandling er revaskularisering kontroversiel, men der er forfattere, der vælger denne tilgang, da pludselig død hos disse patienter er uforudsigelig og kan være det første tegn på CAA.24,26,34,35 Nogle forfattere går ind for årlige opfølgningsbesøg i disse tilfælde med ekkokardiogrammer eller thallium-stresstest og baserer deres beslutninger på resultaterne.7,36 Efter den kirurgiske behandling nyder patienterne en normal livsstil, herunder deltagelse i sport.25,34,49
Hos patienter over 35 år skal beslutningerne træffes på et individuelt grundlag. Risikoen for pludselig død er lavere, men da CAA kan fremkalde symptomatisk myokardiskæmi, foretages i nogle tilfælde revaskularisering (Figur 12).24,26
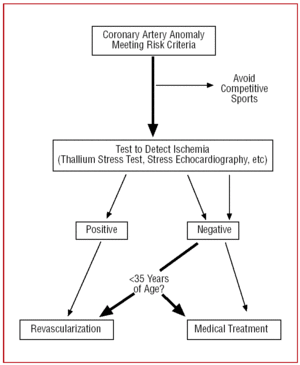
Figur 12. Terapeutisk protokol foreslået for koronaranomalier med oprindelse i den kontralaterale sinus of Valsalva i tilstedeværelse af risikofaktorer.
Nogle grupper undersøger anvendelsen af visse diagnostiske protokoller (intrakoronar ekkokardiografi til vurdering af det anomale koronarostium i hvile og efter dobutamininfusion eller væskeoverbelastning)59 eller anvendelsen af intrakoronære trykkabler til påvisning af iskæmi.60
Som det kan konstateres, synes den mest fornuftige fremgangsmåde, indtil der er udarbejdet officielle retningslinjer på dette område, at være for det første at bekræfte, om patientens alder og CAA’s anatomi er forbundet med risiko, og for det andet at verificere, at den koronar iskæmi (præsenteret af patienten eller påvist) klart er fremkaldt af anomalien.
HVORDAN SKAL REVASKULARISERINGEN FORETAGES?
Logisk set er det nødvendigt at behandle hvert enkelt tilfælde individuelt i henhold til den koronare anatomi; revaskularisering kan således være enten kirurgisk eller perkutan.
Kirurgisk revaskularisering omfatter aortokoronar bypass, ostial reimplantation eller unroofing-teknikken, som frigør det intramurale segment af CAA ved hjælp af et snit i den væg, som CAA og aorta deler, hvorved der skabes en ny, større åbning i den relevante sinus.61,62 Der er stor uenighed om kirurgisk revaskularisering hos disse patienter, især hos unge mennesker. Aortokoronar bypass-transplantation er blevet stærkt kritiseret7,63 på grund af dens “begrænsede” patency og det uundgåelige konkurrerende flow mellem bypasset og CAA’en. Derfor er man i stigende grad begyndt at anvende en unroofing-teknik, som synes at være mere fysiologisk62 .
Percutan intervention med implantation af stents i området med kompression mellem de store kar og i det anomale ostium er blevet udført i flere tilfælde, hos voksne, med kortvarig succes64 . Til dato foretrækkes kirurgisk revaskularisering hos unge patienter, og den perkutane procedure udføres kun hos voksne.26,62-64 Det er tydeligt, at der i begge tilfælde er behov for langtidsopfølgning.
Er medicinsk behandling en mulighed?
Manglen på serier og kontrollerede undersøgelser gør det vanskeligt at svare på dette spørgsmål. Der findes rapporter med 2 års og 5 års opfølgning hos patienter, der eller patienter, der nægtede operation, hvor tilgangen enten var afventende behandling eller behandling med betablokkere, og blandt dem var der ingen tilfælde af pludselig død.65-68 Nogle forfattere argumenterer dog imod beslutningen om at iværksætte “livslang” behandling hos børn og unge.7
GORE UOPLØSTEDE PROBLEMER
Den sande risiko for pludselig død i forbindelse med hver enkelt anomali er ukendt.5 Årsagen hertil er, at risikoen beregnes på grundlag af obduktionsundersøgelser, som ikke angiver den reelle risiko for, at en person dør som følge af en CAA, men som antyder muligheden for, at en person, der har oplevet pludselig død, har en CAA7 . Desuden kan de beregnede risici være overvurderet i forhold til den almindelige befolkning, da de stammer fra serier af konkurrencesportsudøvere, der, som det er blevet rapporteret, har en to gange højere risiko for pludselig død end en stillesiddende person.69 Vi ved, at risikoen for pludselig død som følge af en CAA er større hos unge mennesker; faktisk anbefales den ene eller den anden terapeutiske tilgang, alt efter om patienten er under 30 eller 35 år gammel. Disse grænseværdier er baseret på de få undersøgelser, der er foretaget på dette område23,25 , og de skal derfor kun betragtes som vejledende. Derfor bør den terapeutiske tilgang altid besluttes individuelt.
Hvis man vælger den ovenfor beskrevne kirurgiske løsning, skal man tage hensyn til, at der ikke findes nogen serier, hvor patienternes forløb er undersøgt i mere end to år. Til usikkerheden om bypassens gennemgangsforløb kommer den mulige skade på aortaklappen, som udtagningen kan medføre. I den forbindelse er der rapporteret om aortainsufficiens eller endog klapudskiftning efter dette indgreb.7,70 Vi må huske på, at hjertekirurgi altid indebærer en risiko for neurologiske komplikationer, hvis forekomst hos unge mennesker er blevet anslået til ca. 2,3 %.71
Endeligt anbefaler retningslinjerne for udvælgelse af konkurrenceatleter med kardiovaskulære anomalier, at patienter med CAA udelukkes fra al konkurrenceidræt.51 Igen er data fra en population af atleter blevet ekstrapoleret til den generelle befolkning. Hos en teenager kan det være vanskeligt at definere begrebet “konkurrencesport”. Desuden kan det at forbyde en teenager eller ung voksen at deltage i gymnastiktimer eller i den sport, han eller hun måske nyder, forårsage mere skade end gavn. Måske bør man undgå anstrengende sport, men ikke en mindre krævende sport.7
KONKLUSION
Koronararterier med oprindelse i den forkerte sinus of Valsalva udgør den gruppe af CAA, der oftest er forbundet med myokardiskæmi og især med pludselig død.
Mistankeindekset for denne anomali bør være højt hos unge patienter, der viser kliniske tegn på angina pectoris, dyspnø eller anstrengelsessynkope. I disse tilfælde bør der udføres TTE i et forsøg på at identificere begge koronararteriernes ostier og det indledende forløb.
Vi bør klart definere det indledende forløb af hver enkelt anomal koronararterie ved hjælp af billeddannelsesteknikker som TTE, TEE eller helst multidetektor CT eller CMRI, i overensstemmelse med vores hospitals karakteristika.
Vi skal prioritere oprettelsen af nationale og internationale registre, der gør det muligt for os at bestemme forekomsten af disse anomalier samt de tilhørende morbiditets- og mortalitetsrater, prognose, behandling, mulige genetiske eller miljømæssige påvirkninger og kort sagt lære så meget om dette som muligt.
Det er nødvendigt at foretage en langtidsopfølgning af patienter, der har gennemgået en operation for CAA, især unge mennesker. Under alle omstændigheder kan revaskularisering (kirurgisk eller perkutan) være en gyldig for patienter med denne type sygdom.
ANERKENDELSER
Vi takker Dr. Joaquín Alonso og Dr. Gabriel C. Fernández for deres hjælp til at opnå multidetector-computertomografibillederne.