Manuskript accepteret den :29 Aug 19
Publiceret online den: 18-09-2019 Plagiatskontrol: Ja
Reviewed by: Farooq Sher
Gennemgået af: Farooq Sher
Gennemgået af: Farooq Sher
Grigorios Kyriakopoulos
Slutlig godkendelse af::: Grigorios Kyriakopoulos
Ayush Dogra
How to Citeclose | Publication Historyclose
Vijitra Luang-In1* , Manatchanok Yotchaisarn1, Worachot Saengha1, Piyachat Udomwong2, Sirirat Deeseenthum1 og Kedsukon Maneewan1
, Manatchanok Yotchaisarn1, Worachot Saengha1, Piyachat Udomwong2, Sirirat Deeseenthum1 og Kedsukon Maneewan1
1Natural Antioxidant Innovation Research Unit, Department of Biotechnology, Faculty of Technology, Mahasarakham University, Khamriang, Kantarawichai, Maha Sarakham, 44150, Thailand.
2International College of Digital Innovation, Chiang Mai University, Chiang Mai 50200, Thailand.
Korresponderende forfatter E-mail: [email protected]
DOI : https://dx.doi.org/10.13005/bpj/1735
Abstract
Denne undersøgelse havde til formål at isolere og identificere bakterier, der kan producere amylaseenzym fra den uudforskede Nasinuan-skov, Kantarawichai-distriktet, Mahasarakham-provinsen, Thailand. Tretten bakterieisolater med amylaseproducerende kapacitet på 1% stivelsesagar blev identificeret ved hjælp af 16S rRNA-sekventering. Tolv bakterier var gram-positive, stavformede og identificeret som Bacillus spp. og en bakterie med gram-negativ og stavformet karakter var Enterobacter cloacae. Deres nærmeste slægtninge blev fundet i Indien, Kina, Korea, Indonesien, Argentina, Argentina, Italien, Israel, USA, Argentina og Sydafrika. Disse bakterier blev testet for specifik amylaseaktivitet efter 1-3 dages enzyminduktion med 1% stivelse ved 37°C. Resultaterne viste den højeste specifikke aktivitet ved inkubation på dag 2 i følgende rækkefølge: Bacillus cereus 3.5AL2 > 3.4AL1 > 1.4AL3, og derfor blev 2-dages enzyminduktion valgt til yderligere analyse. Bacillus sp. 3.5AL2 viste sig at udvise den højeste specifikke amylaseenzymaktivitet på 1,97 ± 0,41 U/mg protein under de optimale betingelser på 60 °C og pH 7,0 efter 30 minutters inkubation med 1 % stivelse i 0,05 M PBS-buffer. Denne amylaseproducerende bakteriestamme har et stort potentiale for anvendelser inden for fødevare- og landbrugsindustrien i Thailand.
Nøgleord
Amylase; Bakterier; Nasinuan skov; jord
Download denne artikel som: ![]()
Kopier følgende for at citere denne artikel:
Luang-In V, Yotchaisarn M, Saengha W, Udomwong P, Deeseenthum S, Maneewan K. Isolation and Identification of Amylase-producerende Bacteria from Soil in Nasinuan Community Forest, Maha Sarakham, Thailand. Biomed Pharmacol J 2019;12(3).
Kopier følgende for at citere denne URL:
Luang-In V, Yotchaisarn M, Saengha W, Udomwong P, Deeseenthum S, Maneewan K. Isolation and Identification of Amylase-producerende Bacteria from Soil in Nasinuan Community Forest, Maha Sarakham, Thailand. Biomed Pharmacol J 2019;12(3). Available from: http://biomedpharmajournal.org/?p=28497
Introduktion
De stivelseshydrolytiske amylaser (α-amylase, β-amylase og glucoamylase) er nogle af de mest udbredte enzymer i nutidens bioteknologi. Glucoamylaser (1,4-α-D-glucan glucanohydrolase; EC 3.2.1.3) eller amyloglucosidaser, er exo-virkende amylaser, der producerer glucose fra den ikke-reducerende ende af stivelse og tilsvarende oligosaccharider. Glucoamylaser anvendes kommercielt til omdannelse af malto-oligosaccharider til glukose1. Selv om amylaser fremstilles fra forskellige kilder (mikroorganismer, planter og dyr), er amylaser fra mikrober mest velegnede til industriel produktion på grund af mikrobiel kort vækstperiode, lav omkostningseffektiv produktion, miljøvenlig adfærd, færre håndteringsproblemer for arbejdstagerne, produktivitet2 og nem manipulation af bakterielle gener3. Bakterier og svampe har en tendens til at udskille amylaser uden for cellerne for at foretage ekstracellulær fordøjelse af stivelse til sukkerstoffer. Der er observeret en stigende industriel efterspørgsel efter mikrobielle amylaser på grund af deres reaktionsspecificitet, de milde betingelser, der er nødvendige for reaktionen, og et mindre energiforbrug end de konventionelle ikke-enzymatiske kemiske metoder.
Den omfattende anvendelse af amylase i fødevare-, stivelseslikvefektion, saccharificering, bryggeri, vaskemiddel-, papir-, tekstil- og destillationsindustrien har medført en større opmærksomhed på at øge den indenlandske produktion af α-amylase4. Bacillus er en almindelig bakteriekilde til industriel amylaseproduktion. De forskellige stammer har imidlertid forskellige optimale vækstbetingelser og enzymproduktionsprofiler. Der er rapporteret om Bacillus-stammer, der i vid udstrækning er blevet anvendt industrielt til produktion af α-amylase, herunder B. amyloliquefaciens, B. subtilis5 , B. licheniformis6 , B. stearothermophilus7 , B. megaterium8 og B. circulans9.
Der er hidtil blevet dokumenteret en række amylaseproducerende bakterier, men der er ikke blevet rapporteret om nogen undersøgelse af amylaseproducerende bakterier fra jorden i Nasinuan Community Forest, Kantharawichai District, Mahasarakham Province, Thailand. Denne skov synes at være rig på mikrobiel biodiversitet, som kan være nyttig til produktion af industrielle enzymer, herunder amylase. Dette er den første rapport om identifikation af amylaseproducerende bakterier, der er isoleret fra Nasinuan Forest. Disse bakterielle amylaser kan anvendes lokalt i forskellige industrier, herunder papirmasse og papir, tekstil, bioethanol, bryggeri, fødevareforarbejdning, dyrefoder og landbrug i Thailand i fremtiden.
Materialer og metoder
Jordprøver
Jordprøver blev tilfældigt indsamlet under jordoverfladen 15 cm og opbevaret i polystyrenposer fra Nasinuan Community Forest, Kantarawichai District, Mahasarakham Province, Thailand (areal på 9.6 hektar; koordinat 16.340941, 103.210799).
Isolering af amylaseproducerende bakterier
Jordprøve (10 g) blev suspenderet i 90 mL steril 0,85 % NaCl-opløsning. Suspensionerne (100 µL) af serielle fortyndinger blev spredt på stivelsesagar (g/L); 3,0 oksekødsekstrakt, 10,0 opløselig stivelse, 15,0 agar pH 7,0 og blev inkuberet ved 37 ºC i 7 dage. Derefter blev pladerne oversvømmet med Gram’s jod. Alle kolonier med dannelse af en klar zone omkring kolonierne blev subkultiveret i flydende bouillon og udstrøget mindst fem gange for at opnå rene isolater som bekræftet ved Gram-farvning og 1000X lysmikroskopisk observation. De rene isolater blev punktinokuleret på stivelsesagar og inkuberet ved 37 °C i 7 dage. De klare zoners diametre i forhold til koloniernes diametre blev målt ved hjælp af en lineal som forholdet Halo : koloni.
16S rRNA-gen-sekventering og fylogenetisk analyse
Rene bakterieisolater blev identificeret ved hjælp af genomisk DNA, der blev opnået ved ovennævnte metode og universelle primere: fremadrettet primer 27F 5′-GAGAGAGTTTGATYCTGGCTCAG-3′ og omvendt primer 1492R 5’AAGGAGGAGTGATCCARCCGCA -3′. I 25 µL PCR-blanding bestod den af genomisk DNA 0,5 ng, 2X Master Mix (One PCR) bestående af 100 mM Tris-HCl (pH 9,1), 0,1 % TritonTMX-100, 200 mM dNTP, 1,5 mM MgCl2, 0,005 U Taq DNA-polymerase og 0,2 µM fremadrettet og omvendt primer med volumenjustering med nukleasefrit vand. PCR-termocykleren (Thermo Scientific Hybaid Px2) blev programmeret på følgende måde: (1) indledende denaturering i 2 minutter ved 94 ºC i 1 cyklus; (2) denaturering ved 94 ºC i 45 s; annealing ved 54 ºC i 45 s og forlængelse ved 72 ºC i 1 minut i 32 cyklusser; (3) endelig forlængelse ved 72 ºC i 7 minutter. Prøverne blev opbevaret ved 4 ºC indtil videre analyse. PCR-produkterne af 16S rRNAs (~ 1 500 bp) blev påvist på 0,8 % agarosegel, renset ved hjælp af PCR-produktrensningssættet (Vivantis, Malaysia), sendt til First Base Co. Ltd. (Malaysia) med henblik på DNA-sekventering. Sekvenserne af 16S rRNA-genet blev derefter sammenlignet med andre sekvenser, der er tilgængelige i GenBank, ved hjælp af BLASTN-programmet (Basic Local Alignment Search Tools)10 . Det fylogenetiske træ blev konstrueret ved hjælp af Muscle-metoden til sekvenstilpasning og maximum likelihood-metoden ved hjælp af MEGA X med 1 000 replikater af bootstrap-værdier11. Alle 16S rRNA-partielle sekvenser af vores amylaseproducerende isolater blev deponeret på NCBI-databasen.
Bestemmelse af amylaseenzymaktivitet
Metoden fulgte Bhaskara et al. (2011)12. De tre bakterier med de højeste Halo: Koloniforhold blev udvalgt til bestemmelse af amylaseenzymaktivitet. Hvert isolat blev subkultiveret i stivelsesvæske-bouillon (g/L): 10,0 opløselig stivelse, 10,0 pepton, 20,0 gærekstrakt, 0,05 KH2PO4, 0,015 MnCl2.4H2O, 0,25 MgSO4.7H2O, 0,05 CaCl2.2H2O, 0,01 FeSO4.7H2O og inkuberet ved 37 ºC, 150 rpm i 1, 2 og 3 dage. Den klare supernatant (det rå ekstracellulære amylaseenzym) blev opnået efter centrifugering ved 10 000 g i 15 min. ved 4 ºC. Det rå ekstrakt blev koncentreret ved hjælp af en MWCO 10 kDa ultracentrifugeproteinkoncentrator (Vivaspin, Sartorius, UK).
Den DNS-metode13 blev anvendt til at bestemme amylaseaktiviteten af hvert bakterieisolat ved hver enzyminduktionsdag. En mL rå enzym blev blandet med 1 mL 1 % stivelsesopløsning i 1 mL 0,05 M natriumphosphatbuffer pH 7,0. Prøverne blev inkuberet ved 37°C i 30 min. Efter inkubationen blev der tilsat 0,5 mL DNS-opløsning til hver prøve for at stoppe reaktionen og derefter kogt ved 100°C i 5 min i vandbad. Opløsningens farveintensitet blev observeret ved at måle den optiske tæthed (OD) ved hjælp af et spektrofotometer ved 575 nm. Målingerne blev sammenlignet med en forberedt blindopløsning (uden råenzym). OD-værdierne for prøverne ved T30min blev fratrukket værdierne for prøverne ved T0min, da der stadig var glukose tilbage i prøverne ved T0min efter enzyminduktionsprocessen efter 1, 2 og 3 dage. Processen blev udført i tre eksemplarer. Koncentrationen af glukose, der blev produceret for hver opløsning, blev beregnet ud fra glukose-standardkurven. Aktiviteten af amylase blev beregnet. En enhed amylaseaktivitet er defineret som den mængde amylase, der er nødvendig for at katalysere dannelsen af reducerende sukker, som svarer til 1 µmol glukose pr. min under forsøgsbetingelser14.
Det rå enzym fra det bakterieisolat, der havde den højeste aktivitet, blev valgt til det videre arbejde.
For at bestemme de udvalgte isolaters specifikke enzymaktivitet blev Folin-Lowry-metoden til estimering af totalprotein anvendt15. Den specifikke enzymaktivitet blev målt ved hjælp af følgende formel:
Specifik aktivitet (U/mg) = enzymaktivitet (U/ml)/ekstracellulær proteinkoncentration (mg/ml)
Optimal pH og temperatur for amylaseenzymaktivitet
Optimal pH og temperatur for amylaseenzymaktivitet
Opløselige stivelsesopløsninger (1 %) i forskellige pH-værdier fra 3 til 10 blev testet. En mL af forskellige 1 % substratopløsninger blev tilsat sammen med 1 mL af de respektive buffere; 0,05 M citratbuffer (pH 3 til 5), 0,05 M natriumphosphatbuffer (pH 6 og 7), 0,05 M Tris-HCl (pH 8 og 9) og 0,05 M glycin NaOH (pH 10). Der blev også tilsat 1 mL råenzym til disse buffere. Prøverne blev inkuberet ved 37 °C i 30 minutter. Den specifikke amylaseaktivitet blev beregnet. Den pH-værdi, ved hvilken den højeste aktivitet blev observeret, blev noteret. Ligeledes blev der fremstillet forskellige substratopløsninger ved at opløse 1 % opløselig stivelse i pH 7,0-opløsninger. 1 mL af 1 % opløselig stivelse blev tilsat sammen med 1 mL 0,05 M natriumphosphatbuffer (pH 7). En mL råenzym blev også tilsat til bufferne. Prøverne blev inkuberet ved 20, 30, 40, 40, 50, 60, 70 og 80 °C i 30 minutter. Den specifikke amylaseaktivitet blev beregnet. Den temperatur, ved hvilken den højeste aktivitet blev observeret, blev noteret. Både optimal pH og temperatur blev anvendt til at bestemme den endelige specifikke amylaseenzymaktivitet.
Statistisk analyse
Envejsanalyse af varians (One-way ANOVA) blev anvendt med Duncan Multiple Range’s Test på SPSS Statistics Ver. 17.0. Resultaterne blev udtrykt som gennemsnit ± SD med statistisk forskel når p < 0,05.
Resultater
Isolering af amylaseproducerende bakterier
I denne undersøgelse viste 13 amylase-positive isolater klare zoner på 1% stivelsesagar med forskellige Halo : Koloniforhold. De kolonier, der viste klare zoner i jodopløsning, blev taget som positive stivelsesnedbrydende bakteriekolonier. Alle bakterieisolater viste lignende kolonimorfologier og fremstod som Gram-positive og stavformede bakterier (tabel 1). Resultatet viste, at forholdet Halo : koloniforholdet varierede fra 1,18 til 1,71 (tabel 1). Bakterieisolaterne blev derefter anvendt til at bestemme den optimale amylaseenzyminduktionsvarighed, og kun de 3 isolater med de højeste specifikke aktiviteter blev vist i 3.4.
Stammeidentifikation af amylaseproducerende bakterier
Alle 13 amylasepositive bakteriestammer blev underkastet 16S rRNA-gen-sekventering med henblik på stammeidentifikation. BLAST-resultaterne viste, at alle amylasepositive isolater tilhører slægten Bacillus, bortset fra et isolat, der tilhører Enterobacter (tabel 2). Deres nærmeste slægtninge blev fundet i Indien, Kina, Korea, Indonesien, Argentina, Argentina, Italien, Israel, USA, Argentina og Sydafrika med en identitet på 96-100 %.
Fylogenetisk analyse
Det fylogenetiske træ af 13 amylasepositive bakteriestammer og 2 referencestammer med formodede amylaseenzymer ved hjælp af MEGA 7.0 viste, at E. cloacae 2.1AL2 var evolutionært forskellig fra de andre Bacillus-stammer (Fig. 1). B. thuringiensis serovar konkukian (NCBI accession no. AB617494.1) referencestammen udviklede sig anderledes end vores Bacillus-bakterier. En anden referencestamme B. cereus ATCC 14579 (NCBI accession no. MG708176.1) isoleret fra saflorblade, Eqypt, viste imidlertid en lignende udvikling som vores bakterier (fig. 1).
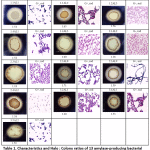 |
Tabel 1: Karakteristika og Halo : Koloniforhold af 13 amylaseproducerende bakteriestammer
Klik her for at se tabellen |
Optimal amylaseenzyminduktionsvarighed
Det blev vist, at inkubationsvarigheden, der inducerede amylaseproduktion med den højeste specifikke aktivitet, var 2-3 dage blandt alle 3 isolater uden statistiske forskelle. Bacillus sp. 3.5AL2 syntes at producere den højeste specifikke aktivitet på 0,91 ± 0,12 U/mg på dag 2 ved 37 °C (tabel 3). Derfor blev denne stamme og denne betingelse anvendt til induktion af amylaseproduktion med henblik på yderligere analyse.
Optimal pH og temperatur for amylaseenzymaktivitet
Bacillus sp. 3.5AL2 viste den højeste specifikke aktivitet ved pH 7,0 ved 37°C og ved 60°C ved pH 7,0 (fig. 2). Således blev begge optimale betingelser anvendt til at bestemme den specifikke amylaseaktivitet, og der blev opnået 1,97 ± 0,41 U/mg (tabel 4).
Tabel 2: Tretten amylase-positive bakteriestammer identificeret ved 16S rRNA-analyse
| Isolat | Accession
nr. a |
Nærmeste slægtningeb | Accessionsnr.c | % Identityd | Origine | |
| 1.1AL1 | MK578206 | Bacillus pseudomycoides FJAT-hcl-17 | KY653098.1 | 99% | Host Paris polyphylla var. chinensis, Kina | |
| 1.1AL2 | MK578207 | Bacillus sp. 188Cu-As | KM349197.1 | 99% | Biofilm, Argentina | |
| 1.2AL3 | MK578208 | Bacillus anthracis SAK4 | MG706137.1 | 100% | Jord, Republikken Korea | |
| 1.4AL1 | MK578209 | Bacillus sp. CNJ732 PL04 | DQ448749.1 | 99% | Marinesediment, USA | |
| 1.4AL3 | MK578210 | Bacillus cereus B19 | MK229038.1 | 99% | Hvedekorn, Isarael | |
| 2.1AL2 | MK578211 | Enterobacter cloacae HNXY160623 | KX431213.1 | 98% | Fugleembryo, Kina | |
| 2.3AL1 | MK578212 | Bacillus thuringiensis BD17-E12 | HF584771.1 | 99% | Grapevine rodsystem, Italien | |
| 2.3AL8 | MK578213 | Bacillus cereus DFT-1 | KY750685.1 | 98% | Sejvand fra industriområde, Indonesien | |
| 2.3AL9 | MK578214 | Bacillus sp. PTP1 | KY910137.1 | 96% | Papayabakteriedarm, Indien | |
| 2.4AL2 | MK578215 | Bacillus pseudomycoides 74 | MH910178.1 | 99% | Indien | |
| 3.2AL1 | MK578216 | Bacillus thuringiensis
IARI-IIWP-38 |
KF054891.1 | 99% | Hvede rhizospere, Indien | |
| 3.4AL1 | MK578217 | Bacillus cereus F4a | MK088302.1 | 99% | Tea rhizosfærejord, Indien | |
| 3.5AL2 | MK578218 | Bacillus cereus SP1-AB4 | MH013307.1 | 99% | Marinesvamp, Sydafrika |
aGenBank accession no. af vores stammer deponeret på NCBI-webstedet (http://www.ncbi.nlm.nih.gov/pubmed)
bNærmeste art med højeste % identitet og højeste Max-score på BLAST-søgning
cGenBank accession nr. af nærmeste beslægtede stammer på NCBI-webstedet
dB Baseret på BLAST-søgningsresultater, identitet (%) af stammer sammenlignet med de
nærmeste slægtninge.
eBaseret på BLAST-søgningsresultater, oprindelse af de nærmeste slægtninge.
 |
Figur 1: Fylogenetisk træ af 13 amylase-positive bakteriestammer og 2 Bacillus-referencestammer
Klik her for at se figur |
| Figur 2: Optimal pH (A) og temperatur (B) for amylase-enzymaktivitet fra Bacillus sp. 3.5AL2 | Figur 2: Optimal pH (A) og temperatur (B) for amylaseenzymaktivitet fra Bacillus sp. 3.5AL2
Klik her for at se figur |
Tabel 3: Optimal amylaseenzyminduktionsvarighed
|
Isolat |
Specifik amylase aktivitet
(U/mg protein) |
||
| 24 h | 48 h | 72 h | |
| Bacillus sp. 1.1AL2 | 0,21 ± 0,04Ab | 0,40 ± 0,04Ca | 0,41 ± 0,04Ba |
| B. cereus 2.3AL8 | 0,45 ± 0,06Ab | 0,62 ± 0,04Ba | 0,65 ± 0,06Aa |
| Bacillus sp. 3.5AL2 | 0,32 ± 0,11Ab | 0,91 ± 0,12Aa | 0,86 ± 0,11Aa |
Værdierne er middelværdier ± SD i tre eksemplarer.
Kapital og små bogstaver angiver statistiske forskelle (p < 0,05) i henholdsvis kolonne og række.
Tabel 4: Specifik amylaseenzymaktivitet ved optimal pH og temperatur
| Stamme | Aktivitet (U/mg) | Optimal Temp. (°C) | Optimal pH |
| Bacillus sp. 3.5AL2 | 1.97 ± 0.41 | 60 | 7.0 |
Diskussion
Den thailandske told (2017) data viste, at Thailand har importeret industrielle enzymer fra andre lande med en værdi på 2,625 mio. baht i 2016, og importraten steg med 9,40 % om året. Et af de mest udbredte enzymer i Thailand, amylase, er blevet anvendt i beklædningsindustrien, tekstilindustrien og fødevareindustrien. Der er imidlertid mangel på lokal produktion af kommerciel amylase, og derfor havde dette arbejde til formål at isolere jordbakterier fra lokale skove med kapacitet til at producere amylase til industriel brug.
Stivelseholdige rester kan være en bedre potentiel kilde, hvor amylasepositive bakterier kan isoleres16. Desuden kunne disse isoleres fra steder som f.eks. cassava-landbrug, jord og forarbejdningsmelfabrikker17. I dette arbejde blev 13 amylaseproducerende bakterier isoleret og identificeret som Bacillus spp. og Enterobacter sp. hvilket svarer til de tidligere rapporter18, 19, 20 , hvor Bacillus spp. for det meste blev fundet som amylaseproducenter.
Vores resultater viste, at Bacillus sp. 3.5AL2, isolatet med den højeste specifikke aktivitet blandt 13 isolater, producerede den højeste specifikke aktivitet på 0,91 ± 0,12 U/mg ved 2 dages inkubation ved 37°C. Den optimale pH-værdi og temperatur for amylaseaktivitet var henholdsvis 7,0 og 60 °C. Begge optimale betingelser gav en specifik amylaseaktivitet fra Bacillus sp. 3.5AL2 på 1,97 ± 0,41 U/mg. Det er kendt, at enzymer, der kan arbejde ved høj temperatur, anses for at have en fordel i industrielle processer som f.eks. stivelseslikvefektion21. Amylase fra Bacillus sp. 3.5AL2 kan således potentielt anvendes i sådanne industrier.
Sådan viste Bacillus sp. GM890 den optimale temperatur for amylase ved 60 °C20, Bacillus licheniformis AI20 viste den højeste aktivitet mellem 60-80 °C22 og Bacillus sp. WA21 havde en lavere optimal temperatur på 55 °C for amylase19.
De fleste af de stivelsesnedbrydende bakteriestammer viste et pH-interval på mellem 6,0 og 7,0 for normal vækst og enzymaktivitet4. Ligeledes havde Bacillus sp. 3.5AL2 i dette arbejde en optimal pH-værdi på 7,0, hvilket ikke kræver nogen tilsætning af syre eller alkali. Vores resultat var i overensstemmelse med Bacillus sp. isoleret fra dhal-industriaffald, der udviser en optimal temperatur på 60 °C23 og B. amyloliquefaciens med en optimal pH-værdi på 7,024. Ikke desto mindre viste Bacillus sp. WA21 en optimal pH-værdi for amylase på 6,0, hvilket er mindre end den, der blev fundet i denne undersøgelse19.
Denne type undersøgelse er meget vigtig for udgangspunktet for kommerciel amylaseproduktion i Thailand. Yderligere forskningsundersøgelser er dog afgørende for at gøre amylaseproduktionen omkostningseffektiv. Der er behov for en grundig enzymkarakterisering, yderligere bestemmelse af termostabilitet, pH-stabilitet, indflydelse af forskellige metalioner og forskellige substrater, især landbrugsaffald i Thailand, og deres koncentrationer.
Efter indhentning af alle de nødvendige data som nævnt ovenfor, menes det, at produktionen af kommerciel amylase i Thailands enzymindustrier vil være stigende og udbredt i alle regioner og til gengæld vil gavne landets økonomi på grund af selvforsyning med egne ressourcer til at producere amylaseenzym.
Slutning
Dette er den første rapport om identifikation af 13 amylaseproducerende bakterieisolater fra jord i Nasinuan Community Forest, Maha Sarakham. Alle bakterier blev identificeret som Bacillus spp. med undtagelse af en fra Enterobacter-slægten. Disse bakterier kan anvendes til amylaseproduktion og anvendes lokalt og nationalt inden for landbrug, fødevareforarbejdning og tekstilindustri i fremtiden. Dette vil således reducere omkostningerne ved import af industrielle enzymer fra andre lande, sikre bæredygtighed i den lokale enzymproduktion og forbedre landets økonomi.
Anerkendelser
Forfatterne vil gerne takke Mahasarakham University (Grant Year 2018) for finansiel støtte tildelt SD, og Faculty of Technology, Mahasarakham University (Grant Year 2017) tildelt VL.
Interessekonflikter
Forfatterne erklærer ingen interessekonflikter.
- Pandey A. Glucoamylaseforskning: En oversigt. 47:439-445 (1995).
- Burhan A.I., Nisa U., Gokhan C., Omer C., Ashabil A. og Osman G. Enzymatiske egenskaber af en ny termostabil, termofil, alkalisk og chelatorresistent amylase fra et alkalifilt Bacillus-isolat ANT-6. Process Biochem. 38: 1397-1403 (2003).
- Gurung N., Ray S., Bose S., og Rai, V.A. Broader view: Mikrobielle enzymer og deres relevans i industrier, medicin og andre områder. Biomed Res Internat. 1-18. doi:10.1155/2013/ 329121 (2013).
- Gupta R., Gigras P., Mohapatra H., Goswami V.K., og Chauhan B. Microbial α-amylases: a biotechnological perspective. Process Biochem. 38:1599-1616 (2003).
- Takasaki Y. En amylase, der producerer maltotetrose og fra maltopentose fra circulans. Agric Biol Chem. 47:2193-2199 (1983).
- Fogarty W.M., and Kelly C.T. Amylase, amyloglucosidase and related glucanases. Rose A.H. Economic Microbiology, Microbial Enzymes and Bioconversion, New York Academic Press Inc, vol. 5. Pp. 115-170 (1980).
- Wind R.D., Buitelaar R.M.G., Huizing H.J., and Dijkhuizen L. Karakterisering af et nyt Bacillus stearothermophilus-isolat: en meget termostabil α-amylaseproducerende stamme. Appl Microbiol Biotechnol. 41:155-162 (1994).
- Brumm P.J., Hebeda R.E. og Teague W.M. Purification & characterization of commercialized, cloned megaterium α-amylase. Del I: oprensning & hydrolytiske egenskaber. Stivelse. 43:319-323 (1991).
- Takasaki Y. En amylase, der producerer maltotriose fra subtilis. Agric Bio. Chem. 49:1091-1097 (1985).
- Lowry O.H., Rosebrough N.J. og Randall R.J. Proteinmåling med folinfenolreagenser. J Biol Chem. 193: 265-275 (1951).
- Altschul S.F., Gish W., Miller W., Myers E.W., og Lipman D.J. Basic local alignment search tool. J Mol 215:403-410 (1990).
- Bhaskara R.K.V., Ashwini K., Ashwini K., Gaurav K. og Karthik L. Optimering, produktion og delvis oprensning af ekstracellulær α-amylase fra Bacillus marini. Arc Appl Sci Res. 3:33-42 (2011).
- GhoseK. Måling af cellulaseaktiviteter. Pure Appl Chem. 59: 257-268 (1987).
- Haq U.I., Ashraf H., Iqbal J., og Qadeer M.A. Produktion af α-amylase af Bacillus licheniformis ved hjælp af et økonomisk medium. Biores Technol. 87:57-61 (2003).
- Mishra S. og Behera N. Amylaseaktivitet af stivelsesnedbrydende bakterier er isoleret fra jord, der modtager køkkenaffald. Afr J Biotechnol. 7: 3326-3331 (2008).
- Fossi B.T., Taveaand F., and Ndjonenkeu T. Production and Partial Characterization of a Themostable amylase from Ascomycetes yeast strain isolated from starchy soils. Afr J Biotechnol. 4:14-18 (2005).
- Cordeiro C.A.M. Production and propertiesof α-amylase from thermophilic Bacillus sp. Brazil J Microbiol. 33:57-61 (2002).
- Asad W. Ekstracellulær enzymproduktion af indfødte termofile bakterier: Delvis oprensning og karakterisering af α-amylase fra Bacillus sp. WA21. Pakistan J Botany. 43:1045-1052 (2011).
- Kim T.U. Oprensning og karakterisering af en maltotetraose-dannende alkalisk α-amylase fra en alkalofil Bacillus-stamme, GM8901. Appl Envin Microbiol. 61: 83105-3112 (1995).
- Sivaramakrishnan S., Gangadharan D., Madhavan K.N., and Pandey A. Fast dyrkning af Bacillus amyloliquefaciens til produktion af alfa-amylase. Food Technol 44:269-274 (2006).
- Abdel-Fattah Y.R., Soliman N.A., El-Toukhy N.M., El-Gendi H. og Ahmed R.S. Purification, and characterization of thermostable α-amylase produced by Bacillus licheniformis isolate AI20. J Chem. 2013:1-11 (2013).
- Thippeswamy S., Girigowda K., and Mulimani V.H. Isolation and identification of α-amylase producing Bacillus from Dhal
industry waste. Indian J Biochem Biophysics. 43: 295-298 (2006). - Abd-ElhalemT., El-Sawy M., Rawia F.G., og Khadiga A.A.T. Produktion af amylase fra Bacillus amyloliquefaciens under submerged fermentation ved hjælp af nogle agroindustrielle biprodukter. Ann Agri Sci. 60:193-202 (2015).
- Tamura K., and Nei M. Estimation of the number of nucleotide substitutions in the control region of mitochondrial DNA in humans and chimpanzees. Mol Biol Evol. 10:512-526 (1993).

(Besøgt 12.737 gange, 21 besøg i dag)