Læringsmål
- Sammenhænge elementernes elektronkonfigurationer med formen på det periodiske system.
- Bestem den forventede elektronkonfiguration for et grundstof ud fra dets placering i det periodiske system.
I kapitel 3 “Atomer, molekyler og ioner” introducerede vi det periodiske system som et værktøj til organisering af de kendte kemiske grundstoffer. Et periodisk system er vist i figur 8.11 “Det periodiske system”. Grundstofferne er opført efter atomnummer (antallet af protoner i kernen), og grundstoffer med lignende kemiske egenskaber er grupperet sammen i kolonner.
Figur 8.11 Det periodiske system
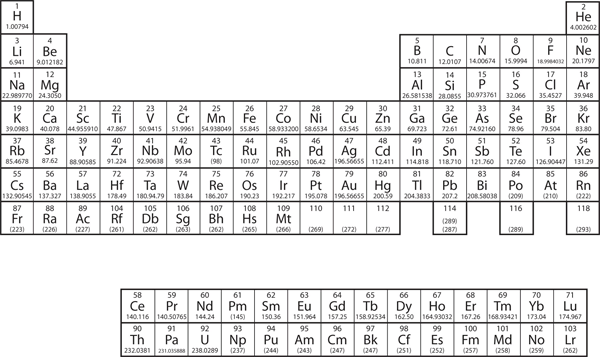
Hvorfor har det periodiske system den struktur, det har? Svaret er ret enkelt, hvis man forstår elektronkonfigurationer: Det periodiske systems form efterligner fyldningen af underskaller med elektroner.
Lad os starte med H og He. Deres elektronkonfigurationer er henholdsvis 1s1 og 1s2; med He er n = 1 skallen fyldt. Disse to grundstoffer udgør den første række i det periodiske system (se figur 8.12 “1’eren”).
Figur 8.12 1s-subskallen
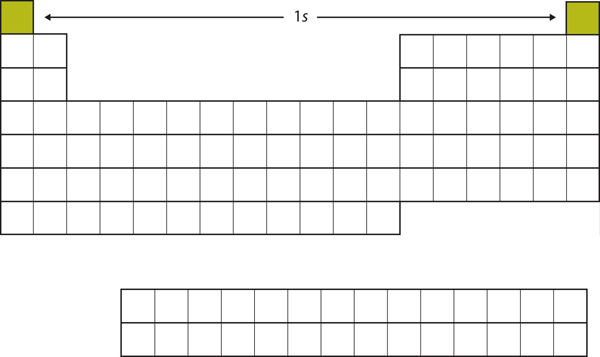
H og He repræsenterer fyldningen af 1s-subskallen.
De næste to elektroner, for Li og Be, ville gå ind i 2s-subskallen. Figur 8.13 “2’eren” viser, at disse to grundstoffer ligger ved siden af hinanden i det periodiske system.
Figur 8.13 2s-subskallen
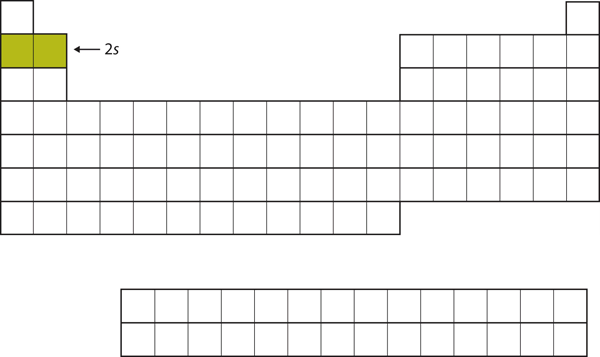
I Li og Be bliver 2s-subskallen fyldt.
For de næste seks grundstoffer bliver 2p-subskallen besat med elektroner. På højre side af det periodiske system er disse seks grundstoffer (B til Ne) grupperet sammen (figur 8.14 “2’eren”).
Figur 8.14 2p-underskallen
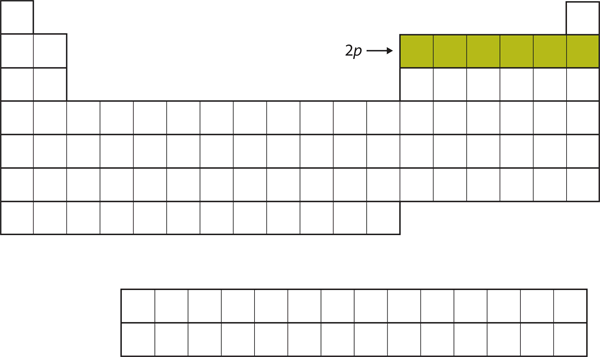
For B til Ne er 2p-underskallen besat.
Den næste underskal, der udfyldes, er 3sunderskallen. De grundstoffer, hvor denne underskal udfyldes, Na og Mg, er tilbage på venstre side af det periodiske system (figur 8.15 “De 3”).
Figur 8.15 3s-subskallen
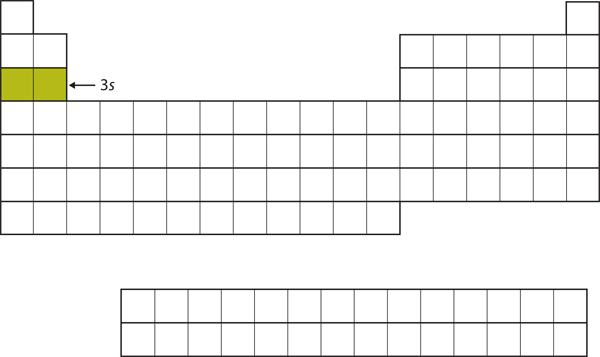
Nu er 3s-subskallen ved at blive besat.
Næste gang fyldes 3p-subskallen med de næste seks grundstoffer (figur 8.16 “Den 3”).
Figur 8.16 3p-underskallen
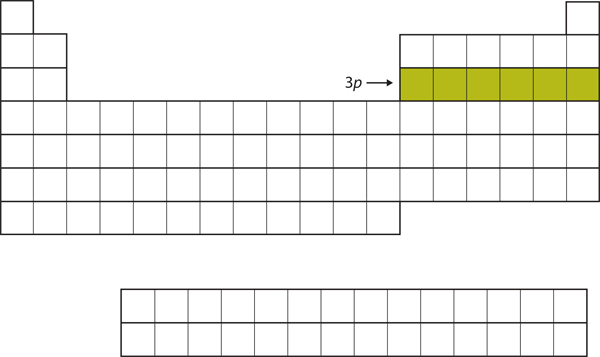
Næste gang fyldes 3p-underskallen med elektroner.
I stedet for at fylde 3d-underskallen næste gang, går elektronerne ind i 4sunderskallen (Figur 8.17 “4’eren”).
Figur 8.17 Den 4s underskal
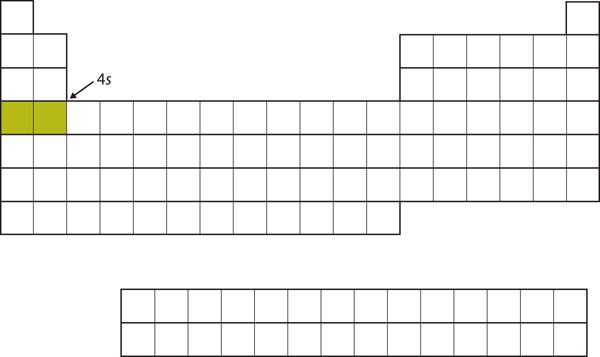
Den 4s underskal fyldes før 3d underskallen. Dette afspejles i strukturen i det periodiske system.
Når 4s underskallen er fyldt, er 3d underskallen fyldt med op til 10 elektroner. Dette forklarer afsnittet med 10 grundstoffer i midten af det periodiske system (figur 8.18 “De 3”).
Figur 8.18 3d-underskallen
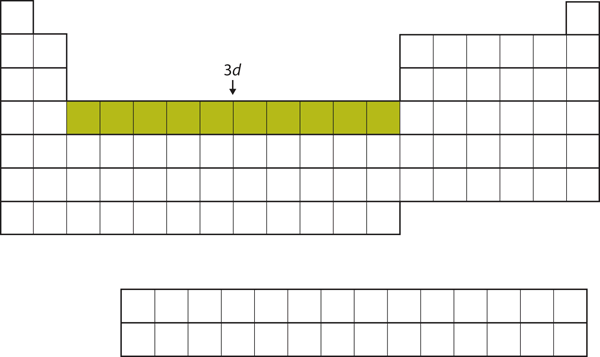
Den 3d-underskal er fyldt i den midterste del af det periodiske system.
Og så videre. Når vi går på tværs af rækkerne i det periodiske system, skitserer bordets overordnede form, hvordan elektronerne besætter skallerne og underskallerne.
De to første kolonner på venstre side af det periodiske system er der, hvor s-underskallerne bliver besat. På grund af dette betegnes de to første rækker i det periodiske system som s-blokken. På samme måde er p-blokken de seks kolonner længst til højre i det periodiske system, d-blokken er de 10 kolonner i midten af det periodiske system, mens f-blokken er den sektion med 14 kolonner, der normalt afbildes som løsrevet fra hoveddelen af det periodiske system. Den kunne godt være en del af hoveddelen, men så ville det periodiske system blive ret langt og besværligt. Figur 8.19 “Blokke i det periodiske system” viser blokkene i det periodiske system.
Figur 8.19 Blokke i det periodiske system
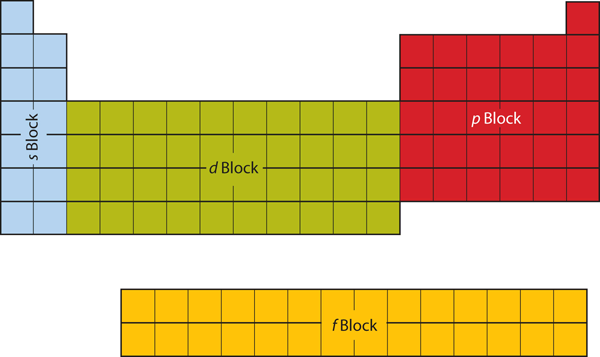
Det periodiske system er opdelt i blokke alt efter hvilken underskal, der udfyldes for de atomer, der hører til i den pågældende sektion.
Elektronerne i den højest nummererede skal plus eventuelle elektroner i den sidste uudfyldte underskal kaldes valenselektroner; den højest nummererede skal kaldes valensskallen. (De indre elektroner kaldes kerneelektroner.) Valenceelektronerne styrer i høj grad et atoms kemi. Hvis vi kun ser på valensskalens elektronkonfiguration, finder vi, at i hver kolonne er valensskalens elektronkonfiguration den samme. Tag f.eks. grundstofferne i den første kolonne i det periodiske system: H, Li, Na, K, Rb og Cs. Deres elektronkonfigurationer (forkortet for de større atomer) er som følger, hvor valensskalens elektronkonfiguration er fremhævet:
| H: | 1s1 |
| Li: | 1s22s1 |
| Na: | 3s1 |
| K: | 4s1 |
| Rb: | 5s1 |
| Cs: | 6s1 |
De har alle en lignende elektronkonfiguration i deres valensskaller: en enkelt s-elektron. Fordi en stor del af et grundstofs kemi påvirkes af valenselektroner, ville vi forvente, at disse grundstoffer ville have samme kemi – og det har de. Organiseringen af elektroner i atomer forklarer ikke kun formen på det periodiske system, men også det faktum, at grundstoffer i den samme kolonne i det periodiske system har samme kemi.
Det samme koncept gælder for de andre kolonner i det periodiske system. Elementer i hver kolonne har de samme elektronkonfigurationer i valensskallen, og elementerne har nogle lignende kemiske egenskaber. Dette gælder strengt taget for alle grundstoffer i s- og p-blokkene. I d- og f-blokkene er der undtagelser fra rækkefølgen for fyldning af delskaller med elektroner, og derfor er ens valensskaller ikke absolut ens i disse blokke. Der er dog mange ligheder i disse blokke, så der forventes en lighed i kemiske egenskaber.
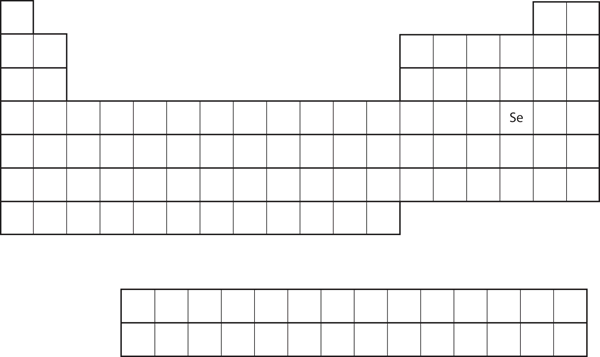
Lighed i valensskalens elektronkonfiguration indebærer, at vi kan bestemme et atoms elektronkonfiguration alene ud fra dets placering i det periodiske system. Betragt Se, som vist i figur 8.20 “Selen på det periodiske system”. Det befinder sig i fjerde kolonne i p-blokken. Det betyder, at dets elektronkonfiguration bør ende i en p4-elektronkonfiguration. Faktisk er elektronkonfigurationen for Se 4s23d104p4, som forventet.
Figur 8.20 Selen i det periodiske system
Eksempel 8
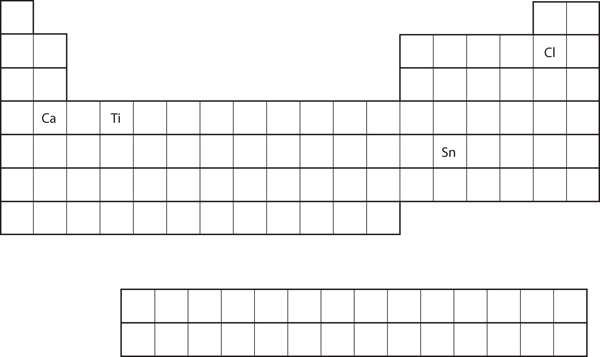
Forsestil valensskalens elektronkonfiguration for hvert atom ud fra grundstoffets placering i det periodiske system. Se figur 8.21 “Forskellige grundstoffer i det periodiske system”.
- Ca
- Sn
Løsning
- Ca er placeret i anden kolonne i s-blokken. Vi ville forvente, at dens elektronkonfiguration skulle ende med s2. Calciums elektronkonfiguration er 4s2.
Sn er placeret i anden kolonne i p-blokken, så vi forventer, at dets elektronkonfiguration ville ende med p2. Tins elektronkonfiguration er 5s24d105p2.
Test dig selv
På grundlag af grundstoffets placering i det periodiske system forudsiger du valensskalens elektronkonfiguration for hvert atom. Se figur 8.21 “Forskellige grundstoffer i det periodiske system”.
- Ti
- Cl
Svar
- 4s23d2
- 3s23p5
Figur 8.21 Forskellige grundstoffer i det periodiske system
Fødevarer og drikkevarer App: Kunstige farver
Farven på genstande kommer fra en anden mekanisme end farverne i neon- og andre udladningslamper. Selv om farvede lys producerer deres farver, er genstande farvede, fordi de fortrinsvis reflekterer en bestemt farve fra det hvide lys, der skinner på dem. En rød tomat er f.eks. knaldrød, fordi den reflekterer rødt lys, mens den absorberer alle de andre farver i regnbuen.
Mange fødevarer, som f.eks. tomater, er stærkt farvede; faktisk er den almindelige udtalelse “man spiser med øjnene først” en implicit anerkendelse af, at madens visuelle appel er lige så vigtig som dens smag. Men hvad med forarbejdede fødevarer?
Mange forarbejdede fødevarer har tilsat farvestoffer. Der findes to typer af farvestoffer: naturlige og kunstige. Naturlige farvestoffer omfatter karamelliseret sukker til brun farve, annatto, gurkemeje og safran til forskellige orange eller gule nuancer, betanin fra rødbeder til lilla og endda karmin, et dybrødt farvestof, der udvindes fra cochenille, et lille insekt, der er en parasit på kaktusser i Central- og Sydamerika. (Det er rigtigt: du spiser måske insektjuice!)
Disse farvestoffer er kunstige. I USA godkender Food and Drug Administration i øjeblikket kun syv forbindelser som kunstige farvestoffer i fødevarer, drikkevarer og kosmetik:
- FD&C Blue #1: Brilliant Blue FCF
- FD&C Green #3: Fast Green FCF
FD&C Blue #2: Indigotine
RD&C Red #3: Erythrosine FD&C Red #40: Allura Red AC FD&C Yellow #5: Tartrazin FD&C Gul #6: Sunset Yellow FCF
Farver med lavere numre er ikke længere på markedet eller er blevet fjernet af forskellige årsager. Typisk er disse kunstige farvestoffer store molekyler, der absorberer visse farver af lys meget kraftigt, hvilket gør dem nyttige selv i meget lave koncentrationer i fødevarer og kosmetik. Selv i så små mængder hævder nogle kritikere, at en lille del af befolkningen (især børn) er følsomme over for kunstige farvestoffer, og de opfordrer indtrængende til, at brugen af dem begrænses eller standses. Formelle undersøgelser af kunstige farvestoffer og deres virkninger på adfærd har imidlertid været ufyldestgørende eller modstridende. På trods heraf fortsætter de fleste mennesker med at nyde forarbejdede fødevarer med kunstige farvestoffer (som dem, der er vist i den medfølgende figur).

Kunstige farvestoffer findes i en række fødevarer, f.eks. forarbejdede fødevarer, slik og ægfarvestoffer. Selv foder til kæledyr indeholder kunstige fødevarefarvestoffer, selv om dyret sandsynligvis er ligeglad!
Kilde:
Nøglepunkter
- Elektronernes placering i atomerne er ansvarlig for det periodiske systems form.
Elektronkonfigurationer kan forudsiges ved hjælp af et atoms placering i det periodiske system.
Opgaver
-
Hvor i det periodiske system er d-underskaller besat af elektroner?
-
I hvilken blok findes Ra?
-
I hvilken blok findes Br?
Hvor på det periodiske system er s delskaller besat af elektroner?
Hvad er valensskalens elektronkonfigurationer for grundstofferne i den anden kolonne i det periodiske system?
Hvad er valensskalens elektronkonfigurationer for grundstofferne i den næstsidste kolonne i det periodiske system?
Hvad er valensskalens elektronkonfigurationer for grundstofferne i den første kolonne i p-blokken?
Hvad er valensskalens elektronkonfigurationer for grundstofferne i den sidste kolonne i p-blokken?
På grundlag af grundstoffets placering i det periodiske system forudsiger du elektronkonfigurationen for hvert atom.
a) Sr
b) S
10. Ud fra grundstoffets placering i det periodiske system forudsiger du elektronkonfigurationen for hvert atom.
a) Fe
b) Ba
11. Ud fra grundstoffets placering i det periodiske system forudsiger du elektronkonfigurationen for hvert atom.
a) V
b) Ar
12. Ud fra grundstoffets placering i det periodiske system forudsiger du elektronkonfigurationen for hvert atom.
a) Cl
b) K
13. Ud fra grundstoffets placering i det periodiske system forudsiger du elektronkonfigurationen for hvert atom.
a) Ge
b) C
14. Ud fra grundstoffets placering i det periodiske system forudsiger du elektronkonfigurationen for hvert atom.
a) Mg
b) I
Svar
de to første kolonner
den s-blok
ns27.
ns2np19.
a) 1s22s22p63s23p64s23d104p65s2
b) 1s22s22s22p63s23p411.
a) 1s22s22s22p63s63s23p64s23d3
b) 1s22s22p63s23p613.
a) 1s22s22p63s23p64s23d104p2
b) 1s22s22p2