- Baggrund og introduktion
- Fældepræsentation
- Diskussion
- Patofysiologi af ADI
- Litteratursøgning
- Orsager til ADI
- Klinisk præsentation af ADI
- Associerede komplikationer af ADI
- Håndtering af ADI
- Slutning
- Datatilgængelighed
- Ethisk erklæring
- Samtykke til deltagelse
- Author Contributions
- Funding
- Interessekonflikterklæring
- Akkreditering
Baggrund og introduktion
Hypothalamisk Adipsic Diabetes Insipidus (ADI), et sjældent syndrom med heterogen klinisk præsentation, er karakteriseret ved en samling af defekter i de homeostatiske mekanismer for vandbalance. Disse omfatter osmoregulering af tørstmekanismen, arginin vasopressin-sekretion og renal evne til at koncentrere urinen. Mindre end hundrede alvorlige tilfælde er blevet rapporteret på verdensplan i løbet af de sidste fire årtier (1).
Behandlingen af sådanne patienter er yderst udfordrende, da disse patienter har en tendens til at lide af store udsving i plasmanatrium, selv når DI er velkontrolleret (2).
Vi rapporterer et tilfælde af alvorlig ADI, som opstod postoperativt efter operation for cerebral arteriovenøs misdannelse (AVM). Vi beskriver den mulige patogenese i dette tilfælde og gennemgår litteraturen for alle lignende rapporterede tilfælde og beskriver de potentielle involverede mekanismer, den kliniske præsentation, den akutte såvel som kroniske behandling og prognosen.
Fældepræsentation
En 27-årig dame præsenterede sig med venstre frontal intracerebral blødning med intraventrikulær udvidelse sekundært til et stort basalgangliakompleks (AVM) med komplekse arterielle feeders fra venstre midterste cerebrale arterier (MCA), og forreste cerebrale arterier (ACA) med Spetzler Martin Grading Scale på 3 (3).
Efter indledende bedring efter dekompressiv kraniotomi og operation til evakuering af blodprop, gennemgik hun en elektiv AVM-ekskisionskirurgi ~2 uger senere. Under AVM-kirurgien rapporterede kirurgerne om en kraftig blødning fra feederkarrene (MCA, ACA og choroidalkarrene) med alvorlig intracerebral blødning og intraventrikulær blødning, der krævede massiv blodtransfusion på op til 32 enheder intraoperativt. Hun blev lagt i barbituratinduceret koma og induceret hypotension for at minimere cerebralt ødem (4).
Hun begyndte at have polyuri med store urinmængder intraoperativt kort efter episoden med den voldsomme intraoperative blødning. Selv om hendes natriumkoncentrationer præoperativt var normale, var natriumkoncentrationerne højere umiddelbart (inden for den 1. time) postoperativt inden for intervallet 151-160 mmol/L sammen med en lav urinosmolalitet <130 mosm/L. Transient DI blev overvejet, og hun blev startet på intravenøs desmopressin (IV desmopressin) 1 mcg, som blev givet dagligt sammen med 3,5-4 L halvstyrke saltvandsinfusion i 3 på hinanden følgende dage.
Derimod udviklede hun siden et lungeødem (sandsynligvis en konsekvens af massiv blodtransfusion intraoperativt, intravenøs hypotonisk væske og samtidig IV desmopressin) på postoperativ dag 4, IV desmopressin blev afbrudt, og frisk frosset plasma og diuretika (intravenøst furosemid 40 mg) blev administreret for at reducere det ekstravaskulære ødem. I den efterfølgende time begyndte hun at udvikle polyuri igen med en urinproduktion på 800 mL i en enkelt time, og hendes natriumkoncentrationer steg til 172 mmol/L. I betragtning af det samtidige postoperative cerebrale ødem blev det besluttet at sænke natriumkoncentrationerne målrettet, således at faldet i natrium ikke oversteg 5-10 mmol/L/dag, med et målniveau på 155 mmol/L. Der blev givet en lav dosis IV desmopressin 0,25 mcg, og der blev foreslået et titreringsregime med henblik på at opretholde en urinproduktion pr. time på mindre end 100 mL/h. Hun havde brug for IV 0,75 mcg desmopressin på den 5. postoperative dag og derefter IV 0,25 mcg to gange dagligt på den 6. dag, da hun nåede et målniveau på 155 mmol/L. Denne natriumkoncentration kunne opretholdes med desmopressindoseringen i yderligere 2 dage.
På dag 9 postoperativt blev desmopressin ophørt, da hun var i stand til at opretholde en lav urinproduktion uden desmopressin, og natriumkoncentrationerne var stabile. På dette tidspunkt blev det vurderet, at hun havde udviklet syndrom med uhensigtsmæssig antidiuretisk hormonsekretion (SIADH), og væskerne blev begrænset til 1 L/dag. Hendes natriumkoncentrationer forblev stabile på 134-138 mmol/L i løbet af denne uge.
På den postoperative dag 14 udviklede hun igen polyuri med stigende natriumkoncentrationer og serumosmolalitet. På dette tidspunkt blev IV desmopressin genoptaget med 0,25 mcg to gange dagligt. Natriumkoncentrationerne kunne holdes på 138-150 mmol/L med IV desmopressin (0,25 mcg to gange dagligt) og væske. Hun havde gennemgået en trifasisk fase med en periode med forbigående DI, efterfulgt af SIADH og efterfølgende permanent DI (se figur 1). Serumkortisol-, væksthormon-, insulinlignende vækstfaktor-1-, skjoldbruskkirtelfunktionen og prolaktinniveauerne var alle inden for normalområdet.

Figur 1. Graf, der viser alle seriemålinger hos vores patient under hele indlæggelsen.
Efter indsættelse af en ventrikuloperitoneal shunt (foretaget for at opretholde det intrakranielle tryk) 6 uger efter AVM-ekskisionen blev hun overført til rehabiliteringsafdelingen, og det intravenøse desmopressinregime blev konverteret til et subkutant (SC) regime (se figur 1). Da den nasogastriske sondeernæring blev afbrudt, forsøgte vi at regulere væskerne ved hjælp af tørst. Blodundersøgelser viste stigende natriumniveauer på op til 165 mmol/L, og hun følte ingen tørst i denne periode med hypernatraæmi på trods af en serumosmolalitet på 350 mosm/kg. Hun forblev adipisk på trods af, at afasien blev genoprettet. Der blev ikke anvendt en tørstskala, da hun på forespørgsel verbaliserede, at hun ikke følte nogen tørst overhovedet, og en tørstskala kunne ikke anvendes. Derfor måtte væskerne reguleres for at opretholde natriumbalancen. Hendes urinproduktion var fast og hendes natriumbalance velreguleret på et SC-regime med desmopressin 0,5 mcg om morgenen og 0,375 mcg om natten, med regulerede væsker på 1,5-2 L om dagen. Hun havde ingen tegn på termoreguleringsforstyrrelser. Der blev foretaget polyetheretherketon (PEEK)-kranioplastik ~ 4 måneder efter den oprindelige operation.
Efter 5 måneders intensiv tværfaglig rehabilitering havde hun stadig en ikke-funktionel dominant højre hånd og betydelige resterende kognitive underskud, og sikker dosering og selvadministration af subkutan desmopressin var ikke mulig på lang sigt.
Et forsøg med nasalt desmopressin og oralt desmopressin viste en betydelig variabel absorption, hvilket førte til større udsving i natriumkoncentrationerne. Herefter besluttede vi at anvende det sublinguale desmopressin, der fås som desmopressin Melt. Efter flere forsøg med forskellige doseringsregimer var vi i stand til at fastsætte urinproduktionen til ca. 2 L/dag ved hjælp af desmopressin Melt oral lyophilizat 120 mcg (2 tabletter) om morgenen og 60 mcg (1 tablet) om aftenen. Ved denne dosis havde hun imidlertid hyponatriæmi på visse tidspunkter af dagen. Vi foretog yderligere dosistitrering ved at skære desmopressin-tabletterne ved hjælp af en pincet/tang til at løfte tabletterne fra blisterpakken og skære tabletterne i nøjagtige kvartstykker (hver 15 mcg) ved hjælp af en pilleskærer. Med et regime på 90 mcg (1,5 tabletter) om morgenen og 75 mcg (1,25 tabletter) om aftenen lykkedes det os at opnå lignende resultater som med det subkutane regime. Med dette regime og et reguleret væskeindtag på 2 L/dag blev hendes natriumkoncentrationer holdt inden for intervallet 135-150 mmol/L uden større udsving eller kognitive symptomer. Denne dosering gjorde det også muligt for hende at have øget aktivitet i dagtimerne til genoptræning, og hun kunne sove godt uforstyrret af polyuri om natten.
Se figur 1 for de serielle natriummålinger hos denne patient i hele indlæggelsesperioden med de ovenfor beskrevne hændelser.
I betragtning af den kliniske historie og det faktum, at hendes hypofyse og hypothalamus for det meste er intakt, er det usandsynligt, at hun havde væsentlige defekter i baroreguleringen.
Diskussion
Patofysiologi af ADI
Under fysiologiske forhold holdes plasmanatrium, osmolalitet og vandbalance inden for snævre intervaller sekundært til et omhyggeligt samspil mellem tørst og vandindtag, neurohypofyseal vasopressinsekretion og antidiurese i de distale renale samlertubuli.
Perifere signaler (oropharyngeale, tarmens osmosensorer, blodets osmolalitet) indkoder oplysninger om den aktuelle hydreringstilstand i realtid, og disse er centralt integreret (5). En tilstand af dehydrering vil føre til stimulerende signaler til subfornical-organet (SFO), som hierarkisk sender signaler til organum-vasculosum of lamina terminalis (OVLT) og den mediane præoptiske kerne (MnPO) (6). MnPO, der kan fungere som en “central detektor”, sender stimulerende signaler til de hypothalamiske kerner for at øge frigivelsen af vasopressin og sender også et øget tørstsignal gennem SFO og OVLT (7, 8). De tørstrelaterede neurale baner, der forbinder SFO og OVLT med den cingulære og insulære cortex, resulterer i den bevidste opfattelse af tørst (7, 8). I en tilstand med tilstrækkelig hydrering fører signalerne fra de perifere sensorer derimod til en hæmning af disse områder og negativ feedback fra MnPO, hvilket fører til undertrykkelse af tørst og lavere vasopressinudskillelse og -frigivelse (rødt kredsløb). I realiteten er neuroner i MnPO, OVLT og SFO omfattende og gensidigt forbundne, da optogenetisk og kemogenetisk aktivering af neuroner i et af disse områder kan stimulere tørst (9). Derfor vil en afbrydelse af blodforsyningen, der resulterer i celleskader, føre til adipsi. Der er også blevet offentliggjort tilfælde af ADI som følge af autoimmunitet mod neuronale celler fra SFO og OVLT, hvilket indikerer den funktionelle betydning af disse neuronale sensorer i tørstkontrol (10).
AVP-neuronerne udviser “fasisk” aktivitet af aktionspotentialer med intervaller, hvor AVP frigives ved axonterminalerne. Frigivelsen af vasopressin reguleres af de osmosensoriske input fra MnPO, gennem baroreceptorer, og der er også en anticiperende regulering, hvor vasopressinfrigivelsen stimuleres før måltider (prandial), ved hypertermi og i et cirkadisk mønster (11). Der er et cirkadisk dagsmønster for sekretion af vasopressin i kredsløbet med en stigning i niveauerne mellem kl. 24.00 og 02.00, og niveauerne falder gradvist i løbet af dagen med et lavpunkt mellem kl. 16.00 og 20.00 (12). Denne cirkadiske midnatsforøgelse forårsaget af en øget vasopressinfrigivelse skyldes til dels øget synaptisk excitation af magnocellulære neurosekretoriske neuroner fra den suprachiasmatiske kerne, som er kendt for at regulere den cirkadiske rytme (11). Ved ADI er den osmosensoriske regulering af vasopressinsekretionen mest påvirket, og andre virkninger kan variere afhængigt af skadestedet og skadens omfang, mens baroreceptorresponset vides at være bevaret hos mange patienter med begrænset skade, som det er påvist i en undersøgelse (13).
AVP virker på de nyreopsamlende kanaler via vasopressin-2 (V2)-receptorer for at øge vandpermeabiliteten, hvilket fører til nedsat urindannelse. Reabsorptionen af vand kontrolleres gennem regulering af vandkanalen, aquaporin-2 (AQP2). AVP inducerer på kort sigt intracellulær translokation af AQP2-bærende vesikler til den apikale plasmamembran og regulerer således AQP2-trafikken. På lang sigt med tilstrækkelige AVP-koncentrationer regulerer det transkriptionen af AQP2-genet for at øge AQP2-proteinoverfladen i samleleddet (14). Ved ADI postulerer vi, at det er sandsynligt, at det akutte osmosensoriske respons er mere påvirket end det kroniske respons. Derfor vil der være en relativ overflod af aquaporin, men den akutte trafikering til den apikale membran vil blive påvirket.
Se figur 2 for detaljeret illustration af mekanismerne.
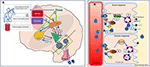
Figur 2. Skematisk fremstilling af væskebalanceregulering hos mennesker. (A) Styring og regulering af vasopressinsekretion i hjernen. (A) Perifere signaler (oropharyngeale, tarm osmosensorer, blod osmolalitet) koder information om den aktuelle hydreringstilstand i realtid (1) og centralt integreret (2). En dehydreringstilstand fører til stimulerende signaler til SFO’en, som hierarkisk sender signaler til OVLT og MnPO (3). MnPO, der kan fungere som en “central detektor”, sender stimulerende signaler til de hypothalamiske kerner for at øge frigivelsen af vasopressin (4) og sender også et øget tørstsignal gennem SFO og OVLT (5, blåt kredsløb i diagrammet). I en tilstand med tilstrækkelige hydreringssignaler fra de perifere sensorer sker der derimod en hæmning af disse områder og negativ feedback fra MnPO, hvilket fører til undertrykkelse af tørst og lavere vasopressinudskillelse og -frigivelse (rødt kredsløb 6). De tørstrelaterede neurale baner, der forbinder SFO og OVLT med den cingulære og insulære cortex, resulterer i den bevidste opfattelse af tørst (7). Ved adipsisk DI er de tilknyttede neurale kredsløb i mangel af osmosensoriske stimuli på grund af celleskader, stimulerende frigivelse eller hæmning af vasopressin og den bevidste opfattelse af tørst begge forstyrret. (B) Vasopressins virkningsmekanisme på de renale samlertubuli. (B) Vasopressin i blodcirkulationen lægger sig til vasopressinreceptor 2 på den luminale overflade af hovedcellerne i de distale samlerør i nyrerne (1). I den akutte fase danner det via syntese af cAMP fra ATP gennem AC (adenylatcyklase) proteinkinase A (2), som stimulerer translokationen af aquaporin fra lagringsvesiklen til den apikale membran og blodets luminale overflade (3). Dette resulterer i, at vand transporteres ind i cellen (4) og efterfølgende absorberes i kredsløbet (5). I den kroniske fase kan der via cAMP-medieret transkriptionskontrol af aquaporin-genet (6) findes øgede niveauer af aquaporin-vandkanalen i de vigtigste celler (7). I adipsisk DI er det akutte respons sandsynligvis mere påvirket end det kroniske respons, da den osmosensorisk relaterede vasopressinsekretion er påvirket.
Litteratursøgning
Vi foretog en systematisk litteratursøgning, herunder Pubmed, Scopus og Embase, for tilfælde rapporteret som en case report eller case series af ADI fra årene 1980 til 2018. Vi brugte søgeudtrykket: Adipsia, Adipsic disorder og Adipsic DI, og vi begrænsede søgningen til engelsk sprog og til mennesker. Vi søgte også i eventuelle andre referencer, der blev identificeret under læsningen af hver enkelt case report/caseserie. Vi fandt 25 referencer (10, 13, 15-39) med i alt 45 tilfælde rapporteret i litteraturen. Vi har opsummeret alle caserapporterne i tabel 1.
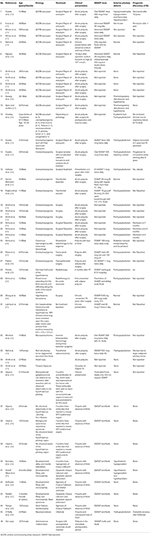
Tabel 1. Demografi, ætiologi, klinisk præsentation, behandling og prognose for patienter med adipsisk diabetes insipidus, der er rapporteret i litteraturen.
Orsager til ADI
Forty procent (17/46) af de tilfælde af ADI, der er beskrevet i litteraturen, opstod som følge af en aneurysmaruptur i den forreste kommunikerende arterie (ACOM) og postkirurgisk klipning ved hjælp af en frontal kraniektomi. I et tilfælde blev der beskrevet en dobbelt patologi af kraniopharyngiom og ACOM-aneurisme (15). Det er blevet beskrevet, at den arterielle forsyning af OVLT kommer fra fire kilder (40): (1) en superior median kilde, der forgrener sig fra den forreste kommunikerende arterie, (2) og (3) to laterale kilder, der kommer fra arterier, der forgrener sig fra hver forreste cerebralarterie under den forreste kommunikerende arterie, og (4) en inferior median kilde, der stiger op fra under det optiske chiasma. Det er karakteristisk, at de kapillærer, der beklæder dette organ, ligger uden for blod-hjernebarrieren, og derfor kan en ændring i osmolaliteten let opfattes af disse organer (41). Det skal bemærkes, at forbedringer i de kirurgiske teknikker og anvendelse af coiling i stedet for klipning kan reducere disse komplikationer. For patienter i god klinisk tilstand med rupturerede aneurismer i den forreste cirkulation, som er egnet til coiling, viser data fra en metaanalyse, at coiling er forbundet med et bedre resultat (42). Sammenlignet med klipning, hvor begge ender af ACA klippes med afbrydelse af blodforsyningen til hypothalamus, er proceduren med indsættelse af en spole i aneurysmet i stand til at bevare føderne til hypothalamus i de fleste tilfælde.
Den anden årsag til ADI er blevet beskrevet som suprasellært kraniopharyngiom (17/46). Disse tilfælde indebærer ofte en transfrontal excision, og der er i nogle tilfælde beskrevet helbredelse efter operationen. Et tilfælde af kavernøst hæmangiom med lignende manifestation efter blødningsepisode er også blevet beskrevet (26).
Hypothalamiske tumorer inklusive hamartom, pinealkirteltumor og kimcelletumor kan præsentere ADI (26, 29, 30). Et tilfælde af hepatocellulært karcinom med metastase til hypothalamus og deraf følgende ADI er blevet rapporteret (31).
Interessant nok er der kun beskrevet to tilfælde af hypofysetumorer med ADI (18, 32). Begge disse tilfælde havde en aggressiv tumor med flere transfrontale resektioner og intrakranielle blødninger intraoperativt. Der er også beskrevet et tilfælde hver i forbindelse med en hovedskade og tolueneksponering (13).
Fire tilfælde er beskrevet med pludselig akut præsentation af polyuri og hypernatriæmi. Disse patienter havde ingen strukturelle abnormiteter i hypothalamus, og detaljerede undersøgelser afslørede tegn på antistoffer mod OVLT-organerne. Disse tilfælde er blevet postuleret at have en underliggende autoimmun patologi (10, 33).
Anfødte eller tidlige barndomstilfælde hos patienter med udviklingsproblemer af corpus callosum er også blevet beskrevet med manifestation af ADI (34-38). Et tilfælde af neurosarcoidose med omfattende påvirkning af den forreste hypofyse, den bageste hypofyse og hypothalamus med ADI er også blevet beskrevet (39).
Klinisk præsentation af ADI
Den kliniske præsentation i de fleste af de beskrevne tilfælde er polyuri i den umiddelbare uge efter kirurgisk klipning for AVM eller efter kraniotomi. Den biokemiske præsentation er hypernatriæmi med øget serumosmolalitet ved tilstedeværelse af uhensigtsmæssigt fortyndet urin i store mængder. Hvis tørstfornemmelsen vurderes ved hjælp af en tørstskala, rapporterer disse ADI-patienter lav eller minimal tørst på trods af hypernatriæmi. Interessant nok har disse patienter et normalt respons på hypotension, og deres baroreceptormekanisme er intakt (13).
Vores patient gennemgik en trifasisk fase med initial DI, efterfulgt af SIADH og derefter permanent DI. Dette mønster, der beskrives som trifasisk respons, er blevet beskrevet efter hypofyse- og kraniopharyngiomoperationer. Patofysiologien i det trefaseformede respons synes at kunne forklares ved tidlig hypothalamisk dysfunktion (karakteriseret ved polyuri og hypernatriæmi), efterfølgende frigivelse af præformet vasopressin fra lagringsvesiklerne i hypofysens bageste del (ikke relateret til nogen stimulus) (karakteriseret ved SIADH) og endelig udtømning af vasopressinlagrene (permanent DI) (43). Hos vores patient er det sandsynligt, at i den tredje fase afmaskeres manglen på respons på osmolalitet i frigivelsen af vasopressin, efter at SIADH er forsvundet, snarere end en absolut depletion af vasopressin.
Associerede komplikationer af ADI
Få tilfælderapporter har beskrevet termoreguleringsforstyrrelser. Panhypopopituitarisme er kun blevet rapporteret i tilfælde af kraniopharyngiom og i tilfælde af hypofysetumorer og var ikke til stede hos vores patient.
Men selv om det ikke konsekvent er rapporteret, omfatter andre vigtige komplikationer af hypernatriæmi dyb venetrombose; derfor kan lavmolekylær heparin være indiceret under akut sygdom og immobilisering (18).
Hypothalamisk obesitet og søvnapnø er også blevet almindeligt rapporteret (18). I en case-serie (13), hvor man evaluerede AVP-responset på hypotension, fandt man, at patienterne med kraniopharyngiomer også havde et tab af det baro-regulerede AVP-respons. Disse patienter havde tegn på panhypopituitarisme, hvilket indikerer, at operationen af deres tumorer havde efterladt mere udbredte skader på hypofysen, herunder den bageste hypofyse, som er den sidste fælles vej for AVP-sekretion.
Håndtering af ADI
Håndteringen af disse tilfælde er blevet beskrevet (15, 18). Patient- og familieuddannelse om principperne for vandbalance og håndtering er afgørende. Vandindtaget kan fastsættes til 1,5-2 L dagligt og derefter foretages titrering af desmopressin. Daglig vægtmåling er nyttig for at opdage dehydrering eller væskeoverbelastning. Det anbefales at foretage ugentlige plasma-natriumkoncentrationer for at overvåge udsving. Trods streng overvågning er det vanskeligt at reproducere en døgnkontrol af plasmanatriumkoncentrationerne, der efterligner fysiologisk osmoregulering. I betragtning af risikoen for hurtige udsving i natriumkoncentrationerne og de symptomer på hyponatriæmi, der ses ved det lave referenceområde, er det tilrådeligt at holde natriumkoncentrationerne inden for det højere referenceområde.
Desmopressin, den syntetiske analog af AVP, blev først introduceret til behandling af DI i 1972 (44). De fleste patienter klarer sig godt med lave doser af desmopressin givet to gange dagligt. Der er en fin balance, og natriumniveauet kan svinge til meget lave niveauer ved minutiøse dosiseskaleringer.
Vores patient klarede sig meget godt på meget lave doser af parenterale administrationer, som er kendt for at have den laveste variabilitet i biotilgængelighed (45). Absorptionen af intranasale formuleringer er meget variabel, især hos børn eller voksne med kognitive problemer, da de måske ikke inhalerer opløsningen på en ensartet måde (46, 47). Orale formuleringer er en god mulighed, da en forøgelse af dosis vil føre til en længere virkningsvarighed, men har ingen maksimal effekt (48-50). Vi prøvede denne form i varierende doser på 50-100 mcg, men vi fandt betydelige dag-til-dag variationer i virkningerne med denne formulering. Sublingual desmopressin (Minirin Melt) har været tilgængelig siden 2005. Farmakologiske undersøgelser har vist, at sublingual rute resulterer i en højere biotilgængelighed på ~60 % sammenlignet med oral rute (49, 50). Forfinede doser af sublingual desmopressin kunne opnås ved at skære hver 60 mcg-tablet op, hvilket giver mulighed for dosisjusteringer på 65 til 90 mcg sublingualt. En lignende farmakokinetisk profil af sådanne opdelte tabletter er blevet beskrevet (51). Samtidig indtagelse af mad er kendt for at nedsætte absorptionshastigheden og -omfanget med 40 %, og det er derfor bedst at undgå enhver indtagelse af mad inden for en time før og efter indgivelse af sublinguale desmopressintabletter. For nylig er der beskrevet en detaljeret væskeadministrationsprotokol med daglig natriumovervågning med subkutan desmopressin i fast dosis (28), som viser, hvor vanskeligt det er at foretage daglig overvågning. I en anden nyere rapport (27) er der også rapporteret om anvendelse af den sublinguale desmopressinform til ADI i en dosis på 60 og 120 mcg dagligt. Anvendelse af sublingualt desmopressin kan være et nyttigt alternativ i tilfælde, hvor der ikke kan opnås optimale virkninger med andre formuleringer, og hvor disse patienter kræver nøje overvågning af daglig vægt, urinvolumen og væskeindtag døgnet rundt. I betragtning af de kognitive og hukommelsesmæssige defekter, som disse patienter har tendens til at have, har de normalt brug for en plejer til at overvåge væskeindtaget for at sikre, at de drikker den nødvendige mængde.
I vores gennemgang af tilfælde havde 6 patienter en remission af ADI, hvoraf 2 var relateret til ACOM aneurisme (15, 16) og 4 var relateret til kraniopharyngiom (15, 26). En patient med neurosarcoidose fik en remission med infliximabbehandling (39). Sådanne observationer kan tyde på, at både osmoreceptorer, der regulerer tørst, og deres efferente veje udviser større neuroplasticitet end dem, der regulerer AVP-produktionen (26).
Slutning
ADI er en yderst sjælden komplikation af hypothalamiske lidelser, som resulterer i et funktionstab i tørstcentret. På grund af den hierarkiske kontrol fra tørstcentret er fraværet af tørst også forbundet med tab af vasopressinregulering og polyuri. Personer, der lider af ADI, skal behandles forsigtigt med lave doser af desmopressin og væskebalance. Med den nuværende overvågning og personlige plejetilgange er det stadig ikke muligt at efterligne kvasifysiologisk osmoregulering døgnet rundt.
Datatilgængelighed
Alle datasæt genereret til denne undersøgelse er inkluderet i manuskriptet/supplementære filer.
Ethisk erklæring
Skriftligt informeret samtykke blev indhentet fra den/de enkelte person(er) til offentliggørelse af potentielt identificerbare billeder eller data inkluderet i denne artikel.
Samtykke til deltagelse
Vi har indhentet skriftlig tilladelse fra patientens nærmeste pårørende til at skrive og offentliggøre dette manuskript.
Author Contributions
RD var den primære endokrinolog, der håndterede patientens væskebalance, konceptualiserede ideen, skrev manuskriptet, lavede litteraturgennemgangen, indhentede dataene, skrev og gennemgik det endelige manuskript. HC, AC og JH var reservelæger, der var involveret i behandlingen af denne patient, og gennemgik det endelige manuskript. HT var den anæstesiolog, der var ansvarlig for denne patient i intensivfasen, konceptualiserede idéen og vurderede kritisk det endelige manuskript. KC var den ledende rehabiliteringsspecialist med ansvar for patienten, hun konceptualiserede idéen og kritisk vurderede det endelige manuskript. BB konceptualiserede ideen og evaluerede kritisk det endelige manuskript.
Funding
RD blev delvist støttet af Center Grant fra National Medical Research Council (NMRC/CG/017/2013) og National Medical Research Council Clinician Scientist Award (MOH-CSAINV17nov-0006).
Interessekonflikterklæring
Forfatterne erklærer, at forskningen blev udført uden kommercielle eller økonomiske relationer, der kunne opfattes som en potentiel interessekonflikt.
Akkreditering
Vi takker patienten og hendes forældre for at give os lov til at skrive og offentliggøre dette manuskript.
1. Eisenberg Y, Frohman LA. Adipsisk diabetes insipidus: en gennemgang. Endocr Pract. (2016) 22:76-83. doi: 10.4158/EP15940.RA
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Robertson GL. Abnormiteter i reguleringen af tørst. Kidney Int. (1984) 25:460-9. doi: 10.1038/ki.1984.39
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Spetzler RF, Martin NA. Et foreslået klassificeringssystem for arteriovenøse misdannelser. J Neurosurg. (1986) 65:476-83. doi: 10.3171/jns.1986.65.4.0476
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Ellens NR, Figueroa BE, Clark JC. Anvendelse af barbituratinduceret koma under cerebrovaskulære neurokirurgiske procedurer: en gennemgang af litteraturen. Brain Circ. (2015) 1:140-6. doi: 10.4103/2394-8108.172887
CrossRef Full Text | Google Scholar
5. Zimmerman CA, Huey EL, Ahn JS, Beutler LR, Tan CL, Kosar S, et al. Et tarm-til-hjerne signal af væske osmolaritet kontrollerer tørst mæthed. Natur. (2019) 568:98-102. doi: 10.1038/s41586-019-1066-x
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Augustine V, Gokce SK, Lee S, Wang B, Davidson TJ, Reimann F, et al. Hierarkisk neural arkitektur, der ligger til grund for tørstregulering. Natur. (2018) 555:204-9. doi: 10.1038/nature25488
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Bichet DG. Regulering af tørst og vasopressinfrigivelse. Annu Rev Physiol. (2019) 81:359-73. doi: 10.1146/annurev-physiol-020518-114556
PubMed Abstract | CrossRef Full Text | Google Scholar
8. McKinley MJ, Denton DA, Ryan PJ, Yao ST, Stefanidis A, Oldfield BJ. Fra sensoriske circumventrikulære organer til cerebral cortex: neurale veje, der kontrollerer tørst og sult. J Neuroendocrinol. (2019) 31:e12689. doi: 10.1111/jne.12689
PubMed Abstract | CrossRef Full Text | Google Scholar
9. McKinley MJ, Yao ST, Uschakov A, McAllen RM, Rundgren M, Martelli D. Den mediane præoptiske kerne: front og centrum for reguleringen af kropsvæske, natrium, temperatur, søvn og kardiovaskulær homøostase. Acta Physiol. (2015) 214:8-32. doi: 10.1111/apha.12487
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Hiyama TY, Matsuda S, Fujikawa A, Matsumoto M, Watanabe E, Kajiwara H, et al. Autoimmunitet mod natriumniveausensoren i hjernen forårsager essentiel hypernatriæmi. Neuron. (2010) 66:508-22. doi: 10.1016/j.neuron.2010.04.017
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Baylis PH, Thompson CJ. Osmoregulering af vasopressinsekretion og tørst i sundhed og sygdom. Clin Endocrinol. (1998) 29:549-76. doi: 10.1111/j.1365-2265.1988.tb03704.x
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Gizowski C, Bourque CW. Det neurale grundlag for homeostatisk og foregribende tørst. Nat Rev Nephrol. (2018) 14:11-25. doi: 10.1038/nrneph.2017.149
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Smith D, McKenna K, Moore K, Tormey W, Finucane J, Phillips J, et al. Baroregulering af vasopressinfrigivelse i adipsisk diabetes insipidus. J Clin Endocrinol Metab. (2002) 87:4564-8. doi: 10.1210/jc.2002-020090
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Jung HJ, Kwon TH. Molekylære mekanismer, der regulerer aquaporin-2 i nyrernes opsamlingskanaler. Am J Physiol Renal Physiol. (2016) 311:F1318-28. doi: 10.1152/ajprenal.00485.2016
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Cuesta M, Gupta S, Salehmohamed R, Dineen R, Hannon MJ, Tormey W, et al. Heterogene mønstre for genopretning af tørst hos voksne patienter med adipsisk diabetes insipidus. QJM. (2016) 109:303-8. doi: 10.1093/qjmed/hcv175
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Imai E, Kaneko S, Tsukamoto Y. Renal kompensatorisk tilpasning til vandhåndtering hos en patient med adipsisk diabetes insipidus efter klipning af et ruptureret aneurisme i den forreste kommunikerende arterie. Clin Nephrol. (2017) 88:112-6. doi: 10.5414/CN108963
PubMed Abstract | CrossRef Full Text | Google Scholar
17. McIver B, Connacher A, Whittle I, Baylis P, Thompson C. Adipsisk hypothalamisk diabetes insipidus efter klipning af anterior communicating artery aneurysm. BMJ. (1991) 303:1465-7. doi: 10.1136/bmj.303.6815.1465
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Ball SG, Vaidya B, Bayliss PH. Hypothalamisk adipsisk syndrom: diagnose og behandling. Clin Endocrinol. (1997) 47:405-9. doi: 10.1046/j.1365-2265.1997.2591079.x
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Nguyen BN, Yablon SA, Chen CY. Hypodipsisk hypernatriæmi og diabetes insipidus efter klipning af aneurisme i anterior kommunikerende arterie: diagnostiske og terapeutiske udfordringer hos den amnestiske rehabiliteringspatient. Brain Injury. (2001) 15:975-80. doi: 10.1080/02699050110063459
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Nussey SS, Ang VT, Ang VT, Jenkins JS. Kronisk hypernatriæmi og hypotermi efter subaraknoidalblødning. Postgrad Med J. (1986) 62:467-741. doi: 10.1136/pgmj.62.728.467
CrossRef Full Text | Google Scholar
21. Spiro SG, Jenkins JS. Adipsi og hypotermi efter subarachnoidalblødning. BMJ. (1971) 3:411-2. doi: 10.1136/bmj.3.5771.411
CrossRef Full Text | Google Scholar
22. Crowley RK, Sherlock M, Agha D, Smith D, Smith D, Thompson CJ. Klinisk indsigt i adipsisk diabetes insipidus: en stor sagserie. Clin Endocrinol. (2007) 66:475-82. doi: 10.1111/j.1365-2265.2007.02754.x
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Colleran K, Sanchez-Goettler L, Sloan A. Hypothalamisk fedme kompliceret af adipsisk central diabetes insipidus efter kirurgisk resektion af et kraniopharyngiom. J Clin Hypertens. (2009) 11:608-10. doi: 10.1111/j.1751-7176.2009.00057.x
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Zantut-Wittmann D, Garmes HM, Panzan AD, Lima Mde O, Baptista MT. Alvorlig rhabdomyolyse på grund af adipsisk hypernatriæmi efter kraniopharyngiomoperation. Arq Bras Endocrinol Metabol. (2007) 51:7. doi: 10.1590/S0004-27302007000700000023
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Raghunathan V, Dhaliwal MS, Gupta A, Jevalikar G. From cerebral salt wasting to diabetes insipidus with adipsia: case report of a child with craniopharyngioma. J Pediatr Endocrinol Metab. (2015) 28:323-6. doi: 10.1515/jpem-2014-0224
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Sinha A, Ball S, Jenkins A, Hale J, Cheetham T. Objektiv vurdering af tørstgenoprettelse hos patienter med adipsisk diabetes insipidus. Hypofyse. (2011) 14:307-11. doi: 10.1007/s11102-011-0294-3
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Pérez MA, Millán HA, Naranjo JA, Flórez Romero A. Adipsisk diabetes insipidus sekundært til kraniopharyngiomresektion. BMJ Case Rep. (2019) 12:e225903. doi: 10.1136/bcr-2018-225903
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Pabich S, Flynn M, Pelley E. Daglig natriumovervågning og væskeindtagsprotokol: forebyggelse af tilbagevendende hospitalsindlæggelse ved adipsisk diabetes insipidus. J Endoc Soc. (2019) 3:882-6. doi: 10.1210/js.2018-00406
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Pereira MC, Vieira MM, Pereira JS, Salgado D. Adipsi hos en diabetes insipidus-patient. Case Rep Oncol. (2015) 8:385-8. doi: 10.1159/000440611
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Zhang Y, Wang D, Feng Y, Zhang W, Zeng X. Juvenil gigt og adipsisk diabetes insipidus: en case report og litteraturgennemgang. J Int Med Res. (2018) 46:4829-36. doi: 10.1177/030006060518800114
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Latcha S, Lubetzky M, Weinstein AM. Alvorlig hyperosmolaritet og hypernatriæmi hos en adipsisk ung kvinde. Clin Nephrol. (2011) 76:407-11. doi: 10.5414/CN106617
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Sherlock M, Agha A, Crowley R, Smith D, Thompson CJ. Adipsisk diabetes insipidus efter hypofyseoperation for et makroprolaktinom. Pituitary. (2006) 9:59-64. doi: 10.1007/s11102-006-8280-x
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Hiyama TY, Utsunomiya AN, Matsumoto M, Fujikawa A, Lin CH, Hara K, et al. Adipsic hypernatremia without hypothalamic lesions accompanied by autoantibodies to subfornical organ. Brain Pathol. (2017) 27:323-31. doi: 10.1111/bpa.12409
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Komatsu H, Miyake H, Kakita S, Ikuta H. Hypoplasi af corpus callosum associeret med adipsisk hypernatriæmi og hypothalamisk hypogonadotropinisme: en caserapport og gennemgang af litteraturen. Pediatr Int. (2001) 43:683-7. doi: 10.1046/j.1442-200X.2001.01453.x
PubMed Abstract | CrossRef Full Text | Google Scholar
35. Schaff-Blass E, Robertson GL, Rosenfield RL. Kronisk hypernatriæmi som følge af en medfødt defekt i osmoregulering af tørst og vasopressin. J Pediatr. (1983) 102:703-8. doi: 10.1016/S0022-3476(83)80237-6
PubMed Abstract | CrossRef Full Text | Google Scholar
36. AvRuskin TW, Tang SC, Juan C. Essentiel hypernatriæmi, antidiuretisk hormon og neurohypofysinsekretion: respons på chlorpropamid. Acta Endocrinol. (1981) 96:145-53. doi: 10.1530/acta.0.0960145
CrossRef Full Text | Google Scholar
37. Radetti G, Rizza F, Rizza F, Mengarda G, Pittschieler K. Adipsisk hypernatriæmi hos to søstre. Am J Dis Child. (1991) 145:321-5. doi: 10.1001/archpedi.1991.02160030091028
PubMed Abstract | CrossRef Full Text | Google Scholar
38. Takeya T, Hamano K, Iwasaki N, Kitazawa R, Tsuji C, Jougamoto M. Et tilfælde af kronisk hypernatriæmi med agenese af corpus callosum. Nippon Shounikagagakkai Zasshi. (1996) 100:1392-5.
Google Scholar
39. O’Reilly MW, Sexton DJ, Dennedy MC, Counihan TJ, Finucane FM, O’Brien T, et al. Radiologisk remission og genoprettelse af tørstforståelse efter infliximabbehandling i adipsisk diabetes insipidus sekundært til neurosarcoidose. QJM. (2015) 108:657-9. doi: 10.1093/qjmed/hct023
PubMed Abstract | CrossRef Full Text | Google Scholar
40. Duvernoy H, Koritké JG, Monnier G. . Zeitschrift für Zellforschung und mikroskopische Anatomie. (1969) 102:49-77. doi: 10.1007/BF00336416
PubMed Abstract | CrossRef Full Text | Google Scholar
41. Duvernoy HM, Risold PY. De circumventrikulære organer: et atlas over sammenlignende anatomi og vaskularisering. Brain Res Rev. (2007) 56:119-47. doi: 10.1016/j.brainresrev.2007.06.002
PubMed Abstract | CrossRef Full Text | Google Scholar
42. Lindgren A, Vergouwen MD, van der Schaaf I, Algra A, Wermer M, Clarke MJ, et al. Endovaskulær coiling versus neurokirurgisk klipning for personer med aneurysmal subarachnoidal blødning. Cochrane Database Syst Rev. (2018) 8:CD003085. doi: 10.1002/14651858.CD003085.pub3
PubMed Abstract | CrossRef Full Text | Google Scholar
43. Ewout JH, Robert Z. Vandbalanceforstyrrelser efter neurokirurgi: det trefaseformede svar genovervejet. NDT Plus. (2010) 3:42-4. doi: 10.1093/ndtplus/sfp117
CrossRef Full Text | Google Scholar
44. Andersson KE, Arner B. Effekter af DDAVP, en syntetisk analog af vasopressin, hos patienter med kraniel diabetes insipidus. Acta Med Scand. (1972) 192:21-7. doi: 10.1111/j.0954-6820.1972.tb04772.x
PubMed Abstract | CrossRef Full Text | Google Scholar
45. Rembratt A, Graugaard-Jensen C, Senderovitz T, Norgaard JP, Djurhuus JC. Farmakokinetik og farmakodynamik af desmopressin administreret oralt versus intravenøst i dagtimerne versus nattimerne hos raske mænd i alderen 55-70 år. Eur J Clin Pharmacol. (2004) 60:397-402. doi: 10.1007/s00228-004-0781-9
PubMed Abstract | CrossRef Full Text | Google Scholar
46. Vande Walle J, Stockner M, Raes A, Nørgaard JP. Desmopressin 30 år i klinisk brug: en sikkerhedsgennemgang. Curr Drug Saf. (2007) 2:232-8. doi: 10.2174/15757488607781668891
PubMed Abstract | CrossRef Full Text | Google Scholar
47. Yutaka O, Robertson GL, Nørgaard JP, Nørgaard JP, Juul KV. Behandling af neurohypofyseal diabetes insipidus. J Clin Endocrinol Metabol. (2013) 98:3958-67. doi: 10.1210/jc.2013-2326
CrossRef Full Text | Google Scholar
48. Fjellestad-Paulsen A, Höglund P, Lundin S, Paulsen O. Farmakokinetik af 1-deamino-8-D-argininin vasopressin efter forskellige administrationsveje hos raske frivillige personer. Clin Endocrinol. (1993) 38:177-82. doi: 10.1111/j.1365-2265.1993.tb00990.x
CrossRef Full Text | Google Scholar
49. Lam KS, Wat MS, Choi KL, Ip TP, Pang RW, Kumana CR. Farmakokinetik, farmakodynamik, langtidseffekt og sikkerhed af oral 1-deamino-8-D-arginin vasopressin hos voksne patienter med central diabetes insipidus. Br J Clin Pharmacol. (1996) 42:379-85. doi: 10.1046/j.1365-2125.1996.39914.x
PubMed Abstract | CrossRef Full Text | Google Scholar
50. Steiner IM, Kaehler ST, Sauermann R, Rinosl H, Muller M, Joukhadar C. Plasmafarmakokinetik af desmopressin efter sublingual administration: en eksplorativ dosis-eskaleringsundersøgelse hos raske mandlige frivillige. Int J Clin Pharmacol Ther. (2006) 44:172-9. doi: 10.5414/CPP44172
PubMed Abstract | CrossRef Full Text | Google Scholar
51. De Waele K, Cools M, De Guchtenaere A, Van de Walle J, Raes A, Van Aken S, et al. Desmopressin lyophilisat til behandling af central diabetes insipidus: første erfaring hos meget små spædbørn. Int J Endocrinol Metab. (2014) 12:e16120. doi: 10.5812/ijem.16120
PubMed Abstract | CrossRef Full Text | Google Scholar