Når brint er kovalent bundet til et meget elektronegativt atom, såsom fluor, klor, oxygen eller nitrogen, har H-atomet en delvis positiv ladning, skrevet Hδ+.
Hδ+ er fysisk meget lille, så ladningstætheden på det er usædvanlig høj.
Forestil dig, at et andet negativt eller elektronegativt atom, f.eks. på et andet molekyle, nærmer sig Hδ+;der vil være gensidig tiltrækning, hvilket resulterer i en særlig stærk dipol-dipol tiltrækning.Denne tiltrækning kaldes en hydrogenbinding.
Generelt er hydrogenbindinger svagere end ioniske og kovalente bindinger, men er stærkere end van der Waals-kræfter.

Hydrogenbindinger i vand
Det mest kendte eksempel på hydrogenbindinger er vand:
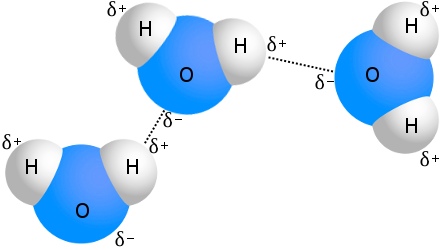
Hvert vandmolekyle kan være hydrogenbundet til op til fire andre vandmolekyler.I vand ved stuetemperatur er det gennemsnitlige antal hydrogenbindinger pr. vandmolekyle 3,6,
Den tilfældige termiske bevægelse af molekyler sikrer, at levetiden for en individuel hydrogenbinding i vand er kort, i gennemsnit kun 10 picosekunder.Tiden til at danne en ny binding er imidlertid endnu kortere.
Det kræver 21 kJ mol-1 at bryde en enkelt hydrogenbinding i vand permanent, hvilket er et betydeligt energitilskud.Resultatet er, at vands smelte- og kogepunkt er meget højere, end man ville forvente for et molekyle med så lav molekylvægt.
Skønt vand vs. metan: Vandmolekyler tiltrækkes ret kraftigt til hinanden ved hjælp af hydrogenbindinger, mens van der Waals-kræfter hersker i metan. så selv om deres molekylære masse er ens, nemlig 18 for vand og 16 for metan, er deres fysiske egenskaber meget forskellige.For eksempel smelter vand ved 0,00 °C og koger ved 99,98 °C; metan smelter ved -182,5 °C og koger ved -161,5 °C.
Hydrogenbinding i vand vs. svovlbrinte
Svovl er i gruppe 16 i det periodiske system, det samme som oxygen. Svovl er tungere end ilt, såH2S burde have højere smelte- og kogepunkt end H2O.Det er dog ikke tilfældet, fordi svovl er mindre elektronegativt end ilt, og derfor er hydrogenbindingen i H2S svag.

Mol. Masse: 16
Smelt Pt.: 0,00 °C
Boil Pt.: 99,98 °C
Elektronegativitet for O (Pauling): 3,44
Hydrogenbindingsenthalpi: 21 kJ mol-1

Mol. Mass: 34
Smeltningspt.: -82 °C
Kogningspt.: -60 °C
Elektronegativitet for S (Pauling): 2.58
Hydrogenbindingsenthalpi: ≅ 3 kJ mol-1
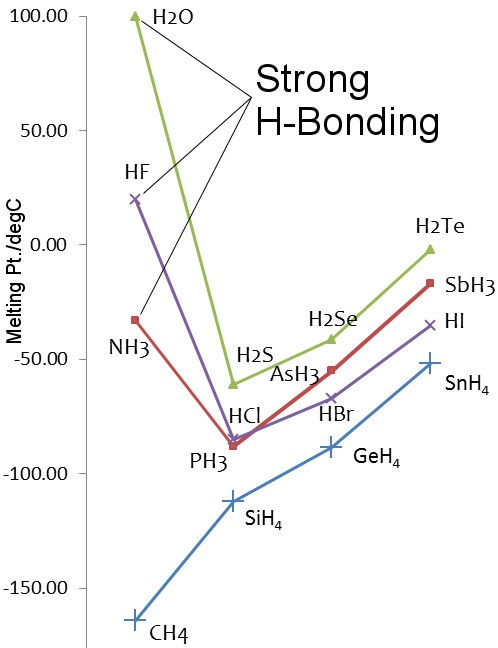
Hydrogenbinding i ammoniak og hydrogenfluorid
Fluor og nitrogen er de mest elektronegative grundstoffer i deres grupper i det periodiske system, og hydrogenbinding er observeret i hydrogenfluorid og ammoniak.
Som for vand er hydrogenfluorid og ammoniaks smelte- og kogepunkt højere end hydriderne af tungere grundstoffer i deres grupper.
Smeltepunkter for hydriderne af grundstofferne i gruppe 14-17
Hydrogenbinding i DNA
DNA’s basepar forbinder dets to helixkæder. baseparrene bærer DNA’s genetiske information.
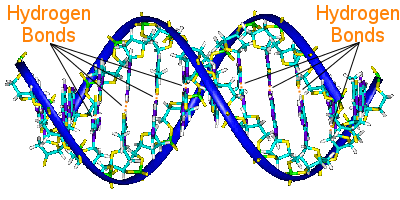
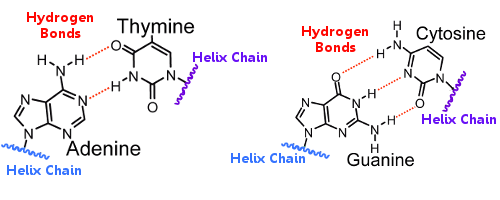
Baseparrene på den ene helix er forbundet med baseparrene på den anden helix ved hjælp af hydrogenbindinger. hydrogenbindinger holder således helixerne sammen og skaber den berømte dobbelthelix.
Når DNA replikeres, brydes hydrogenbindingerne, så de to helixer kan skilles. på denne måde spiller hydrogenbindinger en væsentlig rolle i basepar-låsnings- og nøgle-mekanismen i DNA-replikationen.
Hydrogenbindinger i uld
Lige andre proteinfibre er uld udstyret med hydrogenbindinger. billedet nedenfor viser, hvordan hydrogenbindinger (orange prikker) forbinder spolerne i ulds α-helix-kæde (grøn).
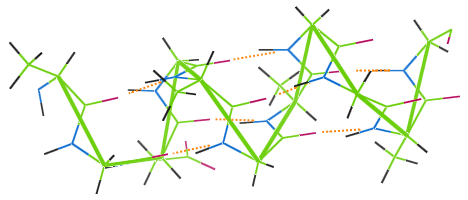
Hvis et uldtøj vaskes ved høj temperatur, ødelægges brintbindingerne, spolerne mister deres elasticitet, og tøjet bliver fejlslagent.
