Indledning
ß amyloid og fosforylerede tau-proteiner er patologiske kendetegn ved Alzheimers sygdom (AD), som ophobes og spredes på forudsigelig vis gennem distribuerede neurale netværk, hvilket forårsager progressive metaboliske abnormiteter, neuronal skade og celledød. Neuroafbildning gør det muligt at foretage en detaljeret vurdering af disse patologiske ændringer hos patienter, der gennemgår en undersøgelse for kognitiv svækkelse. Tidligere var det kun muligt at stille en endelig diagnose af Alzheimers sygdom ved post mortem-observation og neuroanatomisk inddeling af disse proteinaggregater. De seneste fremskridt inden for molekylær billeddannelse gør det imidlertid muligt at visualisere amyloid- og tau-aflejringer i levende menneskehjerner og har bragt os tættere på en in vivo endelig diagnose af AD.
Strukturel billeddannelse
Retningslinjerne fra American Academy of Neurology (AAN) for diagnostisk udredning af personer med kognitive klager1 anbefaler strukturel billeddannelse af hjernen med ikke-kontrast CT eller MRI hos alle personer med en positiv klinisk historie og objektive kognitive ændringer. I denne sammenhæng er den primære rolle for hjerneafbildning at udelukke ikke-degenerative strukturelle læsioner, hvoraf 5 % måske ikke fremgår af klinisk historie eller fysisk undersøgelse2 og som potentielt kan behandles. AAN anbefaler også, at vaskulær demens (VaD), demens med Lewy bodies (DLB) og frontotemporal demens (FTD) udelukkes klinisk. Strukturel billeddannelse kan forbedre den diagnostiske sikkerhed og ændrer den kliniske diagnose i 19 % til 28 % samt håndteringen af 15 % af de kliniske tilfælde.2
De billeddannelsesmodaliteter, der er det foretrukne valg ved vurdering af strukturel atrofi, er CT og MRT. Sygdomsspecifikke atrofi-mønstre er blevet grundigt beskrevet og valideret ved hjælp af disse modaliteter. Selv om atrofi kan observeres på CT, resulterer den iboende lavere rumlige opløsning og den ringere grå/hvide stof-kontrast i tab af potentielt nyttige subtile observationer vedrørende neurodegenerative forandringer. Derfor er klinikere ofte afhængige af MRI til at vurdere mønsteret og sværhedsgraden af strukturelle ændringer, til at udelukke ikke-neurodegenerative årsager til kognitiv svækkelse og til at vurdere sværhedsgraden og omfanget af ændringer i den hvide substans, som diskuteret mere detaljeret nedenfor.
De tidligste neurodegenerative ændringer i AD forekommer i de mediale temporallapper – hippocampus, entorhinal cortex og parahippocampal gyrus. Efterhånden som atrofi indtræder, udvides choroidspalten og det temporale horn i den laterale ventrikel; disse ændringer vurderes bedst i det koronale plan. En almindeligt anvendt visuel vurderingsskala baseret på disse strukturer – den mediale temporale atrofi-skala (MTA-skala) (figur 1) – er blevet klinisk3 og neuropatologisk4 valideret. Forskellige undersøgelser, der anvender denne skala eller de strukturer, den vurderer, har vist en betydelig evne til at skelne personer med AD fra aldersmatchede kontroller4 eller personer med DLB4 eller vaskulær kognitiv svækkelse (VCI).5 Medial temporal atrofi er også prædiktiv for konvertering fra amnestisk mild kognitiv svækkelse (MCI) til Alzheimers demens.3
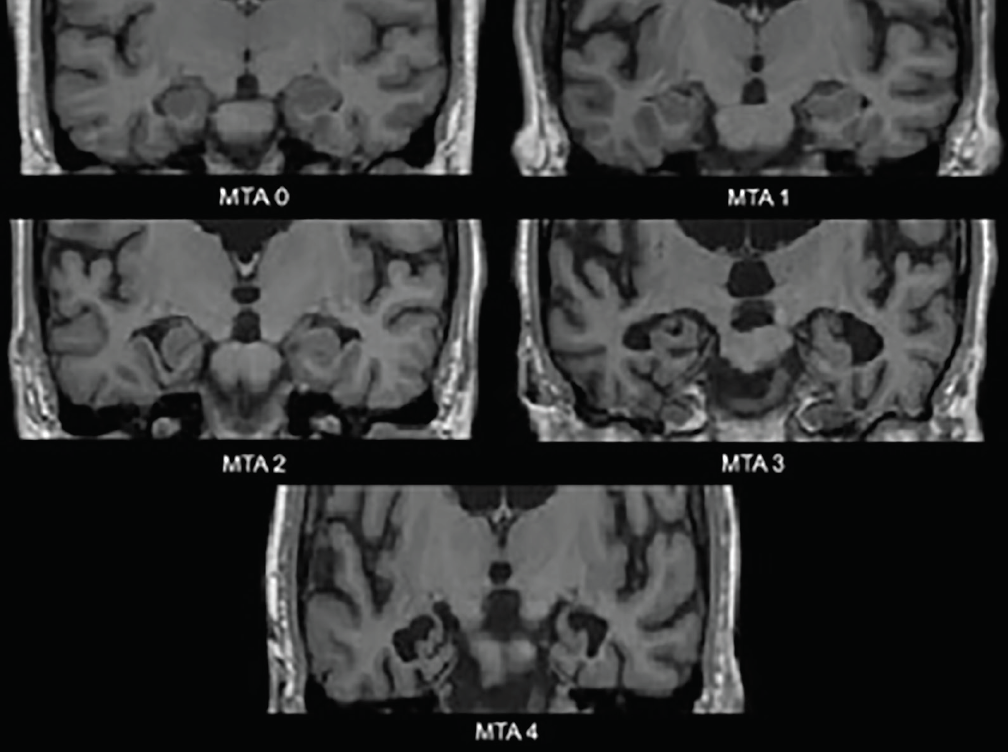
Klik for at se større
Figur 1. Vurderinger på skalaen for medial temporal atrofi (MTA). MTA 0-ingen til minimal åbning af aksusspalten; MTA 1-subtil udvidelse af aksusspalten; MTA 2-videre udvidelse af aksusspalten, som går over i det temporale horn af den laterale ventrikel, let fald i højden af hippocampusformationen; MTA 3-moderat fald i højden af hippocampusformationen, markant udvidelse af lateralventriklens temporalhorn; MTA 4-svært fald i højden af hippocampusformationen, markant udvidelse af lateralventriklens temporalhorn.
Demenssyndromer udviser typisk kanoniske atrofi-mønstre6 , der svarer til kognitive og adfærdsmæssige symptomer; de involverede strukturer kan dog overlappe hinanden. F.eks. viser AD og DLB begge involvering af den mediale temporallap, men flere billeddannende og neuropatologiske undersøgelser har vist, at DLB i forhold til AD har betydeligt mindre forkærlighed for mediale temporale strukturer4,5 (Figur 2).
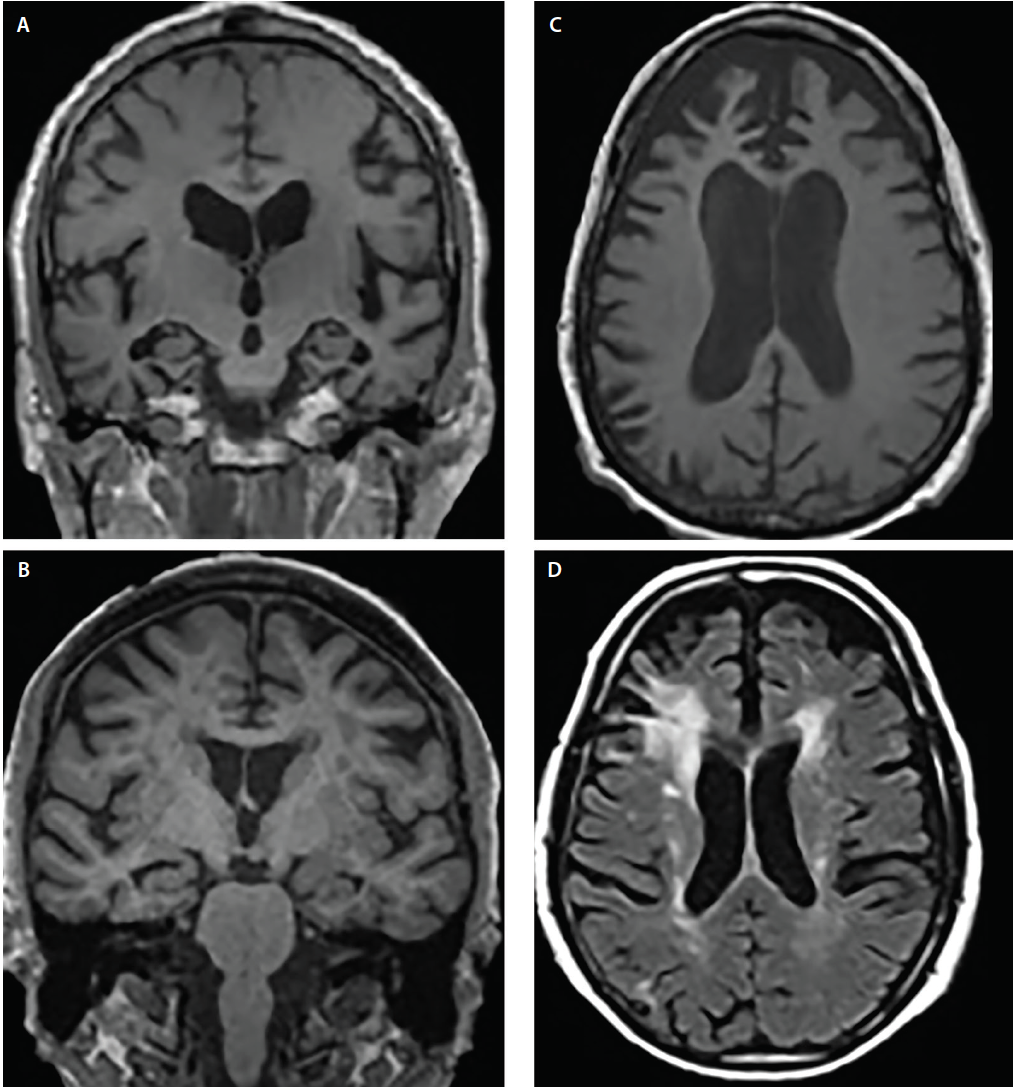
Klik for at se større
Figur 2. Strukturelle atrofi-mønstre på tværs af Alzheimers sygdom (AD) (A), demens med Lewy-kroppe (DLB) (B), frontotemporal demens (FTD) (C) og vaskulær demens (VaD) (D). Koronal T1-vægtet MRI viser generaliseret kortikal atrofi, men forskellige grader af hippocampal atrofi i AD (A) og DLB (B). Axial T1-vægtet MRI viser bvFTD-atrofi med en fokal forkærlighed for den mediale og laterale præfrontale cortex (C). Axial T2-vægtet MRI påviser konfluent periventrikulær kappe og halo hvid substanshypointensiviteter (WMH’er), der omfatter corona radiata og strækker sig ind i den laterale præfrontale neocortex, milde spredte WMH’er og WMH’er i den subependymale ventrikulære foring og septum pellucidum i VaD (D).
Både AD og frontotemporal lobær degeneration (FTLD) har overlappende regioner med atrofi, herunder områder af præfrontale, orbitofrontale og forreste insulære cortex samt de forreste og mediale temporallapper.6 I forhold til hinanden viser AD imidlertid signifikant mere atrofi i de laterale parietale og occipitale cortexe, mens FTLD viser mere atrofi i frontallapperne (figur 2).6
Det er vigtigt systematisk at vurdere alle hjerneområder og bemærke regioner med både strukturel atrofi og anatomisk skånsomhed for at gøre størst mulig brug af diagnostisk billeddannelse. En stor multicenterundersøgelse vurderede for nylig 6 visuelle vurderingsskalaers evne til korrekt at klassificere 186 patologisk bekræftede tilfælde af AD, DLB og FTLD.6 Denne undersøgelse viste, at en samtidig vurdering af flere sygdomsspecifikke regioner gav en betydelig bedre diskrimination end at fokusere på et enkelt område.4
Vaskulær skade er en vigtig overvejelse ved vurdering af personer med kognitiv svækkelse. Iskæmiske forandringer er almindelige i normal aldring og fremskyndes af almindelige komorbiditeter (f.eks. hypertension, diabetes og hyperkolesterolæmi). Vaskulære bidrag til kognitiv svækkelse konkluderes ofte, når der på T2-vægtede eller FLAIR-sekvenser (Fluid Attenuated Inversion Recovery) påvises betydelige hvide substanshyperintensiteter (WMH), kortikale slagtilfælde eller strategisk placerede lakuner. Lakunære slagtilfælde i de basale ganglier og WMH i centrum semiovale og corona radiata er indikatorer for kronisk iskæmisk skade i små kar (figur 2). I modsætning hertil er periventrikulære hætter ofte af ikke-iskæmisk oprindelse og afspejler subependymal gliose.7 Der findes flere WMH-sværhedsskalaer (f.eks. Fazekas-skalaen)7 , som kan anvendes i kliniske sammenhænge. Sådanne scoringsalgoritmer er alle enige om, at udbredt konfluent WMH og subkortikale lacunære infarkter i det mindste delvist sandsynligvis er medvirkende faktorer til kognitiv tilbagegang.7
Diffusionstensorafbildning (DTI) er en ny MRI-sekvens, der er følsom over for vanddiffusion gennem væv, som vurderer integriteten af hvid substans, fordi axonernes arkitektur begrænser vandstrømmen. Gennemsnitlig diffusivitet og fraktionel anisotropi målinger anvendes ofte til at karakterisere neurodegenerative ændringer på DTI. Førstnævnte måler størrelsen af diffusionen, og sidstnævnte måler, om vandet flyder fortrinsvis i en enkelt retning, som det forventes i sunde axoner. Der er konsekvent blevet rapporteret om nedsat gennemsnitlig diffusivitet og nedsat fraktionel anisotropi i både MCI- og demenspopulationer med AD.8 Flere undersøgelser har også identificeret DTI-forandringer hos asymptomatiske personer, der er i risiko for at udvikle AD9 , hvilket tyder på, at disse ændringer forekommer tidligt i sygdomsforløbet. Ud over at vurdere integriteten af det hvide stof kan DTI anvendes til at modellere grov strukturel konnektivitet mellem kortikale regioner ved hjælp af algoritmer til tractografi. Dette har vundet indpas inden for AD, da der er tegn på, at amyloid- og tau-patologi kan sprede sig via hjerneforbindelser.10 Selv om DTI viser potentiale som et mål for integritet af hvid substans, begrænser dens følsomhed over for bevægelse og andre tekniske begrænsninger i det mindste foreløbig dens kliniske anvendelse.
Functional Imaging
Hjernehypometabolisme observeres let i neurodegenerative sygdomme og kan bidrage til differentialdiagnostik. Neuronernes funktion er afhængig af ilt og glukose fra blodet, og leveringen heraf fremmes af regional vasodilation. 18F-fluorodeoxyglucose positronemissionstomografi (FDG-PET) afspejler indirekte graden af kortikal aktivitet og kan let anvendes til at visualisere neurodegenerative ændringer ved at udnytte denne metaboliske afhængighed af glucose.
Den karakteristiske hypometaboliske kortikale signatur for AD består af tidlige ændringer i den bageste cingulat (PCC); precuneus; temporale, parietale og, i senere stadier, frontale cortexe. Dette mønster manifesterer sig tidligt, selv præ-symptomatisk,11 og er klinisk nyttigt til at skelne AD fra FTD.12 I modsætning til AD afslører den metaboliske signatur af FTD frontal, anterior temporal, basal gangliar og thalamisk hypometabolisme med relativ skånelse af de posteriore associationscortex.13 I klinisk usikre situationer kan klinikere bruge disse metaboliske signaturer til at skelne AD fra FTD.12 På samme måde kan DLB’s neokortikale metaboliske signatur have forvirrende overlapning med AD’s, men DLB-tilfælde kan også vise occipital hypometabolisme.14
Center for Medicare & Medicaid Services anser kun FDG-PET for “rimelig og nødvendig” for dem, der opfylder kriterierne for både AD og FTD, hos hvem fuld diagnostisk udredning i henhold til AAN-retningslinjerne1 ikke endeligt har fastslået en ætiologi.15
Funktionel MRI (fMRI) kan også måle hjerneaktivitet ved hjælp af sekvenser, der er følsomme over for tidsmæssige ændringer i iltet/deoxygeneret hæmoglobin som følge af hjerneaktivitet. På denne måde er fMRI beslægtet med FDG-PET, fordi ændringerne i hæmoglobin er drevet af glukosemetabolismen, der er nødvendig for hjerneaktivitet. Temporale afhængigheder mellem regioner kan bruges til at udlede funktionel konnektivitet (dvs. hvilke regioner der kommunikerer aktivt). Sammenlignet med FDG-PET giver fMRI en bedre rumlig opløsning, hvilket giver mulighed for en mere præcis kortlægning af konnektivitet. En anden fordel ved fMRI er, at den kan optages under udførelse af en opgave eller i hvile. Førstnævnte identificerer konnektivitetsmønstre, der er drevet af specifikke aktive tilstande, mens sidstnævnte identificerer konnektivitetsmønstre, der er til stede i hvile, og som er kendt som standardtilstandsnetværket (DMN). DMN er defineret af funktionelle knudepunkter, PCC og precuneus, som er forbundet med et dorsalt medielt undersystem og et medielt temporalt undersystem.16 Amyloidaflejring menes at begynde i de funktionelle knudepunkter i DMN. DMN vides at være påvirket i AD.16 I modsætning hertil er DMN skånet i FTD, mens salience- eller opmærksomhedsnetværk er påvirket.17 I øjeblikket er fMRI-teknologien begrænset til forskningsanvendelser, men mulighederne for at udvikle relevante klinisk anvendelige algoritmer udforskes aktivt.
Molekylær billeddannelse
Kriteriestandarden for en endelig diagnose af AD er postmortem neuropatologisk hjerneundersøgelse. Selv i hænderne på erfarne demenseksperter når den kliniske diagnose af AD kun op på en foruroligende sensitivitet på 70,9 % til 87,3 % og en specificitet på 44,3 % til 70,8 %.18 Det mest relevante for en forbedret klinisk diagnostisk nøjagtighed af AD har været udviklingen af radiomærkede PET-billeddannende sporstoffer med specifik affinitet for AD-relaterede ß-amyloid- og fosforylerede tau-aggregater (figur 3), som gør det muligt at påvise den underliggende neuropatologi in vivo (tabel), hvilket tidligere kun var muligt post mortem.
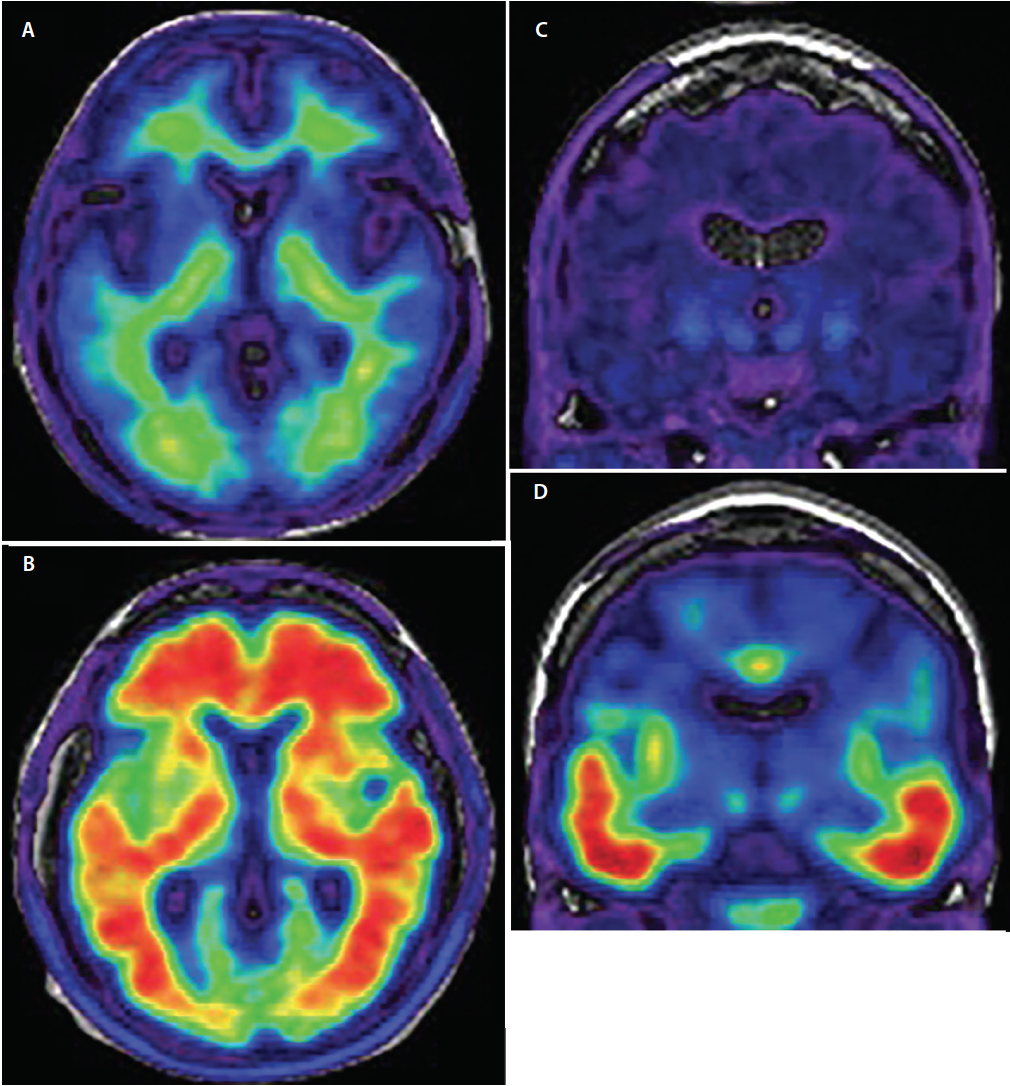
Klik for større visning
Figur 3. Axial amyloid-PET, der viser amyloid-negative (A) og amyloid-positive scanninger (B). I amyloid-negative billeder (A) viser radiotracer-signalet lav intensitet og er begrænset til uspecifik binding af den hvide substans. Overgangen mellem grå/hvid substans er bevaret. I amyloidpositive billeder (B) er radiotracer-signalet af høj intensitet og strækker sig diffust ind i kortikale grå substansregioner og skjuler grå/hvid substans-grænsen. Koronal tau-PET, der viser tau-negative (C) og tau-positive (D) scanninger. I tau-negative scanninger er der et minimalt, uspecifikt radiotracer-signal af lav intensitet i de mediale temporale, basale forhjerner og basale ganglieregioner. I tau-positive scanninger (D) er radiotracer-signalet af højere intensitet og involverer den nedre og laterale temporale cortex, der følger den kendte progression af neurofibrillære tangles.
Amyloid Positron Emission Tomography
Amyloid, og for nylig tau-billeddannelse har revolutioneret vores evne til at visualisere AD-patologi selv i præsymptomatiske stadier.19 Amyloid PET-billeddannende sporstoffer er gyldige og pålidelige til påvisning in vivo af AD-patologi på forskellige stadier af sygdommen. Disse billeddannende sporstoffer binder specifikke konformationsmotiver af amyloidproteinet og resulterer i en sporstofoptagelse, der er tæt korreleret med postmortal amyloidaflejring.20
Sammenlignet med tau begynder amyloidpatologi i et mere diffust distribueret regionalt mønster, der spreder sig fra de basale dele af de frontale, temporale og occipitale lober til de dorsale neokortikale associeringsområder med kun sen involvering af de primære sensoriske og motoriske cortexe.21 De mest bemærkelsesværdige områder med sporstofoptagelse er frontale, parietale og laterale temporale cortexer (figur 3), hvor optagelsen er 1,5 til 2 gange større hos personer med AD end hos kontrolgrupper22 eller personer med andre demenssygdomme.23
Amyloid PET-billeder vurderes for kortikal sporstofoptagelse i karakteristiske områder af AD-amyloidfordelingen. Positive scanninger viser tab af skelnen mellem grå/hvid substans, efterhånden som optagelsen af sporstoffet strækker sig ind i neocortex. Negative scanninger bevarer sondringen mellem grå/hvid substans og viser kun off-target-binding i den hvide substans.24 Amyloid PET-billeddannelsesmønstre kan pålideligt forudsige kognitiv tilbagegang hos både raske personer og personer med MCI.20
18F-florbetapir, 18F-florbetaben og 18F-flutemetamol er godkendt af Food and Drug Administration (FDA) til klinisk brug.20 Forsikringsselskaberne har imidlertid ikke taget teknologien til sig på grund af udgifter og risiko for klinisk overanvendelse i mangel af sygdomsmodificerende behandlinger og etablerede omkostningsfordele. En metaanalyse rapporterede om 95 % sensitivitet og 57 % specificitet for en positiv amyloid PET-scanning med hensyn til at forudsige konvertering fra MCI til AD.25
Det usikre forhold mellem omkostninger, risiko og fordele har ført til udvikling af kriterier for hensigtsmæssig anvendelse af amyloid-billeddannelse, der tilskriver personer med uforklarlig MCI, atypiske AD-præsentationer og demens i begyndelsen af sygdomsforløbet behovet for amyloid PET-evaluering.26 Eksperter har også identificeret uhensigtsmæssige indikationer for amyloid-billeddannelse, som omfatter en selvstændig evaluering af kognitive problemer forud for en grundig klinisk, kognitiv, laboratorie- og strukturel neuroimaging-undersøgelse, i mangel af objektiv kognitiv svækkelse, ved høj sandsynlighed for AD (dvs. i mangel af klinisk ekvilibrisme) og til stadieinddeling af demenssygdommens sværhedsgrad.
Dementia-evidence for amyloid scanning (IDEAS) undersøgelsen – en igangværende undersøgelse fra Center for Medicare and Medicaid Services – er i øjeblikket ved at validere kriterierne for hensigtsmæssig anvendelse og evaluere virkningen af PET-bestemt amyloidstatus på sygdomsbehandling og langtidsresultater for Medicare-modtagere med MCI eller atypiske præsentationer. En foreløbig analyse viste, at integrering af amyloid-PET i den kliniske undersøgelse resulterede i ændringer i sygdomsstyringen hos 60,2 % af personer med MCI og 63,5 % af dem med demens.27 De langsigtede resultater er stadig ved at blive fastlagt.
Tau Positron Emission Tomography
Tau er det andet protein, der aflejres i hjernen hos personer med Alzheimers sygdom. Tau PET-billeddannende sporstoffer er i øjeblikket under udvikling og viser allerede lovende resultater. I lighed med amyloid-PET er Tau-PET-tracere rettet mod bestemte konformationsmotiver af fosforyleret tau. Specificiteten af tau-tracere er blevet valideret postmortalt28 , og det observerede tau-PET-signal svarer nøje til den anatomiske fordeling af neurofibrillære tangles, der i øjeblikket anvendes til neuropatologisk diagnosticering af AD.29 De tidligste stadier af tau-patologi, der kan visualiseres med tau-PET-billeddannelse, er de neurofibrillære tangle-aflejringer i entorhinal cortex og hippocampus. Derefter kan tau-aflejringer påvises i den inferior og laterale temporale (figur 3), efterfulgt af den parietale og occipitale og endelig den frontale cortex efter den veletablerede Braak og Braak-patologiske inddeling af tau-aflejringer i hjernen.21 Tau-tracere er ikke uden diagnostiske begrænsninger og er under yderligere udvikling for bedre at kunne definere deres kliniske rolle. Men da tau-tracerbindingen ændrer sig dynamisk gennem hele det kliniske forløb af AD, vil denne billeddannelsesmodalitet sandsynligvis spille en vigtig rolle i inddelingen af sygdommens sværhedsgrad in vivo.30
Fremtidige retninger
I betragtning af at AD-patologi let kan påvises op til 20 år før demensdiagnosen19 og følger en forudsigelig trinvis fordeling, fokuserer forskningen nu på tidlig præsymptomatisk påvisning og forbedring af diagnostisk nøjagtighed ved hjælp af biomarkører (tabel).31 En foreslået forskningsramme for amyloid-tau-neurodegeneration (ATN) med fokus på påvisning af 3 biomarkørændringer i hjernen forudsiger den kliniske relevans af multimodal billeddannelse.31 ATN-klassifikationssystemet er agnostisk over for kliniske syndromer og indfanger hele spektret af neurodegenerative sygdomme gennem en AD-biomarkørlinse. Efter yderligere udvikling og forfining forventes ATN gennem objektiv in vivo biomarkørkategorisering at forbedre den kliniske diagnostiske nøjagtighed dramatisk og forbedre kvaliteten af behandlingen.
Slutning
Neuroimaging tilbyder unikke oplysninger om den underliggende ætiologi af kognitiv svækkelse og letter vejledning for patienter og familier gennem en frygtelig og usikker oplevelse. Alle neurodegenerative sygdomme udviser betydelig klinisk heterogenitet, og før de seneste fremskridt inden for molekylær billeddannelse kunne ingen af dem diagnosticeres endeligt før døden. Den moderne billeddannende hjerneteknologi er i stand til at påvise mange epifænomener, der afspejler den underliggende neuropatologi, hvoraf nogle er ret nærliggende i forhold til kilden til sygdommen. Den mest sikre kliniske diagnose er i øjeblikket baseret på en integration af klinisk historie, lægens observationer, fysisk undersøgelse, medicinsk behandling, neuropsykologisk testning og informeret fortolkning af diagnostisk neuroimaging. Efterhånden som ATN-biomarkørerne forfines yderligere, vil kliniske diagnoser kunne stilles tidligere og mere definitivt hos levende patienter, være mindre afhængige af symptomklassificering og give mulighed for tidligere behandlingsinterventioner, der kan ændre forløbet af neurodegenerative sygdomme.
1. Knopman DS, DeKosky ST, Cummings JL, et al. Praksisparameter: diagnose af demens (en evidensbaseret gennemgang). Rapport fra underudvalget for kvalitetsstandarder fra det amerikanske akademi for neurologi. Neurology. 2001;56(9):1143-1153.
2. Chui H, Zhang Q. Evaluation of dementia: a systematic study of the usefulness of the American Academy of Neurology’s practice parameters. Neurology. 1997;49(4):925-935.
3. Apostolova LG, Thompson PM, Green AE, et al. 3D-sammenligning af lav, mellemliggende og avanceret hippocampal atrofi i MCI. Hum Brain Mapp. 2010;31(5):786-797.
4. Harper L, Fumagalli GG, Barkhof F, et al. MRI visual rating scales in the diagnosis of dementia: evaluation in 184 post-mortem confirmed cases. Brain. 2016;139(Pt 4):1211-1225.
5. Burton EJ, Barber R, Mukaetova-Ladinska EB, et al. Medial temporallappens atrofi på MRT differentierer Alzheimers sygdom fra demens med Lewy bodies og vaskulær kognitiv svækkelse: en prospektiv undersøgelse med patologisk verifikation af diagnosen. Brain. 2009;132(Pt 1):195-203.
6. Harper L, Bouwman F, Burton EJ, et al. Mønstre af atrofi i patologisk bekræftede demenssygdomme: en voxelvis analyse. J Neurol Neurosurg Psychiatry. 2017;88(11):908-916.
7. Fazekas F, Kleinert R, Offenbacher H, et al. Patologiske korrelater af tilfældige MRI-signalhyperintensiviteter i hvid substans ved hjælp af MRI. Neurology. 1993;43(9):1683-1689.
8. Huang J, Friedland RP, Auchus AP. Diffusionstensorafbildning af normalt udseende hvidt stof ved let kognitiv svækkelse og tidlig Alzheimers sygdom: foreløbige beviser for axonal degeneration i tindingelappen. AJNR Am J Neuroradiol. 2007;28(10):1943-1948.
9. Selnes P, Fjell AM, Gjerstad L, et al. Ændringer i billeddannelse af hvidt stof ved subjektiv og let kognitiv svækkelse. Alzheimers Dement. 2012;8(5 Suppl):S112-S121.
10. Jacobs HIL, Hedden T, Schultz AP, et al. Strukturelle traktændringer forudsiger nedstrøms tau-akkumulering hos amyloid-positive ældre personer. Nat Neurosci. 2018;21(3):424-431.
11. Apostolova LG, Thompson PM, Rogers SA, et al. Overfladeguidet kortlægning af cerebrale metaboliske ændringer hos kognitivt normale og let svækkede ældre mennesker. Mol Imaging Biol. 2010;12(2):218-224.
12. Foster NL, Heidebrink JL, Clark CM, et al. FDG-PET forbedrer nøjagtigheden ved skelnen mellem frontotemporal demens og Alzheimers sygdom. Brain. 2007;130(Pt 10):2616-2635.
13. Ishii K, Sakamoto S, Sasaki M, et al. Cerebral glukosemetabolisme hos patienter med frontotemporal demens. J Nucl Med. 1998;39(11):1875-1878.
14. Mosconi L, Tsui WH, Herholz K, et al. Multicenter standardiseret 18F-FDG PET-diagnose af let kognitiv svækkelse, Alzheimers sygdom og andre demenssygdomme. J Nucl Med. 2008;49(3):390-398.
15 . Centers for Medicare & Medicaid Serivces. Decision Memo for Positron Emission Tomography (FDG) and Other Neuroimaging Devices for Suspected Dementia (CAG-00088R)https://www.cms.gov/medicare-coverage-database/details/nca-decision-memo.aspx?NCAId=104. Tilgået den 4. maj 2019.
16. Buckner RL, Sepulcre J, Talukdar T, et al. Kortikale knudepunkter afsløret af intrinsisk funktionel konnektivitet: kortlægning, vurdering af stabilitet og relation til Alzheimers sygdom. J Neurosci. 2009;29(6):1860-1873.
17. Seeley WW, Crawford RK, Zhou J, Miller BL, Greicius MD. Neurodegenerative sygdomme er rettet mod store menneskelige hjernenetværk i stor skala. Neuron. 2009;62(1):42-52.
18. Beach TG, Monsell SE, Phillips LE, Kukull W. Accuracy of the clinical diagnosis of Alzheimer disease at National Institute on Aging Alzheimer Disease Centers, 2005-2010. J Neuropathol Exp Neurol. 2012;71(4):266-273.
19. Jagust W. Imaging the evolution and pathophysiology of Alzheimer disease. Nat Rev Neurosci. 2018;19(11):687-700.
20. Rice L, Bisdas S. Den diagnostiske værdi af FDG og amyloid PET i Alzheimers sygdom – en systematisk gennemgang. Eur J Radiol. 2017;94:16-24.
21. Braak H, Braak E. Neuropatologisk stadieinddeling af Alzheimer-relaterede forandringer. Acta Neuropathol. 1991;82(4):239-259.
22. Klunk WE, Engler H, Nordberg A, et al. Imaging brain amyloid in Alzheimer’s disease with Pittsburgh Compound-B. Ann Neurol. 2004;55(3):306-319.
23. Ossenkoppele R, Jansen WJ, Rabinovici GD, et al. Prævalens af amyloid PET-positivitet i demenssyndromer: en meta-analyse. JAMA. 2015;313(19):1939-1949.
24. Minoshima S, Drzezga AE, Barthel H, et al. SNMMI-procedure standard/EANM Practice Guideline for Amyloid PET Imaging of the Brain 1.0. J Nucl Med. 2016;57(8):1316-1322.
25. Ma Y, Zhang S, Li J, et al. Prædiktiv nøjagtighed af amyloid billeddannelse for progression fra mild kognitiv svækkelse til Alzheimers sygdom med forskellige længder af opfølgning: en metaanalyse. . Medicine (Baltimore). 2014;93(27):e150.
26. Johnson KA, Minoshima S, Bohnen NI, et al. Kriterier for hensigtsmæssig anvendelse af amyloid PET: en rapport fra Amyloid Imaging Task Force, Society of Nuclear Medicine and Molecular Imaging og Alzheimer’s Association. Alzheimers Dement. 2013;9(1):e1-e16.
27. Rabinovici GD, Gatsonis C, Apgar C, et al. Association of amyloid positronemissionstomography with subsequent change in clinical management among medicare beneficiaries with mild cognitive impairment or dementia. JAMA. 2019;321(13):1286-1294.
28. Aguero C, Dhaynaut M, Normandin MD, et al. Autoradiografisk validering af ny tau PET-tracer -MK-6240 på humant postmortalt hjernevæv. Acta Neuropathol Commun. 2019;7(1):37.
29. Chien DT, Bahri S, Bahri S, Szardenings AK, et al. Tidlige kliniske PET-billeddannelsesresultater med den nye PHF-tau-radioligand -T807. J Alzheimers Dis. 2013;34(2):457-468.
30. Wang L, Benzinger TL, Su Y, et al. Evaluering af tau-billeddannelse til stadieinddeling af Alzheimers sygdom og afsløring af interaktioner mellem beta-amyloid og tauopati. JAMA Neurol. 2016;73(9):1070-1077.
31. Jack CR, Jr., Bennett DA, Blennow K, et al. NIA-AA Research Framework: På vej mod en biologisk definition af Alzheimers sygdom. Alzheimers Dement. 2018;14(4):535-562.
MRA og DS rapporterer ingen offentliggørelser.
LGA har fungeret som rådgivende bestyrelsesmedlem for Eli Lilly.