Læringsmål
- Udvid tidligere introducerede ligevægtsbegreber til syrer og baser, der kan afgive eller acceptere mere end én proton
Vi kan også bruge de relative styrker af konjugerede syre-base-par til at forstå syre-base-egenskaberne i opløsninger af salte. En neutraliseringsreaktion kan defineres som en reaktion mellem en syre og en base, hvor der dannes et salt og vand. Det vil sige, at et andet kation, f.eks. \(Na^+\), erstatter protonerne på syren. Et eksempel er reaktionen af \(\ce{CH3CO2H}\), en svag syre, med \(\ce{NaOH}\), en stærk base:
\
Afhængigt af syre-base-egenskaberne for dets komponent-ioner kan et salt imidlertid opløses i vand for at producere en neutral opløsning, en basisk opløsning eller en sur opløsning.
Når et salt som f.eks. \(NaCl\) opløses i vand, danner det \(Na^+_{(aq)}\) og \(Cl^-_{(aq)}\) ioner. Ved hjælp af en Lewis-tilgang kan \(Na^+\)-ionen betragtes som en syre, fordi den er en elektronparacceptor, selv om dens lave ladning og relativt store radius gør den til en meget svag syre. \(Cl^-\\)-ionen er den konjugerede base til den stærke syre \(HCl\), så den har stort set ingen basisk karakter. Derfor har opløsning af \(NaCl\) i vand ingen virkning på en opløsnings \(pH\), og opløsningen forbliver neutral.
Nu skal vi sammenligne denne opførsel med opførslen af vandige opløsninger af kaliumcyanid og natriumacetat. Igen har kationerne (\(K^+\) og \(Na^+\)) stort set ingen sur karakter, men anionerne (\(CN^-\) og \(CH_3CO_2^-\)) er svage baser, der kan reagere med vand, fordi de er konjugerede baser til de svage syrer \(HCN\) henholdsvis \(HCN\) og eddikesyre.
Ingen af reaktionerne forløber meget langt mod højre som skrevet, fordi dannelsen af det svagere syre-basepar favoriseres. Både \(HCN\) og eddikesyre er stærkere syrer end vand, og hydroxid er en stærkere base end enten acetat eller cyanid, så i begge tilfælde ligger ligevægten til venstre. Ikke desto mindre danner hver af disse reaktioner nok hydroxidioner til at producere en basisk opløsning. F.eks. er \(pH\) for en 0,1 M opløsning af natriumacetat eller kaliumcyanid ved 25°C henholdsvis 8,8 eller 11,1. Af tabel E1 og E2 fremgår det, at \(CN^-\) er en stærkere base (\(pK_b = 4,79\)) end acetat (\(pK_b = 9,24\)), hvilket er i overensstemmelse med, at \(KCN\) giver en mere basisk opløsning end natriumacetat ved samme koncentration.
Derimod bør den konjugerede syre til en svag base være en svag syre. For eksempel er ammoniumchlorid og pyridiniumchlorid salte, der fremstilles ved at lade henholdsvis ammoniak og pyridin reagere med \(HCl\). Som du allerede ved, er chloridionen en så svag base, at den ikke reagerer med vand. Derimod er kationerne i de to salte svage syrer, der reagerer med vand på følgende måde:
Figur \(\PageIndex{2}\) viser, at \(H_3O^+\) er en stærkere syre end enten \(NH_4^+\) eller \(C_5H_5NH^+\), og omvendt er ammoniak og pyridin begge stærkere baser end vand. Ligevægten vil derfor i begge tilfælde ligge langt til venstre og begunstige det svagere syre-basepar. Den koncentration \(H_3O^+\), som reaktionerne frembringer, er imidlertid stor nok til at sænke opløsningens \(pH\) betydeligt: \(pH\) for en 0,10 M opløsning af ammoniumchlorid eller pyridiniumchlorid ved 25°C er henholdsvis 5,13 eller 3,12.
Hvad sker der med vandige opløsninger af et salt som f.eks. ammoniumacetat, hvor både kationen og anionen kan reagere hver for sig med vand for at danne henholdsvis en syre og en base? Ifølge figur 16.10 vil ammoniumionen sænke \(pH\), mens acetationen ifølge figur 16.9 vil hæve \(pH\). Dette særlige tilfælde er usædvanligt, idet kationen er lige så stærk en syre, som anionen er en base (pKa ≈ pKb). Derfor ophæver de to virkninger hinanden, og opløsningen forbliver neutral. Med salte, hvor kationen er en stærkere syre end anionen er en base, har den endelige opløsning en \(pH\) < 7,00. Omvendt, hvis kationen er en svagere syre end anionen er en base, har den endelige opløsning en \(pH\) > 7,00.
Syre metalioner
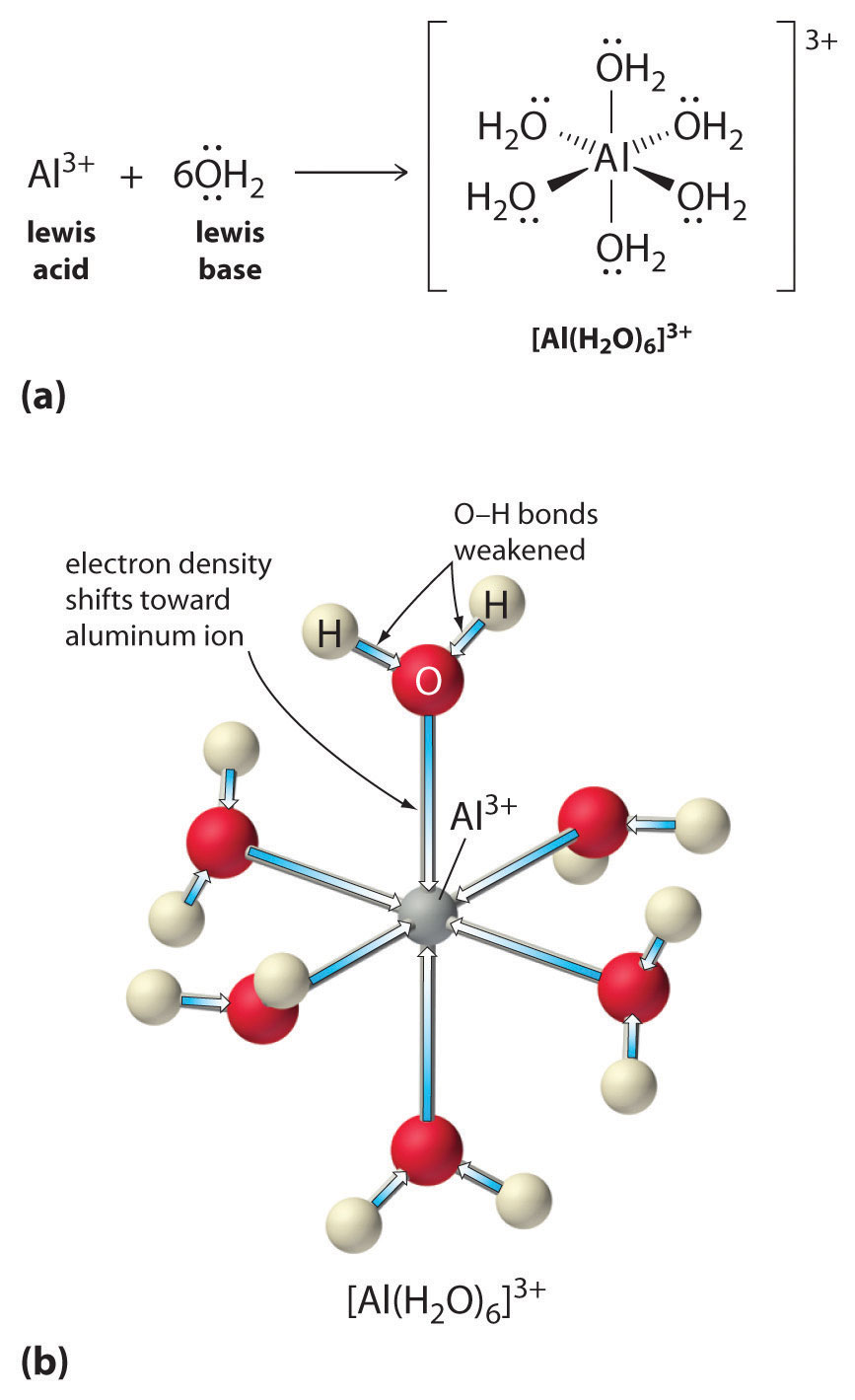
Løsninger af simple salte af metalioner kan også være sure, selv om en metalion ikke kan afgive en proton direkte til vand for at producere \(H_3O^+\). I stedet kan en metalion fungere som en Lewis-syre og interagere med vand, en Lewis-base, ved at koordinere til et ensomt elektronpar på oxygenatomet for at danne en hydreret metalion (figur \(\(\PageIndex{1a}\))). Et vandmolekyle, der er koordineret med en metalion, er mere surt end et frit vandmolekyle af to grunde. For det første gør afvisende elektrostatiske vekselvirkninger mellem den positivt ladede metalion og de delvist positivt ladede hydrogenatomer i det koordinerede vandmolekyle det lettere for det koordinerede vand at miste en proton.
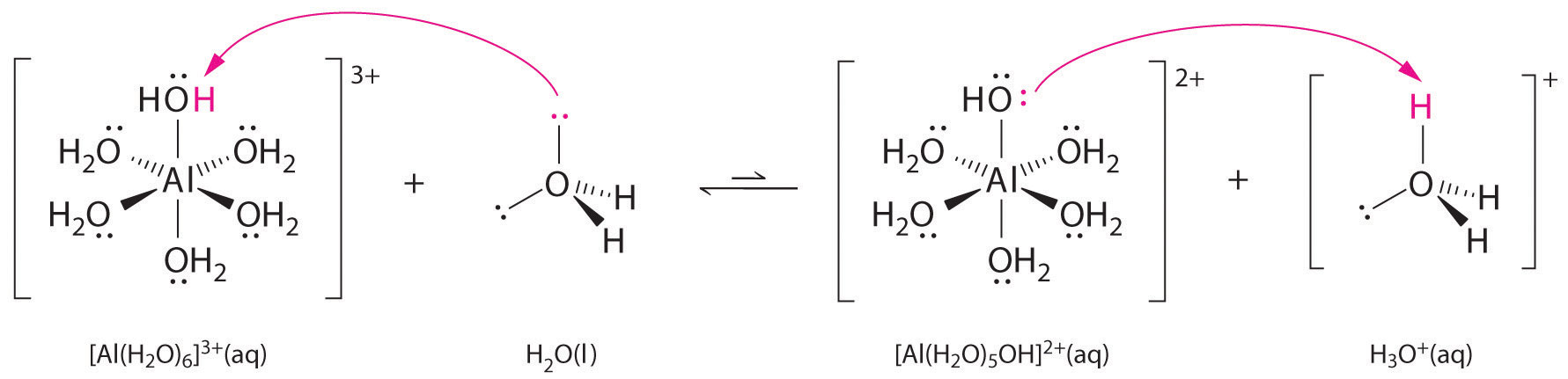
For det andet tiltrækker den positive ladning på \(Al^{3+}\)-ionen elektrontætheden fra vandmolekylernes oxygenatomer, hvilket mindsker elektrontætheden i \(\ce{O-H}\)-bindingerne, som vist i figur \(\PageIndex{1b}\). Med mindre elektrontæthed mellem \(O\)-atomerne og H-atomerne er \(\ce{O-H}\)-bindingerne svagere end i et frit \(H_2O\)-molekyle, hvilket gør det lettere at miste en \(H^+\)-ion.

Størrelsen af denne effekt afhænger af følgende to faktorer (Figur \(\(\PageIndex{3}\)):
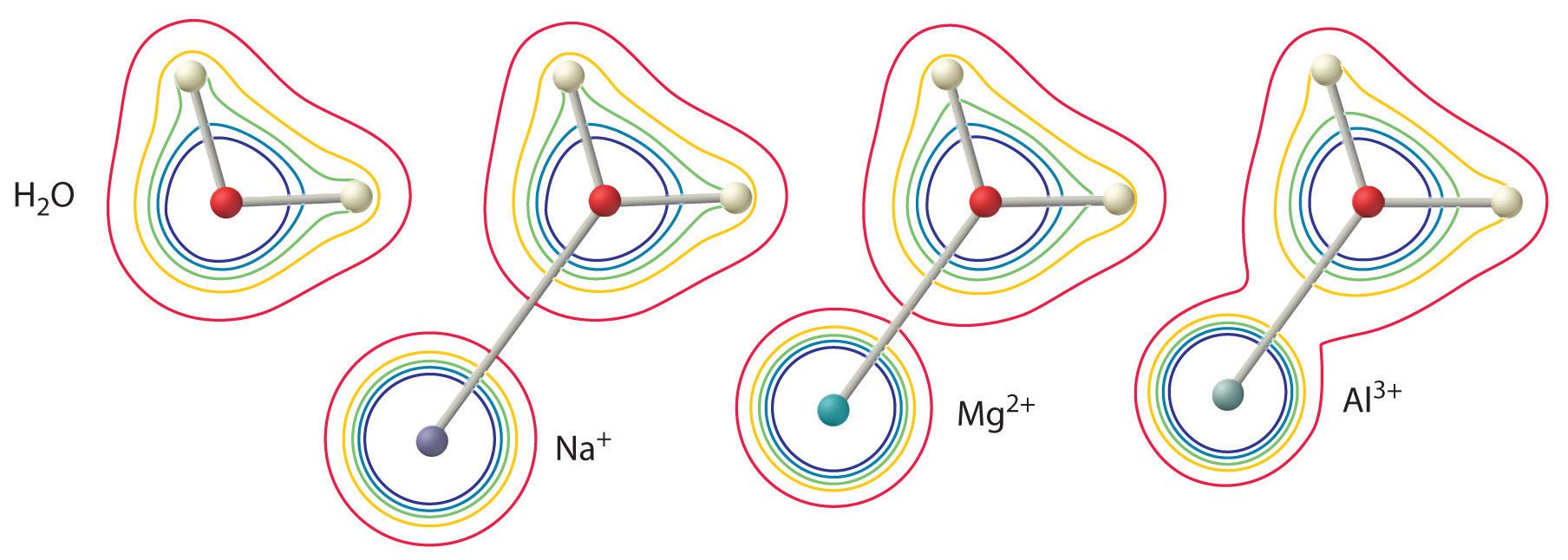
- Ladningen på metalionen. En divalent ion (\(M^{2+}\)) har ca. dobbelt så stærk en virkning på elektrontætheden i et koordineret vandmolekyle som en monovalent ion (\(M^+\)) med samme radius.
- Metalionens radius. For metalioner med samme ladning gælder det, at jo mindre ionen er, jo kortere er den mellemkernede afstand til vandmolekylets iltatom, og jo større er metallets virkning på elektrontæthedsfordelingen i vandmolekylet.
Dermed er vandige opløsninger af små, højt ladede metalioner, såsom \(Al^{3+}\) og \(Fe^{3+}\), sure:
\^{3+}_{(aq)} \rightleftharpoons ^{2+}_{(aq)}+H^+_{(aq)} \label{16.36}\]
Den \(^{3+}\) ion har en \(pK_a\) på 5,0, hvilket gør den næsten lige så stærk en syre som eddikesyre. På grund af de to faktorer, der er beskrevet tidligere, er den vigtigste parameter til forudsigelse af en metalions virkning på surhedsgraden af koordinerede vandmolekyler metalionens ladning/radius-forhold. En række par af metalioner, der ligger på en diagonal linje i det periodiske system, som f.eks. \(Li^+\) og \(Mg^{2+}\) eller \(Ca^{2+}\) og \(Y^{3+}\), har forskellige størrelser og ladninger, men lignende forhold mellem ladning og radius. Som følge heraf har disse metalionpar lignende virkninger på surhedsgraden af koordinerede vandmolekyler, og de udviser ofte også andre betydelige ligheder i kemien.
Syre metalioner
Løsninger af små, højt ladede metalioner i vand er sure.
Reaktioner som dem, der er behandlet i dette afsnit, hvor et salt reagerer med vand for at give en sur eller basisk opløsning, kaldes ofte for hydrolysereaktioner. Det er uheldigt at bruge et særskilt navn for denne type reaktion, fordi det antyder, at de på en eller anden måde er forskellige. Faktisk er hydrolysereaktioner blot syre-base-reaktioner, hvor syren er et kation eller basen er en anion; de adlyder de samme principper og regler som alle andre syre-base-reaktioner.
Hydrolyse
En hydrolysereaktion er en syre-base-reaktion.
Eksempel \(\PageIndex{1}\)
Fortæl, om vandige opløsninger af disse forbindelser er sure, basiske eller neutrale.
- \(KNO_3\)
- \(CrBr_3 \cdot H_2O\)
- \(Na_2SO_4\)
Givet: Forbindelse
Spørgsmålet er: Forbindelse
Spørgsmålet er: Syre eller basiskhed i vandig opløsning
Strategi:
- Vurder syre-base-egenskaberne for kationen og anionen. Hvis kationen er en svag Lewis-syre, vil den ikke påvirke opløsningens \(pH\). Hvis kationen derimod er konjugeret syre til en svag base eller et relativt højt ladet metalkation, vil den reagere med vand og give en sur opløsning.
- Hvis anionen er konjugeret base til en stærk syre, vil den ikke påvirke opløsningens \(pH\). Hvis anionen derimod er den konjugerede base af en svag syre, vil opløsningen være basisk.
Løsning:
a
- Den \(K^+\) kation har en lille positiv ladning (+1) og en relativt stor radius (fordi den står i fjerde række i det periodiske system), så den er en meget svag Lewis-syre.
- Den \(NO_3-\) anion er den konjugerede base af en stærk syre, så den har stort set ingen basisk karakter (tabel 16.1). Derfor vil hverken kationen eller anionen reagere med vand for at danne \(H^+\) eller \(OH^-\), og opløsningen vil være neutral.
b.
- Den \(Cr^{3+}\)-ion er et relativt højt ladet metalkation, der bør opføre sig på samme måde som \(Al^{3+}\)-ionen og danne 3+-komplekset, der vil opføre sig som en svag syre: \^{3+}_{(aq)} \ce{ <=>>} Cr(H_2O)_5(OH)]^{2+}_{(aq)} + H^+_({aq)}\]
- Anionen \(Br^-\) er en meget svag base (det er den konjugerede base til den stærke syre \(HBr\)), så den påvirker ikke opløsningens \(pH\). Derfor vil opløsningen være sur.
c.
- Ionen \(Na^+\) er ligesom \(K^+\) en meget svag syre, så den bør ikke påvirke opløsningens surhedsgrad.
- I modsætning hertil er \(SO_4^{2-}\) den konjugerede base til \(HSO_4^{2-}\), som er en svag syre. Derfor vil ionen \(SO_4^{2-}\) reagere med vand som vist i figur 16.6 og give en svagt basisk opløsning.
Ovelse \(\(\PageIndex{1}\)
Forudsig, om vandige opløsninger af følgende er sure, basiske eller neutrale.
- \(KI\)
- \(Mg(ClO_4)_2\)
- \(NaHS\)
Svar a
neutral
Svar b
sur
Svar c
basisk (pga. reaktionen af \(HS^-\) med vand til dannelse af \(H_2S\) og \(OH^-\))
Summary
Et salt kan opløses i vand og danne en neutral, en basisk eller en sur opløsning, afhængigt af, om det indeholder den konjugerede base af en svag syre som anion (\(A^-\)), den konjugerede syre af en svag base som kation (\(BH^+\)) eller begge dele. Salte, der indeholder små, stærkt ladede metalioner, giver sure opløsninger i vand. Reaktionen af et salt med vand for at frembringe en sur eller basisk opløsning kaldes en hydrolysereaktion.