Úvod
ß amyloid a fosforylované tau proteiny jsou patologickými znaky Alzheimerovy choroby (AD), které se hromadí a předvídatelně šíří distribuovanými neuronálními sítěmi, způsobují progresivní metabolické abnormality, poškození neuronů a buněčnou smrt. Neurozobrazení usnadňuje podrobné posouzení těchto patologických změn u pacientů, kteří podstupují vyšetření kvůli poklesu kognitivních funkcí. Dříve bylo možné definitivní diagnózu AD stanovit pouze postmortálním pozorováním a neuroanatomickým stagingem těchto proteinových agregátů. Nejnovější pokroky v molekulárním zobrazování však umožňují vizualizaci depozit amyloidu a tau v živém lidském mozku a přiblížily nás k definitivní diagnóze AD in vivo.
Strukturální zobrazování
Pokyny Americké neurologické akademie (AAN) pro diagnostické vyšetření osob s kognitivními obtížemi1 doporučují strukturální zobrazování mozku pomocí nekontrastního CT nebo MRI u všech osob s pozitivní klinickou anamnézou a objektivními kognitivními změnami. V této souvislosti je primárním úkolem zobrazovacích metod mozku vyloučit nedegenerativní strukturální léze, z nichž 5 % nemusí být z klinické anamnézy nebo fyzikálního vyšetření zřejmých2 a jsou potenciálně léčitelné. AAN rovněž doporučuje klinicky vyloučit vaskulární demenci (VaD), demenci s Lewyho tělísky (DLB) a frontotemporální demenci (FTD). Strukturální zobrazovací metody mohou zvýšit diagnostickou jistotu a změnit klinickou diagnózu v 19 až 28 % i management 15 % klinických případů.2
Zobrazovacími metodami volby při posuzování strukturální atrofie jsou CT a MRI. Pomocí těchto modalit byly důkladně popsány a ověřeny vzorce atrofie specifické pro dané onemocnění. Ačkoli je atrofie pozorovatelná na CT, přirozeně nižší prostorové rozlišení a horší kontrast šedé/bílé hmoty vedou ke ztrátě potenciálně užitečných jemných pozorování týkajících se neurodegenerativních změn. Proto se kliničtí lékaři často spoléhají na MRI, aby posoudili vzor a závažnost strukturálních změn, vyloučili jiné než neurodegenerativní příčiny poklesu kognitivních funkcí a zhodnotili závažnost a rozsah změn bílé hmoty, jak je podrobněji popsáno níže.
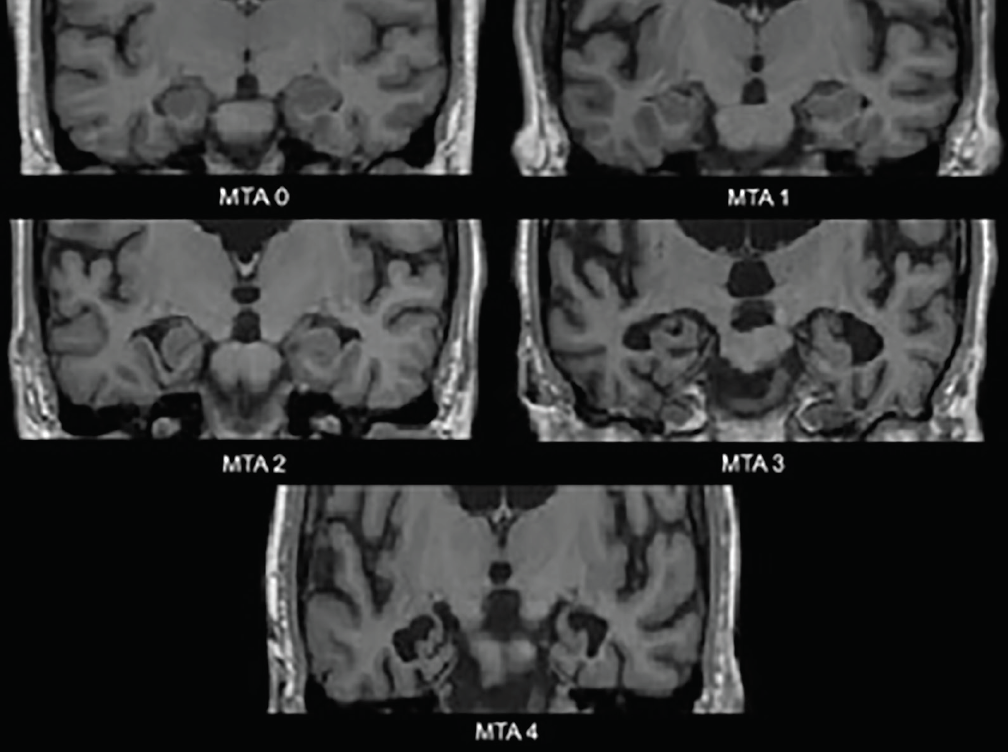
Nejčasnější neurodegenerativní změny u AD se vyskytují v mediálních temporálních lalocích – hipokampu, entorhinální kůře a parahipokampálním gyru. S nástupem atrofie dochází k rozšíření cévnatkové štěrbiny a temporálního rohu postranní komory; tyto změny lze nejlépe posoudit v koronální rovině. Běžně používaná vizuální hodnotící škála založená na těchto strukturách – škála mediální temporální atrofie (MTA) (obr. 1) – byla klinicky3 a neuropatologicky4 ověřena. Různé studie využívající tuto stupnici nebo struktury, které hodnotí, prokázaly významnou schopnost rozlišit osoby s Alzheimerovou chorobou od věkově srovnatelných kontrol4 nebo osob s DLB4 nebo vaskulární kognitivní poruchou (VCI).5 Mediální temporální atrofie je také prediktivní pro přechod z amnestické mírné kognitivní poruchy (MCI) do Alzheimerovy demence.3
Klikněte pro větší zobrazení
Obrázek 1. Hodnocení na stupnici mediální temporální atrofie (MTA). MTA 0-žádné nebo minimální rozštěpení cévnatkové štěrbiny; MTA 1-mírné rozšíření cévnatkové štěrbiny; MTA 2-další rozšíření cévnatkové štěrbiny, která splývá s temporálním rohem postranní komory, mírné snížení výšky hipokampální formace; MTA 3 – mírné snížení výšky hipokampální formace, výrazné rozšíření temporálního rohu postranní komory; MTA 4 – závažné snížení výšky hipokampální formace, výrazné rozšíření temporálního rohu postranní komory.
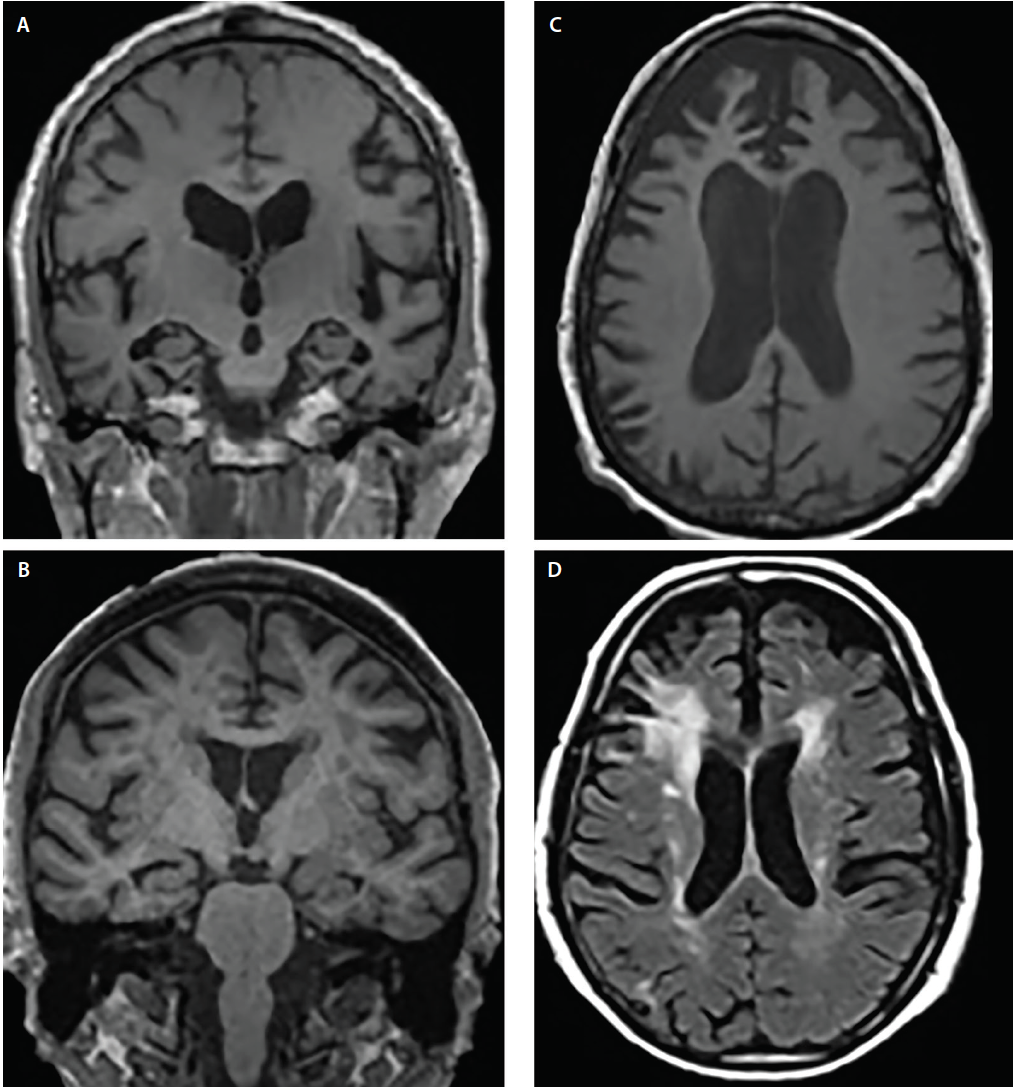
Syndromy demence obvykle vykazují kanonické vzorce atrofie6 , které odpovídají kognitivním a behaviorálním příznakům; postižené struktury se však mohou překrývat. Například AD i DLB vykazují postižení mediálního temporálního laloku, ale několik zobrazovacích a neuropatologických studií ukázalo, že ve srovnání s AD má DLB výrazně menší predilekci mediálních temporálních struktur4,5 (obr. 2).
Klikněte pro zobrazení většího obrázku
Obrázek č. 2. Strukturální vzorce atrofie u Alzheimerovy choroby (AD) (A), demence s Lewyho tělísky (DLB) (B), frontotemporální demence (FTD) (C) a vaskulární demence (VaD) (D). Koronární T1 vážená MRI prokazuje generalizovanou kortikální atrofii, ale různý stupeň hipokampální atrofie u AD (A) a DLB (B). Axiální T1 vážená MRI prokazuje atrofii bvFTD s fokální predilekcí mediálního a laterálního prefrontálního kortexu (C). Axiální T2 vážená MRI prokazuje splývající periventrikulární čepičku a halo hypointenzity bílé hmoty (WMH) zahrnující corona radiata a zasahující do laterálního prefrontálního neokortexu, mírné rozptýlené WMH a WMH subependymální komorové výstelky a septa pellucidum u VaD (D).
U AD i frontotemporální lobární degenerace (FTLD) se oblasti atrofie překrývají, včetně oblastí prefrontálního, orbitofrontálního a předního insulárního kortexu, jakož i předního a mediálního temporálního laloku.6 Ve vzájemném poměru však AD vykazuje výrazně větší atrofii v laterálních parietálních a okcipitálních kortexech, zatímco FTLD vykazuje větší atrofii ve frontálních lalocích (obr. 2).6
Je důležité systematicky hodnotit všechny oblasti mozku a všímat si oblastí strukturální atrofie i anatomické šetrnosti, aby bylo možné diagnostické zobrazování co nejlépe využít. Rozsáhlá multicentrická studie nedávno hodnotila schopnost 6 vizuálních hodnotících škál správně klasifikovat 186 patologicky potvrzených případů AD, DLB a FTLD.6 Tato studie ukázala, že současné hodnocení více oblastí specifických pro dané onemocnění poskytlo výrazně lepší rozlišení než zaměření na jedinou oblast.4
Cévní poškození je důležitým faktorem při posuzování osob s kognitivní poruchou. Ischemické změny jsou běžné při normálním stárnutí a urychlují je běžné komorbidity (např. hypertenze, diabetes a hypercholesterolemie). Na cévní podíl na kognitivní poruše se často usuzuje, pokud jsou na T2 vážených sekvencích nebo sekvencích FLAIR (fluid attenuated inversion recovery) zjištěny významné hyperintenzity bílé hmoty (WMH), kortikální mrtvice nebo strategicky umístěné lakuny. Lakunární příhody bazálních ganglií a WMH v centrum semiovale a corona radiata jsou ukazateli chronického ischemického poškození malých cév (obr. 2). Naproti tomu periventrikulární uzávěry jsou často neischemického původu a odrážejí subependymální gliózu.7 Existuje několik stupnic závažnosti WMH (např. Fazekasova stupnice)7 , které lze použít v klinických podmínkách. Všechny tyto skórovací algoritmy se shodují na tom, že rozsáhlé splývající WMH a subkortikální lakunární infarkty jsou přinejmenším částečně pravděpodobnými faktory, které přispívají k poklesu kognitivních funkcí.7
Difuzní tenzorové zobrazení (DTI) je nová sekvence MRI citlivá na difúzi vody tkání, která hodnotí integritu bílé hmoty, protože architektura axonů omezuje tok vody. K charakterizaci neurodegenerativních změn na DTI se často používají míry střední difuzivity a frakční anizotropie. První z nich měří velikost difuze a druhá měří, zda voda proudí přednostně jedním směrem, jak se očekává u zdravých axonů. Snížená střední difuzivita a snížená frakční anizotropie byly konzistentně zaznamenány jak u populace s MCI, tak u populace s demencí při AD.8 Několik studií také identifikovalo změny DTI u asymptomatických jedinců s rizikem rozvoje AD9 , což naznačuje, že k těmto změnám dochází v časné fázi onemocnění. Kromě hodnocení integrity bílé hmoty lze DTI použít k modelování hrubé strukturální konektivity mezi korovými oblastmi pomocí algoritmů traktografie. To se prosadilo v oblasti AD, protože důkazy naznačují, že amyloidová a tauová patologie se může šířit prostřednictvím mozkových spojení.10 Ačkoli DTI vykazuje potenciál jako měřítko integrity bílé hmoty, její citlivost na pohyb a další technická omezení přinejmenším prozatím omezují její klinické využití.10
Funkční zobrazování
Mozkový hypometabolismus je snadno pozorovatelný u neurodegenerativních poruch a může pomoci při diferenciální diagnostice. Funkce neuronů je závislá na přísunu kyslíku a glukózy z krve, jejichž dodávku usnadňuje regionální vazodilatace. Pozitronová emisní tomografie s 18F-fluorodeoxyglukózou (FDG-PET) nepřímo odráží stupeň kortikální aktivity a lze ji snadno použít k vizualizaci neurodegenerativních změn využitím této metabolické závislosti na glukóze.
Charakteristický hypometabolický kortikální podpis AD sestává z časných změn v zadním cingulátu (PCC); precuneu; temporálním, parietálním a v pozdějších stadiích frontálním kortexu. Tento vzorec se projevuje brzy, dokonce presymptomaticky11 , a je klinicky užitečný při odlišení AD od FTD.12 Na rozdíl od AD odhaluje metabolický podpis FTD frontální, přední temporální, bazální gangliový a thalamický hypometabolismus s relativní šetrností zadních asociačních kortiků.13 V klinicky nejistých situacích mohou kliničtí lékaři tyto metabolické znaky použít k odlišení AD od FTD.12 Podobně, ačkoli se neokortikální metabolický znak DLB může matoucím způsobem překrývat se znakem AD, mohou případy DLB vykazovat také okcipitální hypometabolismus.14
Center for Medicare & Medicaid Services považuje FDG-PET za „přiměřenou a nezbytnou“ pouze u osob splňujících kritéria pro AD i FTD, u nichž úplné diagnostické vyšetření podle pokynů AAN1 definitivně neprokázalo etiologii.15
Funkční MRI (fMRI) může také měřit mozkovou aktivitu pomocí sekvencí, které jsou citlivé na časové změny okysličeného/odkysličeného hemoglobinu v důsledku mozkové aktivity. Tímto způsobem je fMRI příbuzná s FDG-PET, protože změny hemoglobinu jsou řízeny metabolismem glukózy potřebným pro mozkovou aktivitu. Časové závislosti mezi oblastmi lze využít k odvození funkční konektivity (tj. které oblasti spolu aktivně komunikují). Ve srovnání s FDG-PET nabízí fMRI lepší prostorové rozlišení, což umožňuje přesnější mapování konektivity. Další výhodou fMRI je, že ji lze získat během provádění úkolu nebo v klidu. V prvním případě se identifikují vzorce konektivity řízené specifickými aktivními stavy, zatímco v druhém případě se identifikují vzorce konektivity přítomné v klidu, známé jako síť výchozího režimu (DMN). DMN je definována funkčními uzly, PCC a precuneus, které se napojují na dorzální mediální subsystém a mediální temporální subsystém.16 Předpokládá se, že ukládání amyloidu začíná ve funkčních uzlech DMN. Je známo, že DMN je u AD postižena.16 Naproti tomu u FTD je DMN ušetřena, zatímco sítě salience nebo pozornosti jsou postiženy.17 V současné době je technologie fMRI omezena na výzkumné aplikace, ale aktivně se zkoumají možnosti vývoje relevantních klinicky použitelných algoritmů.
Molekulární zobrazování
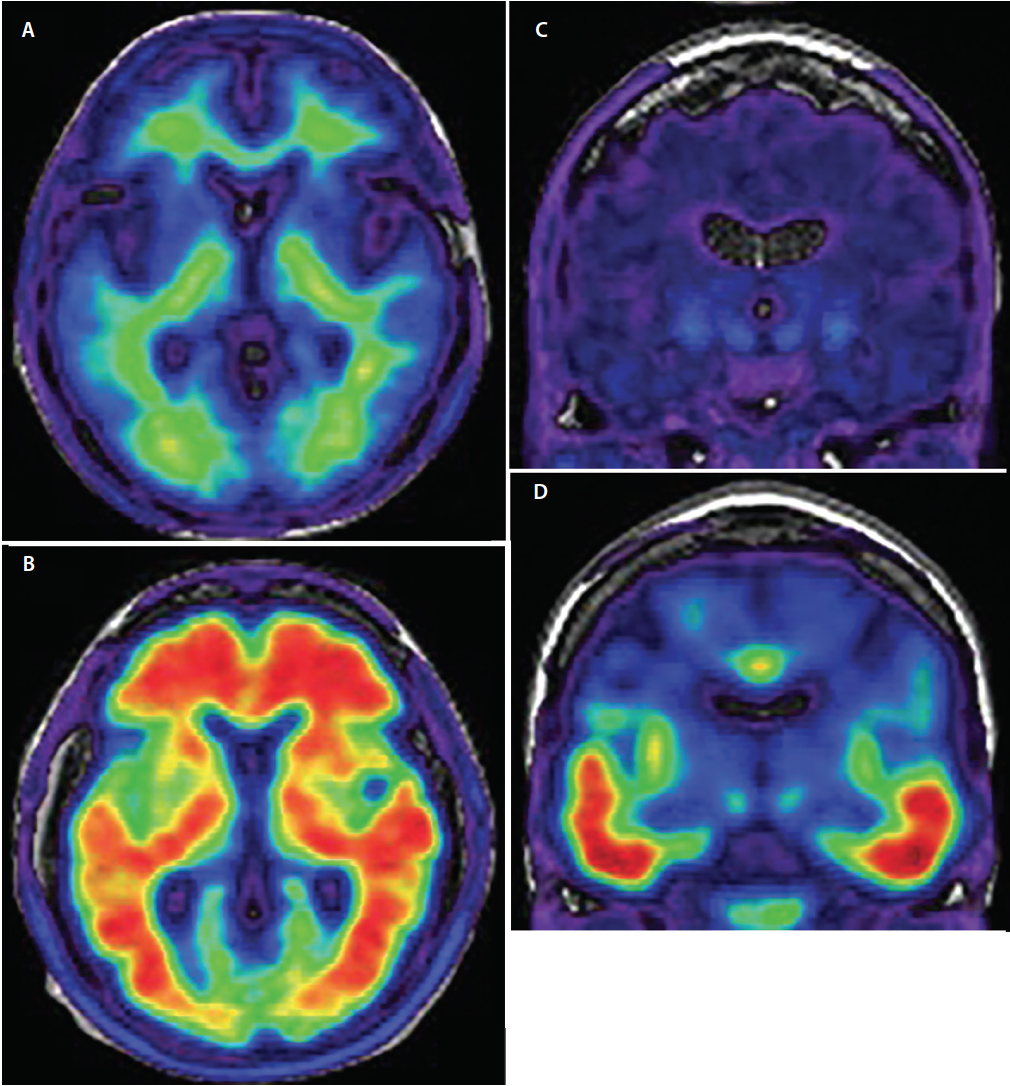
Kriteriálním standardem pro definitivní diagnózu AD je postmortální neuropatologické vyšetření mozku. I v rukou zkušených odborníků na demence dosahuje klinická diagnóza AD pouze znepokojivé senzitivity 70,9 % až 87,3 % a specificity 44,3 % až 70,8 %.18 Největší význam pro zlepšení přesnosti klinické diagnostiky AD má vývoj radioaktivně značených zobrazovacích markerů PET se specifickou afinitou k agregátům ß amyloidu a fosforylovaného tau (obr. 3), které umožňují in vivo prokázat základní neuropatologii (tab.), kdysi možnou pouze post mortem.
Klikněte pro zobrazení většího obrázku
Obrázek 3. Axiální amyloid-PET demonstrující amyloid negativní (A) a amyloid pozitivní skeny (B). Na snímcích s negativním amyloidem (A) vykazuje signál radiotraceru nízkou intenzitu a je omezen na nespecifickou vazbu v bílé hmotě. Spojení šedé a bílé hmoty je zachováno. Na amyloid pozitivních snímcích (B) má signál radiotraceru vysokou intenzitu a difúzně zasahuje do oblastí šedé kůry a zakrývá spojení šedé a bílé hmoty. Koronární tau-PET demonstrující tau negativní (C) a tau pozitivní (D) snímky. U tau negativních skenů je minimální, nespecifický signál radiotraceru nízké intenzity v mediálních oblastech spánku, bazálního předního mozku a bazálních ganglií. U tau-pozitivních skenů (D) je signál radiotraceru vyšší intenzity a zahrnuje dolní a laterální spánkovou kůru podle známé trajektorie progrese neurofibrilárních klubek.
Amyloidová pozitronová emisní tomografie
Amyloid a nověji i zobrazování tau způsobily revoluci v naší schopnosti vizualizovat patologii AD i v presymptomatických stadiích.19 Amyloidové PET zobrazovací tracery jsou validní a spolehlivé pro detekci patologie AD in vivo v různých stadiích onemocnění. Tyto zobrazovací tracery vážou specifické konformační motivy amyloidového proteinu a vedou k vychytávání traceru, které úzce koreluje s postmortálním ukládáním amyloidu.20
V porovnání s tau začíná amyloidová patologie v difuzněji rozloženém regionálním vzorci šířícím se od bazálních částí frontálních, temporálních a okcipitálních laloků k dorzálním neokortikálním asociačním oblastem s postižením primárního senzorického a motorického kortexu až v pozdním stadiu.21 Nejvýraznějšími oblastmi vychytávání stopovače jsou frontální, parietální a laterální temporální kortex (obr. 3), přičemž vychytávání je 1,5 až 2krát vyšší u osob s AD oproti kontrolním skupinám22 nebo osobám s jinými demencemi.23
Snímky PET s amyloidem se hodnotí na vychytávání kortikálního stopovače v charakteristických oblastech distribuce amyloidu u AD. Pozitivní skeny ukazují ztrátu rozlišení šedé a bílé hmoty, protože vychytávání traceru se rozšiřuje do neokortexu. Negativní skeny zachovávají rozdíl mezi šedou a bílou hmotou a ukazují pouze vazbu na bílou hmotu mimo cíl.24 Vzory zobrazování amyloidu PET mohou spolehlivě předpovědět zhoršení kognitivních funkcí jak u zdravých lidí, tak u lidí s MCI.20
18F-florbetapir, 18F-florbetaben a 18F-flutemetamol jsou schváleny Úřadem pro kontrolu potravin a léčiv (FDA) pro klinické použití.20 Pojišťovny však tuto technologii nepřijaly kvůli nákladům a riziku klinického nadužívání při absenci léčby modifikující onemocnění a prokázanému přínosu. Metaanalýza uvádí 95% senzitivitu a 57% specificitu pozitivního PET vyšetření amyloidu pro předpověď přechodu z MCI do AD.25
Nejistý vztah mezi náklady, rizikem a přínosem vedl k vytvoření kritérií vhodného použití pro zobrazování amyloidu, která přisuzují potřebu hodnocení PET amyloidu osobám s nevysvětlitelnou MCI, atypickými projevy AD a časnou demencí.26 Odborníci rovněž identifikovali nevhodné indikace pro zobrazování amyloidu, které zahrnují samostatné hodnocení kognitivních problémů před důkladným klinickým, kognitivním, laboratorním a strukturálním neurozobrazovacím vyšetřením; při absenci objektivní kognitivní poruchy; při vysoké pravděpodobnosti AD (tj. při absenci klinického vybavení; a pro stanovení stupně závažnosti demence.
Studie IDEAS (Imaging dementia-evidence for amyloid scanning) – probíhající studie Center for Medicare and Medicaid Services – v současné době ověřuje kritéria vhodného použití a hodnotí dopad stavu amyloidu stanoveného pomocí PET na léčbu onemocnění a dlouhodobé výsledky u příjemců Medicare s MCI nebo atypickými projevy. Průběžná analýza ukázala, že začlenění PET amyloidu do klinického vyšetření vedlo ke změně léčby onemocnění u 60,2 % osob s MCI a 63,5 % osob s demencí.27 Dlouhodobé výsledky se stále zjišťují.
Tau pozitronová emisní tomografie
Tau je druhý protein, který se ukládá v mozku osob s AD. V současné době se vyvíjejí zobrazovací tracery PET tau, které se již nyní ukazují jako slibné. Podobně jako amyloidová PET se tau PET tracery zaměřují na konkrétní konformační motivy fosforylovaného tau. Specifičnost tau stopovacích látek byla ověřena post mortem28 a pozorovaný signál tau PET přesně odpovídá anatomickému rozložení neurofibrilárních klubek, které se v současné době používá pro neuropatologickou diagnózu AD.29 Nejranějšími stadii tau patologie, která lze zobrazit pomocí tau PET, jsou ložiska neurofibrilárních klubek v entorhinální kůře a hipokampu. Následně jsou tau depozita detekovatelná v dolním a laterálním temporálním kortexu (obr. 3), poté v parietálním a okcipitálním a nakonec ve frontálním kortexu podle zavedeného Braakova a Braakova patologického stagingu ukládání tau depozit v mozku.21 Tau tracery nejsou bez diagnostických omezení a procházejí dalším vývojem s cílem lépe definovat jejich klinickou roli. Nicméně vzhledem k tomu, že se vazba tau traceru dynamicky mění v průběhu celého klinického průběhu AD, bude tato zobrazovací metoda pravděpodobně hrát významnou roli při stagingu závažnosti onemocnění in vivo.30
Budoucí směry
Vzhledem k tomu, že patologii AD lze snadno odhalit až 20 let před stanovením diagnózy demence19 a má předvídatelné stupňovité rozložení, výzkum se nyní zaměřuje na včasnou presymptomatickou detekci a zlepšení diagnostické přesnosti pomocí biomarkerů (tabulka).31 Navrhovaný rámec výzkumu amyloid-tau-neurodegenerace (ATN) zaměřený na detekci změn 3 biomarkerů v mozku předpovídá klinický význam multimodálního zobrazování.31 Klasifikační systém ATN je agnostický vůči klinickým syndromům a zachycuje celé spektrum neurodegenerativních onemocnění optikou biomarkerů AD. Po dalším vývoji a zdokonalení se očekává, že ATN prostřednictvím objektivní kategorizace biomarkerů in vivo výrazně zlepší přesnost klinické diagnostiky a zvýší kvalitu péče.
Závěr
Neurozobrazení nabízí jedinečné informace o základní etiologii kognitivních poruch a usnadňuje pacientům a rodinám orientaci v obávané a nejisté zkušenosti. Všechna neurodegenerativní onemocnění vykazují značnou klinickou heterogenitu a před nejnovějšími pokroky v oblasti molekulárního zobrazování nebylo možné žádné z nich definitivně diagnostikovat před smrtí. Moderní zobrazovací technologie mozku jsou schopny odhalit množství epifenoménů odrážejících základní neuropatologii, z nichž některé jsou zcela proximálně od zdroje onemocnění. Nejjistější klinická diagnóza je v současné době založena na integraci klinické anamnézy, pozorování lékaře, fyzikálního vyšetření, lékařského vyšetření, neuropsychologického testování a informované interpretace diagnostického neurozobrazení. S dalším zdokonalováním biomarkerů ATN bude klinická diagnóza u žijících pacientů stanovena dříve a definitivněji, bude se méně spoléhat na klasifikaci příznaků a poskytne možnosti časnější léčebné intervence, která může změnit trajektorii neurodegenerativního onemocnění.
1. Knopman DS, DeKosky ST, Cummings JL, et al. Practice parameter: diagnosis of dementia (an evidence-based review). Zpráva podvýboru pro standardy kvality Americké neurologické akademie. Neurologie. 2001;56(9):1143-1153.
2. Chui H, Zhang Q. Evaluation of dementia: a systematic study of the usefulness of the American Academy of Neurology’s practice parameters. Neurologie. 1997;49(4):925-935.
3. Apostolova LG, Thompson PM, Green AE, et al. 3D srovnání nízké, střední a pokročilé hipokampální atrofie u MCI. Hum Brain Mapp. 2010;31(5):786-797.
4. Harper L, Fumagalli GG, Barkhof F, et al. MRI visual rating scales in the diagnosis of dementia: evaluation in 184 post-mortem confirmed cases. Brain. 2016;139(Pt 4):1211-1225.
5. Burton EJ, Barber R, Mukaetova-Ladinska EB, et al. Medial temporal lobe atrophy on MRI differentiates Alzheimer’s disease from dementia with Lewy bodies and vascular cognitive impairment: a prospective study with pathological verification of diagnosis. Brain. 2009;132(Pt 1):195-203.
6. Harper L, Bouwman F, Burton EJ, et al. Patterns of atrophy in pathologically confirmed dementias: a voxelwise analysis. J Neurol Neurosurg Psychiatry. 2017;88(11):908-916.
7. Fazekas F, Kleinert R, Offenbacher H, et al. Pathologic correlates of incidental MRI white matter signal hyperintensities. Neurologie. 1993;43(9):1683-1689.
8. Huang J, Friedland RP, Auchus AP. Difuzní tenzorové zobrazení normálně vypadající bílé hmoty u mírné kognitivní poruchy a časné Alzheimerovy choroby: předběžný důkaz axonální degenerace v temporálním laloku. AJNR Am J Neuroradiol. 2007;28(10):1943-1948.
9. Selnes P, Fjell AM, Gjerstad L, et al. Změny zobrazování bílé hmoty u subjektivní a mírné kognitivní poruchy. Alzheimers Dement. 2012;8(5 Suppl):S112-S121.
10. Jacobs HIL, Hedden T, Schultz AP, et al. Structural tract alterations predict downstream tau accumulation in amyloid-positive older individuals. Nat Neurosci. 2018;21(3):424-431.
11. Apostolova LG, Thompson PM, Rogers SA, et al. Surface feature-guided mapping of cerebral metabolic changes in cognitively normal and mildly impaired elderly. Mol Imaging Biol. 2010;12(2):218-224.
12. Foster NL, Heidebrink JL, Clark CM, et al. FDG-PET zlepšuje přesnost při rozlišování frontotemporální demence a Alzheimerovy choroby. Brain. 2007;130(Pt 10):2616-2635.
13. Ishii K, Sakamoto S, Sasaki M, et al. Cerebrální metabolismus glukózy u pacientů s frontotemporální demencí. J Nucl Med. 1998;39(11):1875-1878.
14. Mosconi L, Tsui WH, Herholz K, et al. Multicentrická standardizovaná 18F-FDG PET diagnostika mírné kognitivní poruchy, Alzheimerovy choroby a dalších demencí. J Nucl Med. 2008;49(3):390-398.
15 . Centers for Medicare & Medicaid Serivces. Decision Memo for Positron Emission Tomography (FDG) and Other Neuroimaging Devices for Suspected Dementia (CAG-00088R)https://www.cms.gov/medicare-coverage-database/details/nca-decision-memo.aspx?NCAId=104. Přístup 4. května 2019.
16. Buckner RL, Sepulcre J, Talukdar T a kol. Kortikální uzly odhalené pomocí vnitřní funkční konektivity: mapování, hodnocení stability a vztah k Alzheimerově chorobě. J Neurosci. 2009;29(6):1860-1873.
17. Seeley WW, Crawford RK, Zhou J, Miller BL, Greicius MD. Neurodegenerativní onemocnění se zaměřují na rozsáhlé sítě lidského mozku. Neuron. 2009;62(1):42-52.
18. Beach TG, Monsell SE, Phillips LE, Kukull W. Accuracy of the clinical diagnosis of Alzheimer disease at National Institute on Aging Alzheimer Disease Centers, 2005-2010. J Neuropathol Exp Neurol. 2012;71(4):266-273.
19. Jagust W. Zobrazování vývoje a patofyziologie Alzheimerovy choroby. Nat Rev Neurosci. 2018;19(11):687-700.
20. Rice L, Bisdas S. The diagnostic value of FDG and amyloid PET in Alzheimer’s disease-a systematic review. Eur J Radiol. 2017;94:16-24.
21. Braak H, Braak E. Neuropatologické stadium změn souvisejících s Alzheimerovou chorobou. Acta Neuropathol. 1991;82(4):239-259.
22. Klunk WE, Engler H, Nordberg A, et al. Zobrazování mozkového amyloidu u Alzheimerovy choroby pomocí Pittsburgh Compound-B. Ann Neurol. 2004;55(3):306-319.
23. Ossenkoppele R, Jansen WJ, Rabinovici GD, et al. Prevalence pozitivity amyloidu PET u syndromů demence: metaanalýza. JAMA. 2015;313(19):1939-1949.
24. Minoshima S, Drzezga AE, Barthel H, et al. SNMMI procedure standard/EANM Practice Guideline for Amyloid PET Imaging of the Brain 1.0. (Norma postupu SNMMI/EANM Practice Guideline pro amyloidové PET zobrazení mozku 1.0). J Nucl Med. 2016;57(8):1316-1322.
25. Ma Y, Zhang S, Li J, et al. Prediktivní přesnost zobrazování amyloidu pro progresi z mírné kognitivní poruchy do Alzheimerovy choroby s různou délkou sledování: metaanalýza. . Medicine (Baltimore). 2014;93(27):e150.
26. Johnson KA, Minoshima S, Bohnen NI, et al. Appropriate use criteria for amyloid PET: a report of the Amyloid Imaging Task Force, the Society of Nuclear Medicine and Molecular Imaging, and the Alzheimer’s Association. Alzheimers Dement. 2013;9(1):e1-e16.
27. Rabinovici GD, Gatsonis C, Apgar C, et al. Association of amyloid positron emission tomography with subsequent change in clinical management among medicare beneficiaries with mild cognitive impairment or dementia. JAMA. 2019;321(13):1286-1294.
28. Aguero C, Dhaynaut M, Normandin MD, et al. Autoradiografické ověření nového tau PET traceru -MK-6240 na lidské postmortální mozkové tkáni. Acta Neuropathol Commun. 2019;7(1):37.
29. Chien DT, Bahri S, Szardenings AK, et al. Early clinical PET imaging results with novel PHF-tau radioligand -T807. J Alzheimers Dis. 2013;34(2):457-468.
30. Wang L, Benzinger TL, Su Y, et al. Evaluation of tau imaging in staging Alzheimer disease and revealing interactions between beta-amyloid and tauopathy [Hodnocení zobrazování tau při stagingu Alzheimerovy choroby a odhalování interakcí mezi beta-amyloidem a tauopatií]. JAMA Neurol. 2016;73(9):1070-1077.
31. Jack CR, Jr, Bennett DA, Blennow K, et al. NIA-AA Research Framework: Toward a biological definition of Alzheimer’s disease (K biologické definici Alzheimerovy choroby). Alzheimers Dement. 2018;14(4):535-562.
MRA a DS neuvádějí žádné informace.
LGA působil jako člen poradního sboru společnosti Eli Lilly.