Intracelulární signály, jako je poškození DNA buňky, řídí apoptózu především vnitřní cestou. Intrinsická cesta apoptózy, která zahrnuje konzervované signální proteiny, je fyzicky spojena s mitochondriemi a u obratlovců je citlivá na mitochondriální oxidační stres. Dráha je ovlivňována členy rodiny Bcl vázanými na mitochondriální membránu, včetně genu Bax a Bcl-2, které působí jako pro-, respektive anti-apoptotické regulační proteiny.
Přehled vnitřní dráhy apoptózy
Vnitřní dráha apoptózy je iniciována například chemoterapií a/nebo radioterapií. Je aktivována řadou exogenních a endogenních podnětů, jako je poškození DNA, ischemie a oxidační stres. Kromě toho hraje důležitou funkci ve vývoji a při eliminaci poškozených buněk.
Vnitřní cestou je funkčním důsledkem proapoptotické signalizace narušení mitochondriální membrány a uvolnění cytochromu c do cytoplazmy, kde tvoří komplex neboli apoptosom s apoptotickým proteázovým aktivačním faktorem 1 (APAF1) a neaktivní formou kaspázy-9. Tento komplex hydrolyzuje adenosintrifosfát a štěpí a aktivuje kaspázu-9. Iniciační kaspáza-9 pak štěpí a aktivuje exekuční kaspázy-3/6/7, což vede k apoptóze buňky. To je zcela odlišné od extracelulárních signálů, které jsou obvykle generovány cytotoxickými buňkami imunitního systému a spouštějí apoptózu hlavně prostřednictvím extrinzické dráhy.
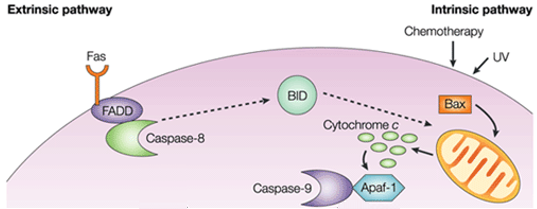
Obrázek 1: Rozdíl mezi extrinzickou a intrinzickou dráhou. Rozdíl mezi vnější a vnitřní cestou.
Proces a regulace vnitřní cesty apoptózy
Vnitřní cesta apoptózy vyvolává apoptózu přímou aktivací kaspázy-3 nebo štěpením bid (agonista smrti interagující s doménou BH3), což vede k mitochondriální dysfunkci a následnému uvolnění cytochromu c a aktivaci kaspáz-9 a kaspáz-3. Kaspáza-3 podporuje typické znaky apoptózy, včetně fragmentace DNA a buněčné smrti v několika tkáních.
Rodina proteinů B-cell lymphoma 2 (Bcl-2) přísně kontroluje aktivaci intrinsické dráhy. Vyskytuje se u folikulárního lymfomu a poprvé byl identifikován jako jeden z genů podílejících se na buněčné smrti buď aktivací proapoptotické, nebo inhibicí anti-apoptotické apoptózy. Proteiny v jedné podskupině, včetně Bid, Bad, Bim, Bmf, Puma a Noxa, obsahují jedinou doménu Bcl-2 homologie 3 (proteiny obsahující pouze BH3) a mají proapoptotickou aktivitu. Dvě další podskupiny proteinů mají více domén BH. První podskupina, zahrnující Bcl-2 asociovaný protein X (Bax), Bcl-2 homologní antagonista/zabiják (Bak) a regulátor apoptózy rodiny Bcl-2 (Bok), je proapoptotická; druhá podskupina, zahrnující Bcl-2, Bcl-XL a Mcl-1, je anti-apoptotická. Mitochondriální dráhu částečně ovlivňují členové rodiny Bcl vázaní na mitochondriální membránu, včetně proapoptotických regulačních proteinů Bax i anti-apoptotických regulačních proteinů Bcl-2.
Proapoptotické molekuly způsobují permeabilizaci vnější mitochondriální membrány, což vede k vyplavení cytochromu c, který v cytosolu váže adaptor Apaf-1 a iniciátor kaspázu-9 a vytváří komplex apoptosomu. Ten stimuluje kaspázu-9, která následně aktivuje efektorové kaspázy. Mitochondrie také uvolňuje do cytosolu protein zvaný Smac/DIABLO. Smac/DIABLO nepřímo podporuje apoptózu tím, že blokuje účinky skupiny anti-apoptotických proteinů nazývaných inhibitory apoptózy (IAPs).
Anti-apoptotické proteiny Bcl-2 a Bcl-XL inhibují uvolňování cytochromu c, zatímco Bax, Bak a Bid, všechny pro-apoptotické proteiny, podporují jeho uvolňování z mitochondrií. Cytochrom c a deoxyadenosintrifosfát (dATP) se vážou na APAF-1 a vytvářejí multimerní komplex, který rekrutuje a aktivuje prokaspázu-9, apoptózu zprostředkující proteázu, která následně aktivuje kaskádu kaspáz, což vede k apoptóze buňky. Během tohoto procesu se na iniciaci apoptózy podílejí kaspáza-2, kaspáza-8, kaspáza-9 a kaspáza-10. Kaspáza-3, kaspáza-6 a kaspáza-7 se podílejí na apoptóze. Kaspáza-3 a kaspáza-7 regulují inhibici oprav DNA a zahajují degradaci DNA. Kaspáza-6 navíc reguluje rozpad lamel a cytoskeletu.
Vnitřní cesta apoptózy v patofyziologii
Většina chemoterapeutických a cílených protinádorových terapií zabíjí nádorové buňky prostřednictvím generování prosmrtné signalizace, která iniciuje vnitřní apoptotickou cestu programované buněčné smrti. Bodem, odkud není návratu v apoptotické kaskádě, je permeabilizace vnější mitochondriální membrány (MOMP); jakmile k ní dojde, vede permeabilizace mitochondrií k vytvoření apoptosomu, který usnadňuje aktivaci kaspáz a následně spouští další charakteristické znaky apoptotické buněčné smrti. Buněčné rozhodnutí o zahájení MOMP je řízeno křehkou rovnováhou mezi pro- a anti-apoptotickými molekulami rodiny BCL-2.
Jedním z důvodů rezistence na chemoterapii je neschopnost nádorových buněk přejít do apoptózy v důsledku defektů ve vnitřní apoptotické dráze (např. změny v p53). Navzdory výraznému zlepšení léčby zůstává míra vyléčení mnoha nádorových onemocnění suboptimální. Rozvoj cytotoxické chemoterapie vedl ke kurativní léčbě části nádorů, ačkoli vnitřní rezistenci k léčbě je u jednotlivých pacientů obtížné předvídat. Vlna molekulárně cílené léčby se zaměřila na mutace aktivující lékové štíty, a je tak omezena na specifické podskupiny pacientů. Vnitřní mitochondriální dráha apoptózy představuje jeden ze slibných cílů pro nové terapie a úspěšné zacílení na tuto dráhu má potenciál změnit terapeutické prostředí léčby různých druhů rakoviny.