Imunitní systém
Imunitní systém se skládá z tkání, buněk a molekul, jejichž hlavní funkcí je detekce, reakce a likvidace patogenů a transformovaných buněk.
Vrozená a adaptivní imunitní odpověď
Existují dvě hlavní složky imunitního systému – 1) vrozený imunitní systém a 2) adaptivní imunitní systém. Vrozený imunitní systém funguje jako první linie obrany a detekuje patogeny prostřednictvím receptorů pro rozpoznávání vzorů zakódovaných v zárodečné linii, nevytváří si paměť a reaguje rychle (během minut až hodin). Adaptivní imunitní systém reaguje pomalu (v průběhu několika dní), využívá antigenně specifické receptory, které během vývoje procházejí mnohonásobnou přestavbou genů, a vytváří si imunologickou paměť – „učí se“ z prvotního útoku a připravuje tělo na boj s budoucím vystavením podobnému škodlivému materiálu. Oba typy imunitních reakcí mohou být poháněny buď makromolekulami v extracelulární tekutině, nebo aktivací specifických imunitních buněk. Tyto reakce se označují jako humorální imunita a buněčná imunita.
Pod hlavičkou buněčně zprostředkované imunitní odpovědi se imunitní buňky většinou rozvrstvují podle toho, zda je odpověď vrozená nebo adaptivní. Vrozený imunitní systém se skládá především z fagocytujících buněk, jako jsou neutrofily, makrofágy, přirozené zabíječské buňky, bazofily a další, které se zaměřují na nebezpečné napadající organismy. Buňky adaptivního imunitního systému jsou T-lymfocyty a B-lymfocyty. Přirozené zabíječské (NK) T buňky mají vlastnosti jak vrozených, tak adaptivních imunitních buněk. Kromě toho může většina ostatních typů buněk, které nejsou specifické pro imunitní systém, v sobě skrývat vrozené imunitní funkce v podobě cytoplazmatických receptorů a signálních a efektorových molekul, jako jsou členové rodin RIG-I, STING a NLR. Jak dále uvedeme, buňky obou systémů vznikají z různých myeloidních a lymfoidních linií hematopoetických kmenových buněk.
Složky imunitního systému
Zralé imunitní buňky se diferencují z tzv. hematopoetických kmenových buněk. Jedná se o pluripotentní nediferencované progenitorové buňky, které se nacházejí v kostní dřeni, periferní krvi a placentě. Tyto hematopoetické kmenové buňky se mohou diferencovat v běžné myeloidní progenitorové buňky nebo běžné lymfoidní progenitorové buňky.
Lymfoidní buňky
Běžné lymfoidní progenitorové buňky se mohou diferencovat do čtyř hlavních populací lymfocytů, které lze rozlišit podle exprese povrchových receptorů: T-lymfocyty, B-lymfocyty, přirozené zabíječské buňky (NK) a NK-T-lymfocyty.
T buňky
T buňky hrají klíčovou roli v imunitě zprostředkované buňkami. Tyto buňky jsou identifikovány podle exprese signálních řetězců CD3 T buněk.
T buňky vznikají z lymfoidních progenitorových buněk, které se původně vyvinuly z hematopoetických kmenových buněk v kostní dřeni. Jakmile se lymfoidní progenitor odhodlá stát se T buňkou, migruje z kostní dřeně do brzlíku (odtud název T buňka). Brzlík poskytuje vhodné mikroprostředí, kde se T-lymfocyty mohou vyvíjet do různých podtypů definovaných specifickými receptory exprimovanými na povrchu buněk. Dozrávající T-buňky v raných stadiích neboli thymocyty postrádají receptory pro CD4 i CD8, a proto se nazývají dvojitě negativní (DN) buňky. DN buňky pak procházejí genetickou přestavbou a mutacemi genů kódujících alfa a beta T buněčné receptory (TCR), čímž se vydávají na cestu liniového zapojení, jehož konečným výsledkem je T buněčný receptor se specifickou afinitou k jedinečnému antigenu.
Thymocyty jsou poté selektovány, a to jak pozitivně, tak negativně, aby bylo zajištěno, že rozpoznají „cizí“ antigeny, ale nikoli hostitelské antigeny, které jsou prezentovány jako peptidy prostřednictvím MHC na povrchu buňky. Pouze buňky, které projdou oběma testy, pak budou aktivovány k expresi CD4 a CD8, čímž se stanou dvojitě pozitivními buňkami. Na konci zrání budou T-buňky exprimovat buď CD4, nebo CD8 (a ztratí expresi druhého), a stanou se tak buňkami s jednou expresí. Tyto zralé CD4 nebo CD8 pozitivní T-lymfocyty jsou poté uvolněny do krevního oběhu a zpočátku se nacházejí v naivním stavu, což znamená, že ještě nejsou vázány na určitý podtyp T-lymfocytů.
Pokud zrající thymocyt během zrání vykazuje střední míru afinity k vlastním peptidům MHC, pak může být vybrán, aby se stal regulační T-buňkou (Treg) pro svou schopnost rozpoznávat škodlivé „vlastní“ antigeny. T-lymfocyty v krvi nebo v periferních tkáních mohou být také lokálně indukovány, aby se staly Treg. Hlavním úkolem Tregs je udržovat toleranci vůči sebe-antigenům a také omezovat funkci a proliferaci T-efektorových buněk.
Po příchodu do krve nebo periferní tkáně lze naivní T buňky indukovat, aby se staly pomocnými T buňkami. Antigen prezentující buňky (APC), jako jsou makrofágy, dendritické buňky a B buňky, ukáží T buňce antigen, a pokud má její receptor afinitu, T buňka antigen rozpozná. Typicky jsou T-buňky CD4+ vhodné k rozpoznávání peptidových antigenů vázaných na proteiny MHC II. třídy. Jakmile je komplex peptid-MHC rozpoznán, T buňka aktivuje řadu vnitřních drah, které umožňují ověření rozpoznání antigenu. Teprve poté dojde k proliferaci pomocné buňky T, čímž se rozšíří zásoba dostupných buněk, které jsou specifické pro škodlivý antigen, jako jsou různé bakterie a paraziti.
Jakmile T-helper buňky rozpoznají svůj antigen a aktivují se, uvolní různé cytokiny, což jsou molekuly, které signalizují ostatním imunitním buňkám, jak mají na škodlivou molekulu vhodně reagovat. Existuje několik podskupin pomocných T-buněk včetně Th1, Th2 a Th17. Tyto podskupiny produkují a vylučují odlišné cytokiny, které pomáhají přizpůsobit imunitní odpověď v závislosti na typu patogenu. Například buňky Th1 spoléhají na efektorový cytokin IFN-γ, který signalizuje makrofágům, aby škodlivý materiál strávily a zničily, zatímco buňky Th2 vylučují kombinaci IL-4, IL-5, IL-9, IL-10 a IL-13, aby spustily útok bazofilů, eozinofilů a dalších buněk na infekci. Konkrétní množství a odrůdy cytokinů určí vhodnou odpověď na infekci nebo škodlivou buňku. T-lymfocyty mohou také reagovat na vlastní buňky tím, že se stanou cytotoxickými T-lymfocyty (nebo přirozenými zabíječskými T-lymfocyty). Obvykle se jedná o buňky CD8+, které rozpoznávají buňky infikované virem nebo nádorové buňky. O přirozených zabíječských T lymfocytech (NKT) bude podrobněji pojednáno v některém z dalších oddílů. Tyto a další typy T lymfocytů plní své různé povinnosti nebo efektorové funkce různými způsoby, aby rozpoznaly škodlivý materiál a získaly další imunitní buňky k jeho zničení, a také aby vytvořily trvalou imunitní odpověď na stejný typ inzultu.
Interaktivní signální dráha T buněčných receptorů je podrobně rozebrána zde.
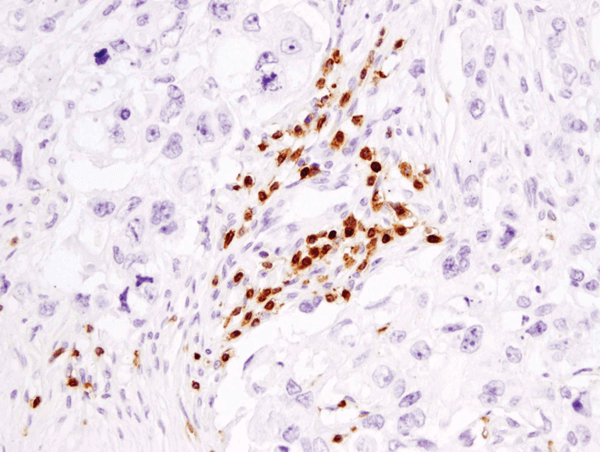
CD3ε (D7A6E™) XP® Rabbit mAb #85061: IHC analýza parafinového lidského karcinomu prsu s použitím #85061.
CD3ε (D7A6E™) XP® Rabbit mAb #85061: IHC analýza parafinového lidského karcinomu prsu s použitím #85061.
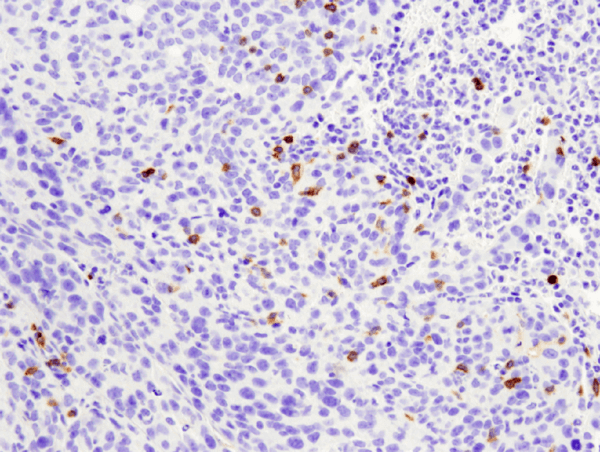
CD4 (D7D2Z) Rabbit mAb #25229: IHC analýza parafinově zalitého metastatického nádoru 4T1 v myších plicích s použitím #25229.
CD4 (D7D2Z) Rabbit mAb #25229: IHC analýza parafinového metastatického nádoru 4T1 v myších plicích s použitím #25229.
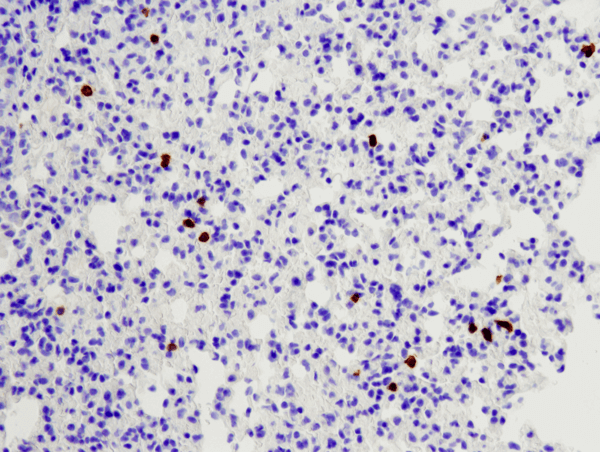
CD8α (D4W2Z) XP® Rabbit mAb (Mouse Specific) #98941: IHC analýza myší plíce zalité v parafinu s použitím #98941.
CD8α (D4W2Z) XP® Rabbit mAb (Mouse Specific) #98941: IHC analýza myší plíce zalité v parafinu s použitím #98941.
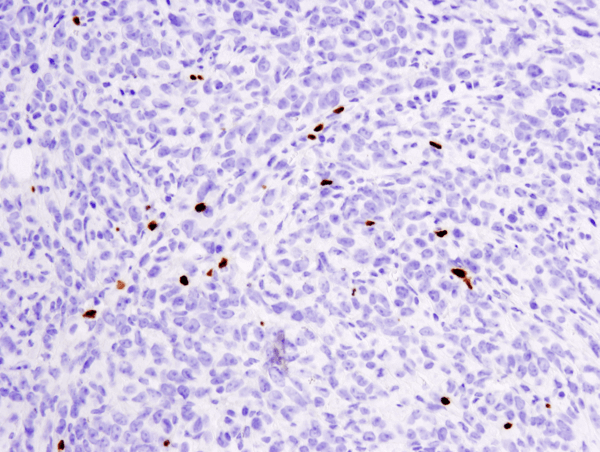
FoxP3 (D6O8R) Rabbit mAb #12653: IHC analýza metastatického nádoru 4T1 v myších plicích zalitého v parafinu s použitím #12653.
FoxP3 (D6O8R) Rabbit mAb #12653: IHC analýza parafinového metastatického nádoru 4T1 v myších plicích s použitím #12653.
B buňky
B buňky jsou rozhodující buňky v krvi, které zprostředkovávají tvorbu protilátek. Když se v krevním řečišti objeví škodlivý materiál, je specifickými receptory na buňkách B rozpoznán jako antigen. Poté po zpracování antigenu a za pomoci T-buněk dozrávají B-buňky v plazmatické buňky, které vylučují protilátky. B buňky mohou také hrát roli při prezentaci antigenů a sekreci cytokinů. Bude probrán vývoj i různé funkce B buněk.
15 % leukocytů nalezených v periferní krvi tvoří B buňky. Buňky B produkují imunoglobuliny (Ig), což jsou bílkoviny vázající antigen (známé také jako protilátky), které se skládají ze dvou identických těžkých a dvou identických lehkých řetězců. Tyto imunoglobuliny obsahují specifická nabídková místa pro antigen, která se v jednotlivých molekulách protilátek liší v sekvenci aminokyselin. Tato místa propůjčují každé protilátce specifičnost pro rozpoznání odlišného antigenu.
Jak bylo uvedeno výše, B-buňky se diferencují z krvetvorných buněk nacházejících se v kostní dřeni. Právě v kostní dřeni dochází k sestavování povrchových Ig receptorů (protilátek) procesem přestavby genů. B buňky využívají somatické spojení různých genů na mnoha chromozomech, které kódují různé části těžkých a lehkých řetězců tvořících Ig. B buňky jsou tlačeny k diferenciaci prostřednictvím produkce IL-7 stromálními buňkami kostní dřeně. Tyto vyvíjející se B buňky se řídí programem postupného přeskupování těžkých a lehkých řetězců, které je zprostředkováno rozdílnou expresí receptorů na povrchu buněk. Například expresi specifického pre-B buněčného receptoru brání určité přestavby genů na nepříbuzných chromozomech, aby bylo zajištěno, že zralá B buňka může exprimovat určitý povrchový receptor Ig schopný specificky rozpoznávat jeden antigen. Tento proces se nazývá alelická exkluze. Nesprávné sestavení těžkých a lehkých řetězců Ig může vyvolat sekundární přeskupení pro úpravu receptoru.
Kromě exprese Ig receptoru na povrchu buňky obsahují B buňky také transmembránové proteiny, které mohou vyvolat intracelulární signály poté, co se antigen naváže na extracelulární část Ig receptoru. B buňky používají podobné intracelulární signální kaskády jako T buňky, které vyvolávají transkripční změny vedoucí k proliferaci a zrání. Konkrétně mohou být intracelulární domény Ig receptoru fosforylovány src-rodinou kináz, čímž je zahájena kaskáda, která je předávána tyrozinkinázou Syk a linkerovým proteinem známým jako BLINK fosfolipáze C a guaninovým výměnným faktorům, což nakonec aktivuje proteinkinázu C, mobilizuje vápník a aktivuje MAP kinázu způsobem závislým na Ras/Rac.
Jedinečnou vlastností B buněk je jejich schopnost podstupovat izotypové přepínání. To se konkrétně týká procesu přeskupení DNA, při kterém mohou vznikat mírně odlišné těžké řetězce. Alternativní sestřih exonů těžkého řetězce může navíc umožnit, aby Ig zůstal vázán na buněčný povrch nebo aby se stal vylučovaným, pokud je transmembránový exon vystřižen. Alternativní sestřih a přepínání izotypu jsou indukovány cytokiny odvozenými od T buněk. Kromě toho mohou buňky T indukovat somatické mutace, které vedou ke změnám v antigenně vázaných místech Ig buněk B. Samoopravná funkce B buněk může zjistit, zda tyto zdánlivě náhodné mutace vedou ke ztrátě afinity k antigenu a spustit program buněčné smrti. Antigeny, které aktivují T-lymfocyty i B-lymfocyty, tedy spouštějí dozrávání B-lymfocytů zprostředkované T-lymfocyty prostřednictvím izotypového přepínání a somatických mutací, které jsou vysoce spojeny s pamětí B-lymfocytů.
Paměťové odpovědi jsou charakterizovány rychlou a rozsáhlou produkcí Ig s vysokou afinitou k takovým antigenům. Vývoj těchto paměťových odpovědí je rozhodující pro úspěch očkování. Mohou však také zvyšovat autoimunitu a alergické reakce.
Může také dojít k aktivaci B buněk antigenem nezávisle na T buňkách; tento typ aktivace je však spojen se slabou imunitní pamětí. Navíc tyto antigeny musí být polymerní, aby mohly aktivovat B buňky.
Poznámka: Cytokiny neboli interleukiny (IL) jsou vylučované molekuly, které působí na transmembránové receptory na povrchu buněk. Po navázání tyto cytokiny aktivují intracelulární signální transdukční dráhy obvykle závislé na signalizaci Jak-STAT.
Interakční signální dráha B buněčných receptorů je podrobně rozebrána zde.
CD19 (D4V4B) XP® Rabbit mAb #90176: IHC analýza parafinového lidského karcinomu plic s použitím #90176.
CD19 (D4V4B) XP® Rabbit mAb #90176: IHC analýza parafinového lidského karcinomu plic s použitím #90176.
NK buňky
Přirozené zabíječské buňky neboli NK buňky jsou dalším typem buněk odvozených z lymfoidní linie. Podobně jako B buňky se vyvíjejí v kostní dřeni v závislosti na cytokinech a stromálních buňkách kostní dřeně. Představují malou část periferní krve a nemají antigenně specifické receptory. Místo toho se NK buňky spoléhají na komplexní soubor transmembránových receptorů. Obsahují zejména inhibiční receptory na povrchu buněk, které rozpoznávají molekuly HLA I. třídy, a proto jsou inhibovány vlastními molekulami MHC a zabíjejí pouze buňky, které mají sníženou expresi HLA I. třídy. Proto slouží k důležitému účelu, kterým je cílení na buňky infikované viry a nádorové buňky, jejichž exprese HLA třídy I je snížena, aby se vyhnuly smrti buňkami CD8+ přirozených zabíječů T (NK-T). NK buňky mohou být také aktivovány způsobem závislým na protilátkách, interferonu nebo cytokinech, a proto mohou hrát velkou roli v boji proti nádorům. Mechanismus účinku NK buněk spočívá v uvolňování malých granulí obsahujících granzymy a perforin z jejich cytoplazmy. Po jejich uvolnění mohou tyto proteiny vytvářet póry a rozkládat intracelulární proteiny s cílem vyvolat apoptózu. Proto se o buňkách NK říká, že jsou cytotoxické.
NK-T buňky jsou zvláštním podtypem T buněk, které exprimují určité receptory a markery typické pro NK buňky v kombinaci s omezeným repertoárem T buněčných receptorů. Proto tento jedinečný podtyp sdílí vlastnosti jak T-buněk, tak NK-buněk. Na rozdíl od NK buněk, které se vyvíjejí v kostní dřeni, se NK-T buňky vyvíjejí v brzlíku.
Myeloidní buňky
Běžné myeloidní progenitorové buňky, které jsou potomky hematopoetických kmenových buněk, dávají vznik několika různým typům myeloidních buněk, včetně makrofágů, dendritických buněk a několika dalších buněk vrozené imunity a krevních buněk.
Makrofágy
Makrofágy mohou být spuštěny, aby rozpoznaly antigeny, například poškozené buňky nebo cizí materiál, a na požádání je zničily. Makrofágy jsou přítomny ve většině tkání a v případě potřeby reagují na infekce a odumírající buňky. Rozpoznaný materiál je v makrofágu zničen fagocytózou, podle které dostaly buňky svůj název („velký požírač“ v řečtině). Makrofágy nabývají různých podob, pokud jsou přítomny na různých místech, a kromě fagocytózy mohou plnit i další funkce.
Při poranění tkáně nebo infekci patogenem se monocyty v krvi rekrutují do postižené tkáně a diferencují se na makrofágy. V závislosti na lokalizaci tkáně existují různé typy makrofágů, například Kupfferovy buňky v játrech, alveolární makrofágy v plicích, mikroglie v mozku atd. Všechny tyto různé typy makrofágů pocházejí z monocytů, ale specializují svou funkci na rezidentní tkáň. Většinu obecné funkce fagocytózy vykonávají makrofágy rezidentní tkáně. Kromě fagocytózy odumřelých buněk a cizorodého materiálu mohou makrofágy také signalizovat ostatním imunitním buňkám prostřednictvím cytokinů. Makrofágy do jisté míry plní kritickou funkci prezentace antigenu, a proto spolupracují s T-lymfocyty na podpoře adaptivní imunity. Kromě toho mohou makrofágy vylučovat cytokiny, jako je IL-12, a hrát roli v lokálních imunitních reakcích, zatímco jiné vylučují vysoké množství IL-10, který zprostředkovává jejich roli při obnově tkání. Kromě hlavního úkolu fagocytózy tedy hrají „velcí požírači“ v imunitním systému celou řadu rolí.
CD68 (D4B9C) XP® Rabbit mAb #76437: IHC analýza lidského serózního papilárního karcinomu vaječníku zalitého v parafinu s použitím #76437.
CD68 (D4B9C) XP® Rabbit mAb #76437: IHC analýza lidského serózního papilárního karcinomu vaječníku v parafinu s použitím #76437.
CD163 (D6U1J) Rabbit mAb #93498: IHC analýza lidského nemalobuněčného karcinomu plic zalitého v parafinu s použitím #93498 provedená na přístroji Leica® Bond™ Rx.
CD163 (D6U1J) Rabbit mAb #93498: IHC analýza parafinového lidského nemalobuněčného karcinomu plic s použitím #93498 provedená na přístroji Leica® Bond™ Rx.
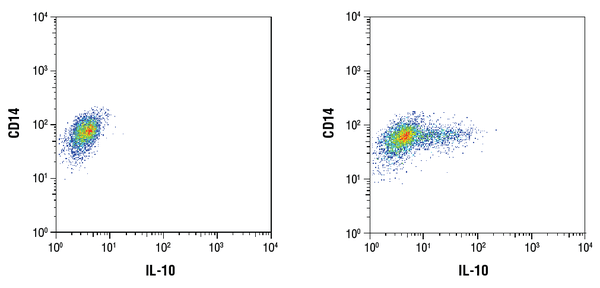
IL-10 (D13A11) XP® Rabbit mAb #12163: Průtoková cytometrická analýza purifikovaných CD14+ lidských mononukleárních buněk periferní krve neošetřených (vlevo) nebo ošetřených LPS (100 ng/ml, 16 h; vpravo) pomocí protilátky CD14 a #12163. K neošetřeným a ošetřeným buňkám byl po 1 hodině stimulace LPS přidán brefeldin A #9972 (300ng/ml). Jako sekundární protilátka byla použita protilátka proti králičímu IgG (H+L), F(ab‘)2 Fragment (konjugát Alexa Fluor® 647) #4414.
IL-10 (D13A11) XP® Rabbit mAb #12163: Průtoková cytometrická analýza purifikovaných CD14+ lidských mononukleárních buněk periferní krve neošetřených (vlevo) nebo ošetřených LPS (100 ng/ml, 16 h; vpravo) pomocí protilátky CD14 a #12163. K neošetřeným a ošetřeným buňkám byl po 1 hodině stimulace LPS přidán brefeldin A #9972 (300ng/ml). Jako sekundární protilátka byla použita protilátka proti králičímu IgG (H+L), F(ab‘)2 Fragment (konjugát Alexa Fluor® 647) #4414.
Dendritické buňky
Podobně jako makrofágy mají dendritické buňky schopnost pohlcovat buněčný a cizorodý materiál, ale místo aby jej trávily za účelem odstranění, dendritické buňky materiál zpracovávají a předkládají jej jako antigeny T-lymfocytům. Dendritické buňky tak slouží jako antigen prezentující buňky nebo akcesorní buňky, a předávají tak informace o patogenech mezi vrozeným a adaptivním imunitním systémem. Dendritické buňky dostaly svůj název podle svých výrazných buněčných výběžků, které se natahují a zachycují škodlivý materiál, který mají strávit.
Původně nezralé dendritické buňky, které vznikají z progenitorů hematopoetické kostní dřeně, procházejí fází „učení“, kdy odebírají vzorky cizorodého materiálu ve svém okolí a zahajují rozpoznávací reakci prostřednictvím receptorů pro rozpoznávání vzorů (jednou z běžných sad těchto receptorů jsou toll-like receptory). Tyto nezralé dendritické buňky se mohou nacházet na různých místech s přístupem do vnějšího prostředí, jako je sliznice nosu, žaludku, plic, a dokonce i v kůži. Po rozpoznání antigenu dendritické buňky migrují do lymfatické uzliny, kde vycvičí T-lymfocyty k rozpoznání antigenu a odpovídající reakci. Dendritické buňky jsou jediné antigen prezentující buňky, které aktivují jak paměťové, tak naivní T buňky. Receptory podobné Toll jsou dobře prozkoumanou třídou receptorů přítomných na makrofázích a dendritických buňkách, které zprostředkovávají rozpoznání a odpověď na cizorodé patogeny. Kromě přímé interakce s T-lymfocyty mohou dendritické buňky signalizovat také prostřednictvím cytokinů, jako je IL-12, který působí jako příprava imunitního systému na následný útok na škodlivý materiál. Jiné typy dendritických buněk mohou vylučovat cytokiny, které signalizují nábor dalších makrofágů k vyčištění přetíženého odpadního materiálu. Jako hlavní buněční mediátoři prezentace antigenu tak hrají dendritické buňky nezastupitelnou roli při vzájemném ovlivňování vrozeného a adaptivního imunitního systému.
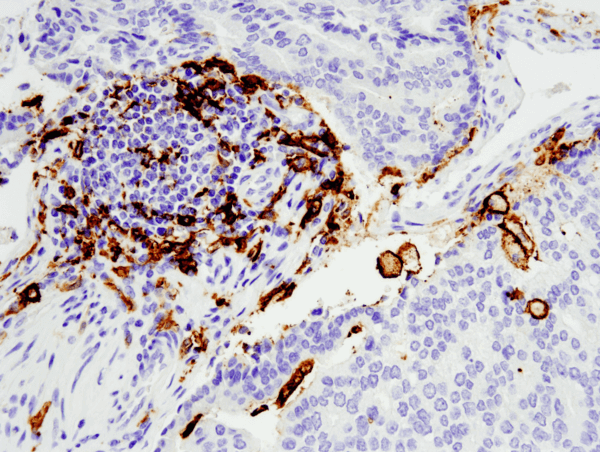
CD11c (D3V1E) XP® Rabbit mAb #45581: IHC analýza lidského adenokarcinomu prostaty zalitého v parafinu s použitím #455812 provedená na přístroji Leica® Bond™ Rx.
CD11c (D3V1E) XP® Rabbit mAb #45581: IHC analýza parafinového adenokarcinomu lidské prostaty s použitím #455812 provedená na přístroji Leica® Bond™ Rx.
Další buňky vrozeného imunitního systému a signalizace
Mezi další buňky vrozeného imunitního systému patří žírné buňky, které fungují při hojení ran a pomáhají zajišťovat ochranu před patogeny. Po spuštění patogenem mohou žírné buňky vylučovat cytokiny a také granula obsahující histamin a heparin, které zprostředkovávají další imunitní odpověď, jako je nábor makrofágů a rozšíření cév. Neutrofily, eosinofily a bazofily se díky charakteristickým granulím v jejich cytoplazmě souhrnně označují jako granulocyty. U neutrofilů působí granula tak, že uvolňují toxické sloučeniny, které se zaměřují na patogeny, jako jsou plísně a bakterie.
Imunologie ve zdraví a nemoci
Imunologie rakoviny
Využití imunitních buněk v boji proti rakovině se díky úspěchům v klinice stalo velmi aktuálním tématem výzkumu. Současná imunoterapie se v poslední době zaměřuje na cílení na signalizační kontrolní proteiny, jako je PD-1, které za normálních okolností brání aktivaci a odpovědi T-buněk. Dalším zajímavým přístupem je adoptivní buněčná terapie, která zahrnuje imunoeditaci T buněk odebraných pacientovi. T-buňky jsou upraveny tak, aby exprimovaly specifický chimérický antigenní receptor, který je specifický pro nádorové buňky pacienta. T-lymfocyty jsou poté znovu podány pacientovi a jsou nyní naprogramovány tak, aby vyhledávaly rakovinné buňky a zabíjely je v souladu s normální funkcí T-lymfocytů. Tyto a další přístupy k manipulaci s imunitním systémem tak, aby napadal škodlivé rakovinné buňky pacienta, představují průlomovou skupinu terapií pro léčbu rakoviny.