Pokud je vodík kovalentně vázán na vysoce elektronegativní atom, jako je fluor, chlor, kyslík nebo dusík, má atom H částečný kladný náboj, psáno Hδ+.
Hδ+ je fyzikálně velmi malý, takže hustota náboje na něm je neobvykle vysoká.
Představte si, že se k Hδ+ přiblíží jiný záporný nebo elektronegativní atom, řekněme na jiné molekule; dojde k vzájemnému přitahování, což má za následek obzvláště silnou dipólovou přitažlivost.Tato přitažlivost se nazývá vodíková vazba.
Vodíkové vazby jsou obecně slabší než iontové a kovalentní vazby, ale jsou silnější než van der Waalsovy síly.

Vodíková vazba ve vodě
Nejznámějším příkladem vodíkové vazby je voda:
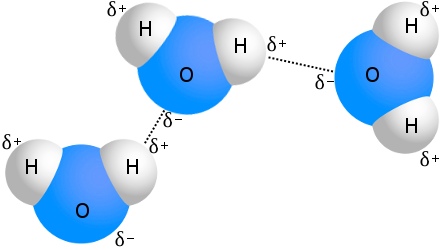
Každá molekula vody může být vodíkově vázána až na čtyři další molekuly vody.Ve vodě při pokojové teplotě je průměrný počet vodíkových vazeb na jednu molekulu vody 3,6.
Náhodný tepelný pohyb molekul zajišťuje, že doba života každé jednotlivé vodíkové vazby ve vodě je krátká, v průměru pouze 10 pikosekund.Doba vzniku nové vazby je však ještě kratší.
K trvalému přerušení jedné vodíkové vazby ve vodě je zapotřebí 21 kJ mol-1, což je značný příkon energie. výsledkem je, že teploty tání a varu vody jsou mnohem vyšší, než by se pro tak nízkou molekulovou hmotnost očekávalo.
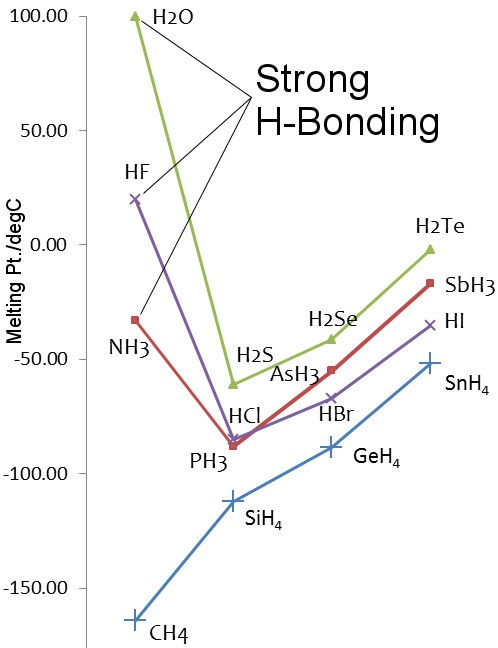
Podívejte se na srovnání vody a metanu. molekuly vody jsou k sobě poměrně silně přitahovány vodíkovou vazbou, zatímco u metanu převládají van der Waalsovy síly. ačkoli jsou tedy jejich molekulové hmotnosti podobné, 18 u vody a 16 u metanu, jejich fyzikální vlastnosti jsou velmi odlišné.Například voda taje při 0,00 °C a vaří při 99,98 °C; metan taje při -182,5 °C a vaří při -161,5 °C.
Vodíková vazba ve vodě vs. sirovodík
Síra je v periodické tabulce ve skupině 16, stejně jako kyslík. Síra je těžší než kyslík, takžeH2S by měl mít vyšší teplotu tání a varu než H2O. To však není pravda, protože síra je méně elektronegativní než kyslík, a proto je vodíková vazba v H2S slabá.

Mol. Hmotnost: 16
Pt tání: 0,00 °C
Pt varu: 99,98 °C
Elektronegativita O (Pauling): 3,44
entalpie vodíkové vazby: 21 kJ mol-1

Mol. Hmotnost: 34
Pt tání: -82 °C
Pt varu: -60 °C
Elektronegativita S (Pauling): 2.58
Entalpie vodíkové vazby: ≅ 3 kJ mol-1
Vodíková vazba v amoniaku a fluorovodíku
Fluor a dusík jsou elektronegativnější prvky ve svých skupinách periodické tabulky a vodíková vazba je pozorována ve fluorovodíku a amoniaku.
Stejně jako v případě vody jsou teploty tání a varu fluorovodíku a amoniaku vyšší než u hydridů těžších prvků v jejich skupinách.
Teploty tání hydridů prvků 14.-17. skupiny
Vodíková vazba v DNA
Bázové páry DNA spojují její dva šroubovicové řetězce. bázové páry nesou genetickou informaci DNA.
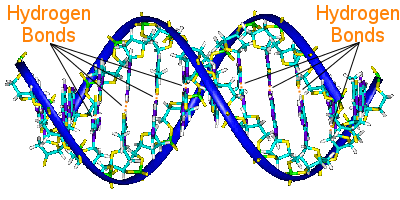
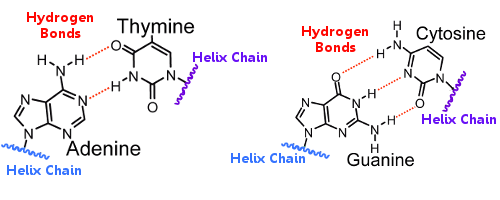
Bázové páry na jedné šroubovici jsou spojeny s bázovými páry na druhé šroubovici vodíkovými vazbami. vodíková vazba tak drží šroubovice pohromadě a vytváří známou dvojitou šroubovici.
Při replikaci DNA se vodíkové vazby přeruší, čímž se obě šroubovice oddělí. vodíková vazba tak hraje zásadní roli v mechanismu uzamčení bázových párů při replikaci DNA.
Vodíková vazba ve vlně
Stejně jako jiná proteinová vlákna se i vlna vyznačuje vodíkovou vazbou. obrázek níže ukazuje, jak vodíkové vazby (oranžové tečky) spojují závity řetězce α-helixu vlny (zelené).
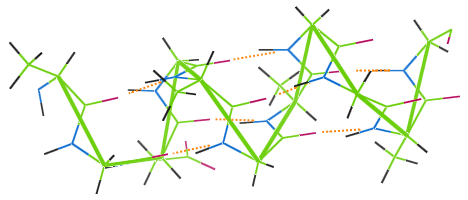
Pokud se vlněný oděv vypere při vysoké teplotě, vodíkové vazby se zničí, závity ztratí svou pružnost a oděv se zmačká.

.