„Minerál“ je anorganická látka, která se skládá z jednoho nebo více chemických prvků. Podle definice musí být minerál:
Chemické složení nerostu se nazývá jeho prvkové složení. Většina minerálů se vyskytuje jako sloučeniny (kombinace několika různých prvků). Některé minerály se však vyskytují jako samostatné chemické prvky. Ty jsou známé jako nativní minerály.
Co jsou to krystaly?
Krystaly jsou pevné látky, které mají uspořádanou krystalickou strukturu vytvořenou z atomů. Vnitřní uspořádání atomů často vede k vnějším rovinným plochám, jaké jsou vidět na krystalu křemene, to však není podmínkou pro to, aby byl klasifikován jako krystal. Krystaly lze klasifikovat jinak než minerály vzhledem k tomu, že některé materiály lze považovat za organické krystaly. Protože minerály jsou čistě anorganické, organický krystal nemůže být minerálem. Například bílkoviny a cukry jsou pevné látky, které mohou tvořit krystaly, avšak protože se jedná o organické látky, nelze je klasifikovat jako minerály.

Nečistoty v roztocích, které tvoří krystaly, mohou mít za následek změny barvy i významné změny krystalové struktury. Příliš mnoho nečistot v krystalové mřížce během krystalizace může vytvořit krystaly s malými až velkými inkluzemi. Tyto inkluze mohou také změnit tvar krystalu.
Minerály, krystaly nebo horniny?
Většina minerálů se v přírodě vyskytuje jako krystaly, avšak ne všechny krystaly jsou minerály, protože organické krystaly vůbec nejsou minerály. Minerál se stejným chemickým vzorcem může tvořit více než jeden typ krystalu. Například existují tři polymorfy (stejný chemický vzorec, různé krystalové struktury) uhličitanu vápenatého, které jsou známé jako kalcit, aragonit a vaterit. Krystaly kalcitu se vyskytují v trigonální soustavě, krystaly aragonitu patří do ortorhombické soustavy a krystaly vateritu se tvoří v hexagonální soustavě. Tyto krystalické struktury se mohou během vzniku měnit v důsledku několika faktorů, mezi které patří nečistoty brzdící růstové vzory, teplota prostředí během vzniku, nasycení minerálů v roztoku, geometrie kovalentních vazeb a změny v pohybu roztoku.
Minerály mají přirozeně vytvořenou uspořádanou atomovou strukturu se specifickým chemickým složením. Krystaly z větší části tyto vlastnosti sdílejí, avšak atomy jsou uspořádány do opakujícího se vzoru, jehož výsledkem je krystalová mřížka, často se prezentující krystalovými plochami.
Mnohdy uslyšíte, že lidé nazývají minerály nebo krystaly horninami, avšak „hornina“ je definována jako vázaný agregát minerálů, mineraloidů nebo úlomků jiných hornin. Slovo „vázaný“ znamená, že agregát minerálů musí být v jistém smyslu stmelený. Například písek není považován za horninu, přestože ve většině případů jsou zrna písku agregována dohromady. Například pískovec se stal horninou, protože zrna písku byla stmelena jemnozrnnějšími minerály a/nebo organickým materiálem a vytvořila relativně pevnou hmotu.
Tři hlavní klasifikace hornin jsou vyvřelé, metamorfované a sedimentární.
Igneózní horniny – horniny, které vznikly ochlazením a krystalizací magmatu v litosféře (zemské kůře) nebo nad ní. Krystaly vznikají uvnitř magmatu, když začne tuhnout, přičemž rychlost chladnutí může určovat velikost vznikajících krystalů.

A close up view of porphyritic granite, a type of igneous rock. Porfyrický granit vzniká při rychlé změně teploty chladnoucího magmatu. V tomto případě se při pomalém ochlazování mohly vytvořit velké krystaly, které byly přerušeny náhlou klesající změnou teploty, která urychlila proces krystalizace, což vedlo ke vzniku menších krystalů.
Sedimentární hornina – hornina, která vznikla v důsledku usazování erodovaného materiálu z dříve vzniklých hornin podél dna oceánů, koryt řek, jezer atd. spolu s usazováním minerálů z vody. V průběhu let se tyto usazeniny přírodními silami zhutňují a později tuhnou v pevnou hmotu (horninu).

Toto je sedimentární skalní útvar, který je součástí Zabriskie Point, nacházejícího se v Údolí smrti v Kalifornii. Je tvořena sedimenty z jezera Furnace Creek, které vyschlo zhruba před 5 miliony let. Miliony let eroze zanechaly vrstvy sedimentů obnažené.
Metamorfní hornina – hornina, která vznikla, když byly stávající sedimentární nebo vyvřelé horniny vystaveny tlakům a v některých případech i teplotním změnám, které změnily jejich původní mineralogii.

Metamorfovaná hornina známá jako „granitový gneiss“. Vznikla z metamorfované žuly.
Jak vznikají anorganické krystaly?
Krystaly mohou vznikat různými procesy, mezi něž patří:
Evaporitová ložiska – jedná se o minerální útvary, které vznikají v důsledku procesů na zemském povrchu. Krystaly vznikají z roztoků obsahujících minerály, které se koncentrují dehydratací/odpařováním vodného roztoku. Jak se kapalina pomalu odpařuje, koncentrované minerály se shromažďují a vysrážejí z vody ve strukturovaném vzoru, který se vyvíjí v krystal. Příkladem srážecích usazenin jsou růžové krystaly halitu z jezera Seamless Lake v kalifornském městě Trona.
Druhotná ložiska minerálů – Vznikají působením vody na primární rudy, usazováním z hydrotermálních roztoků nebo vznikají krystalizací magmatu.
- Působení vody na primární rudy – Voda, která se dostává k obnaženým rudám (obvykle v dutině) prosakováním dolů skrz horniny. Tím mohou začít chemické procesy, které rozkládají rudu a přerozdělují minerály podél otevřených stěn dutiny. Dobrým příkladem jsou azurit a malachit, kde se vodní roztoky pohybovaly oblastmi primární měděné rudy a přerozdělily je v podobě krystalů azuritu a malachitu, jejichž podmínky vzniku zahrnují vodu, uhličitany a měď.
- Hydrotermální fluidní ložisko – ve většině případů vzniká tak, že hydrotermální fluidy pronikají horninou směrem vzhůru a přitom zachycují minerály v okolní hornině. Pokud je těmto tekutinám předložena otevřená dutina, může dojít k vysrážení minerálů ve formě krystalů a/nebo pevné hmoty. Někdy mohou být minerály v okolní hornině nahrazeny, tento jev je znám jako náhradní ložisko.
- Krystalizace magmatu – nastává, když se magma ochladí a minerály v magmatu se začnou oddělovat do skupin podobných a kompatibilních minerálů. V závislosti na rychlosti chladnutí, složení a atmosféře se velikost krystalů může výrazně lišit. Někdy může chladnutí probíhat příliš rychle, což má za následek absenci prvkové struktury, příkladem je obsidián (sopečné sklo). Obsidián, který se primárně skládá ze SiO₂ (ve většině případů z křemene), má chemický vzorec s potenciálem být krystalem/minerálem, avšak absence krystalické struktury a proměnlivost složení vede k tomu, že je místo toho klasifikován jako mineraloid.

Mineraloid, obsidián.
Třídy minerálů
Chemické složení minerálu určuje, jak se bude vyskytovat v přírodě. Některé z běžných tříd minerálů podle jejich chemického složení jsou:
Nativní minerály – prvky, které se v přírodě vyskytují s odlišnou minerální strukturou a bez kombinace s jiným prvkem. Příklady prvků, které jsou známy jako nativní minerály, jsou zlato (Au), stříbro (Ag), síra (S), měď (Cu), grafit ((C) – volně vázaný uhlík) a diamanty ((C) – hustě vázaný uhlík – obvykle obsahuje některé nečistoty).

Hrubý přírodní diamant

Nativní stříbro

Nativní měď
Oxidy – Třída chemických sloučenin, v nichž se iont kyslíku (O2-) páruje s prvkem, v mnoha případech kladně nabitým kovem. Příklady: SiO₂ – křemen, Fe₂O₃ – hematit, Cu₂O – kuprit atd.
Karbonáty – Minerály vyznačující se přítomností uhličitanového iontu (CO₃2-). Obvykle se váže na kationty kovů, které ve většině případů tvoří nerozpustné sloučeniny (nelze je rozpustit ve vodě). Příklady: CaCO₃ – kalcit/Aragonit, FeCO₃ – siderit, ZnCO₃ – Smithsonit atd.
Silikáty – Minerály ze skupiny aniontů, které obsahují křemík (Si) i kyslík (O). Tyto soli tvoří hlavní složku hornin v celé litosféře (zemské kůře). Příklady silikátů: SiO₂ – křemen, AlKO₆Si₂ – křemičitan hlinito-draselný, (Fe,Mg)₂SiO₄ – olivín atd.
Sulfid (sulfid) – anorganický aniont síry, který se vyznačuje chemickým vzorcem S^2- a může zahrnovat reakce, které jsou považovány za poměrně složité. Srážení sulfidů může zahrnovat reakce s těžkými kovy, při nichž vznikají nerozpustné kovové sraženiny. Příklady těchto těžkých kovů, které vznikají ze sulfidických iontů, jsou FeS₂ – pyrit, CuFeS₂ – chalkopyrit, PbS – galenit atd.
Sulfáty (sírany) – soli, které vznikají při reakci kyseliny sírové (H₂SO₄) s jinou chemickou látkou. Příklady síranů: (Ba,Sr)SO₄ – baryt (Barite), CaSO₄- 2H₂O – sádrovec (Gypsum), SrSO₄ – celestin (Celestite) atd.
Fosforečnany – Minerály vyznačující se přítomností složeného aniontu (PO₄)^3-. většina z nich je v přírodě považována za poměrně vzácné. Příklady fosfátů: Ca5(PO₄)(OH,F,CL) – apatit, CuAl₆(PO₄)₄(OH)₈ – 4H₂O – tyrkys, Fe(II)3(PO4)₂- 8H2O – vivianit aj.
Ekonomika krystalů a nerostů
V moderní době platí, že aby se nerost ekonomicky vyplatilo těžit, musí existovat jako koncentrace užitečných nerostů, které lze zpracovávat (těžit) a přitom dosahovat zisku. Koncentrace musí být také dostatečně vysoká, aby se těžba vyplatila. Někdy může vyčerpání nerostu v dole vést k okamžitému uzavření dolu. Z tohoto důvodu může být těžba mimořádně riskantní záležitostí, co se týče ekonomiky.
Kovy jsou v současné době nejdůležitějšími ekonomickými nerosty, protože se používají pro širokou škálu moderních aplikací. Tyto kovy se získávají z kovonosných ložisek, která se skládají z rudy (hledaných minerálů) a ve většině případů z nežádoucích, méně ekonomických okolních minerálů známých jako „hlušina“.
Terminologie a ilustrace
Chemický prvek – Chemický prvek je látka, jejíž všechny atomy obsahují stejný počet protonů, tzv. atomové číslo. Periodická tabulka prvků je v jistém smyslu klíč, který sestavil ruský chemik Dimitrij Mendělejev, aby tyto atomy roztřídil do kategorií prvků podle počtu protonů. Například atom vodíku (H) obsahuje jeden proton, atom helia (He) obsahuje dva protony, atom lithia (Li) obsahuje tři protony a tak dále a tak dále.
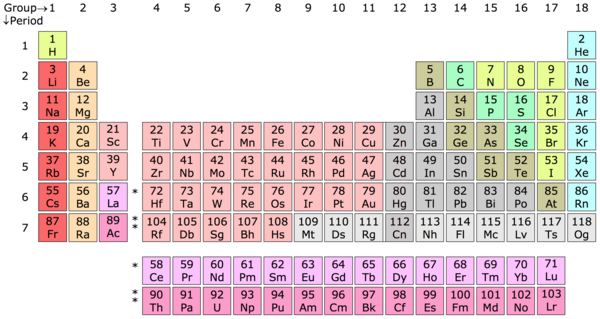
Periodická tabulka
Chemická sloučenina – Skládá se z molekul. Aby byla molekula považována za chemickou sloučeninu, musí být složena až ze dvou více různých chemických prvků, které jsou spolu vázány.
Atom – Nejmenší jednotka chemického prvku. Atom se skládá z protonu(ů), elektronu(ů) a neutronu(ů), které společně určují náboj atomu. Atomy mohou ztrácet nebo získávat elektrony, čímž vznikají kladné a záporné náboje označované jako ionty.
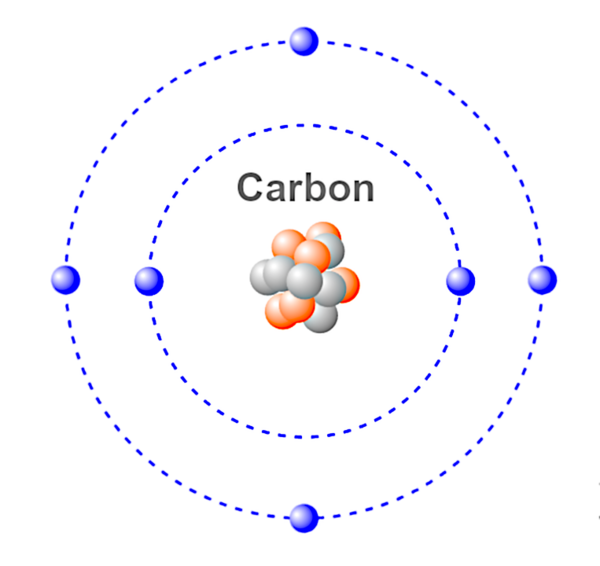
Toto je ilustrace atomu uhlíku.
Modrá – elektrony.
Červená &Šedá – Neutrony &Protony.
Ion – Atom nebo molekula s elektrickým nábojem, který vznikl ztrátou nebo ziskem jednoho nebo více elektronů.
Kationt – Kladně nabitý ion, který je přitahován záporně nabitými ionty. Příklad – vodíkový ion H+.
Anion – Záporně nabitý ion, který je přitahován kladně nabitými ionty. Příklad – Uhličitanový ion je CO₃2-.

Uhličitanový ion chemický vzorec.
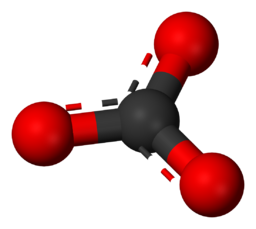
Tento obrázek znázorňuje molekulární strukturu uhličitanového iontu (CO₃2-) na atomové úrovni.
.