Manuscript accepted on :29 Aug 19
Published online on: 18-09-2019 Kontrola plagiátorství: Ano
Recenzováno:
Kontrola plagiátů provedena: Druhá recenze: Farooq Sher
Druhá recenze:: Grigorios Kyriakopoulos
Konečné schválení provedl: (Navštíveno 12 737krát, dnes 21 návštěv)
 , Manatchanok Yotchaisarn1, Worachot Saengha1, Piyachat Udomwong2, Sirirat Deeseenthum1 a Kedsukon Maneewan1
, Manatchanok Yotchaisarn1, Worachot Saengha1, Piyachat Udomwong2, Sirirat Deeseenthum1 a Kedsukon Maneewan1
1Natural Antioxidant Innovation Research Unit, Department of Biotechnology, Faculty of Technology, Mahasarakham University, Khamriang, Kantarawichai, Maha Sarakham, 44150, Thajsko.
2International College of Digital Innovation, Chiang Mai University, Chiang Mai 50200, Thajsko.
Zodpovídající autor E-mail: [email protected]
DOI : https://dx.doi.org/10.13005/bpj/1735
Abstrakt
Tato studie byla zaměřena na izolaci a identifikaci bakterií, které mohou produkovat enzym amylázu z neprobádaného lesa Nasinuan, okres Kantarawichai, provincie Mahasarakham, Thajsko. Pomocí sekvenování 16S rRNA bylo identifikováno třináct bakteriálních izolátů se schopností produkovat amylázu na 1% škrobovém agaru. Dvanáct bakterií bylo grampozitivních, tyčinkovitého tvaru a byly identifikovány jako Bacillus spp. a jedna bakterie s gramnegativním charakterem a tyčinkovitým tvarem byla Enterobacter cloacae. Jejich nejbližší příbuzní byli nalezeni v Indii, Číně, Koreji, Indonésii, Argentině, Itálii, Izraeli, USA, Argentině a Jižní Africe. Tyto bakterie byly testovány na specifickou amylázovou aktivitu po 1-3denní indukci enzymu 1% škrobem při 37 °C. Výsledky ukázaly nejvyšší specifickou aktivitu v pořadí 2. den inkubace: Bacillus cereus 3.5AL2 > 3.4AL1 > 1.4AL3, a proto byla pro další analýzu zvolena dvoudenní indukce enzymu. Bylo zjištěno, že Bacillus sp. 3.5AL2 vykazuje nejvyšší specifickou enzymovou aktivitu amylázy 1,97 ± 0,41 U/mg proteinu při optimálních podmínkách 60 °C a pH 7,0 po 30minutové inkubaci s 1 % škrobu v 0,05M PBS pufru. Tento bakteriální kmen produkující amylázu nabízí velký potenciál pro využití v potravinářském a zemědělském průmyslu v Thajsku.
Klíčová slova
Amyláza; bakterie; les Nasinuan; půda
Stáhnout tento článek jako: ![]()
Citujte tento článek:
Luang-In V, Yotchaisarn M, Saengha W, Udomwong P, Deeseenthum S, Maneewan K. Isolation and Identification of Amylase-producing Bacteria from Soil in Nasinuan Community Forest, Maha Sarakham, Thailand. Biomed Pharmacol J 2019;12(3).
Citovat toto URL:
Luang-In V, Yotchaisarn M, Saengha W, Udomwong P, Deeseenthum S, Maneewan K. Isolation and Identification of Amylase-producing Bacteria from Soil in Nasinuan Community Forest, Maha Sarakham, Thailand. Biomed Pharmacol J 2019;12(3). Dostupné z: http://biomedpharmajournal.org/?p=28497
Úvod
Skrobové hydrolytické amylázy (α-amyláza, β-amyláza a glukoamyláza) patří mezi nejpoužívanější enzymy v současných biotechnologiích. Glukoamylasy (1,4-α-D-glukan glukanohydrolasa; EC 3.2.1.3) nebo amyloglukosidasy jsou exoaktivní amylasy, které produkují glukosu z neredukujícího konce škrobu a odpovídajících oligosacharidů. Glukoamylasy se komerčně využívají k přeměně malto-oligosacharidů na glukosu1. Ačkoli se amylasy vyrábějí z různých zdrojů (mikroorganismů, rostlin a živočichů), amylasy z mikrobů jsou pro průmyslovou výrobu nejvhodnější díky krátké době růstu mikrobů, nízké nákladové efektivitě výroby, ekologickému chování, menším problémům s manipulací pro pracovníky, produktivitě2 a snadné manipulaci s bakteriálními geny3. Bakterie a houby mají tendenci vylučovat amylasy mimo buňky, aby mohly provádět mimobuněčné štěpení škrobu na cukry. Rostoucí průmyslová poptávka po mikrobiálních amylasách byla pozorována díky jejich specifičnosti reakce, mírným podmínkám nezbytným pro reakci a menší spotřebě energie než u konvenčních neenzymatických chemických metod.
Rozsáhlé použití amylas v potravinářství, zkapalňování škrobu, sacharizaci, pivovarnictví, výrobě detergentů, papíru, textilu a lihovarnictví přineslo větší pozornost pro zvýšení domácí produkce α-amylas4. Bacillus je běžným bakteriálním zdrojem pro průmyslovou výrobu amylázy. Různé kmeny však mají různé optimální podmínky růstu a profil produkce enzymů. K průmyslové výrobě α-amylázy se údajně hojně používají kmeny Bacillus, včetně B. amyloliquefaciens, B. subtilis5, B. licheniformis6, B. stearothermophilus7, B. megaterium8 a B. circulans9.
Dosud byla zdokumentována řada bakterií produkujících amylázu, nicméně nebyla zaznamenána žádná studie o bakteriích produkujících amylázu z půdy v Nasinuan Community Forest, Kantharawichai District, Mahasarakham Province, Thajsko. Zdá se, že tento les je bohatý na mikrobiální biodiverzitu, která může být užitečná při výrobě průmyslových enzymů včetně amylázy. Toto je první zpráva o identifikaci bakterií produkujících amylázu izolovaných z lesa Nasinuan. Tyto bakteriální amylázy mohou být v budoucnu lokálně využity v různých průmyslových odvětvích, včetně výroby celulózy a papíru, textilu, bioethanolu, pivovarnictví, zpracování potravin, krmiv a zemědělství v Thajsku.
Materiál a metody
Vzorky půdy
Vzorky půdy byly náhodně odebrány pod povrchem půdy v hloubce 15 cm a uchovávány v polystyrénových sáčcích z lesa Nasinuan Community Forest, okres Kantarawichai, provincie Mahasarakham, Thajsko (rozloha 9,5 ha).6 ha; souřadnice 16.340941, 103.210799).
Izolace bakterií produkujících amylázu
Půdní vzorek (10 g) byl suspendován v 90 ml sterilního 0,85% roztoku NaCl. Suspenze (100 µl) sériových ředění byly rozetřeny na škrobový agar (g/l); 3,0 hovězí extrakt, 10,0 rozpustný škrob, 15,0 agar pH 7,0 a inkubovány při 37 ºC po dobu 7 dnů. Poté byly destičky zaplaveny Gramovým jódem. Všechny kolonie s vytvořením jasné zóny kolem kolonií byly subkultivovány v tekutém bujónu a nejméně pětkrát protaženy, aby se získaly čisté izoláty, což bylo potvrzeno barvením podle Grama a pozorováním 1000x světelným mikroskopem. Čisté izoláty byly naočkovány na škrobový agar a inkubovány při 37 °C po dobu 7 dnů. Průměry čirých zón nad průměry kolonií byly měřeny pomocí pravítka jako poměr Halo : kolonie.
Sekvenování genu 16S rRNA a fylogenetická analýza
Čisté bakteriální izoláty byly identifikovány pomocí genomové DNA získané výše uvedenou metodou a univerzálních primerů: přímý primer 27F 5′-GAGAGTTTGATYCTGGCTCAG-3′ a reverzní primer 1492R 5’AAGGAGGTGATCCARCCGCA -3′. V 25 µl PCR směsi bylo 0,5 ng genomové DNA, 2X Master Mix (One PCR) 100 mM Tris-HCl (pH 9,1), 0,1 % TritonTMX-100, 200 mM dNTP, 1,5 mM MgCl2, 0,005 U Taq DNA Polymerase a 0,2 µM forward a reverse primer s úpravou objemu vodou bez nukleázy. PCR termocykler (Thermo Scientific Hybaid Px2) byl naprogramován takto: (1) počáteční denaturace po dobu 2 min při 94 ºC pro 1 cyklus; (2) denaturace při 94 ºC po dobu 45 s; žíhání při 54 ºC po dobu 45 s a extenze při 72 ºC po dobu 1 min pro 32 cyklů; (3) závěrečná extenze při 72 ºC po dobu 7 min. Vzorky byly uchovávány při 4 ºC až do další analýzy. Produkty PCR 16S rRNA (~ 1 500 bp) byly detekovány na 0,8% agarózovém gelu, přečištěny pomocí PCR product purification kitu (Vivantis, Malajsie), odeslány do First Base Co. Ltd. (Malajsie) k sekvenování DNA. Sekvence genu 16S rRNA byly poté porovnány s ostatními sekvencemi dostupnými v GenBank pomocí programu BLASTN (Basic Local Alignment Search Tools)10. Fylogenetický strom byl sestaven metodou Muscle pro zarovnání sekvencí a metodou maximální věrohodnosti pomocí programu MEGA X s 1000 opakováními bootstrapových hodnot11. Všechny dílčí sekvence 16S rRNA našich izolátů produkujících amylázu byly uloženy v databázi NCBI.
Stanovení aktivity enzymu amylázy
Metoda se řídila metodou Bhaskara et al. (2011)12 . Pro stanovení aktivity enzymu amylázy byly vybrány tři bakterie s nejvyšším poměrem Halo: Colony. Každý izolát byl subkultivován ve škrobovém tekutém bujónu (g/l): 10,0 rozpustného škrobu, 10,0 peptonu, 20,0 kvasnicového extraktu, 0,05 KH2PO4, 0,015 MnCl2.4H2O, 0,25 MgSO4.7H2O, 0,05 CaCl2.2H2O, 0,01 FeSO4.7H2O a inkubován při 37 ºC, 150 ot/min po dobu 1, 2 a 3 dnů. Čirý supernatant (surový enzym extracelulární amyláza) byl získán po odstředění při 10 000 g po dobu 15 min při 4 °C. Surový extrakt byl zahuštěn pomocí ultracentrifugového proteinového koncentrátoru MWCO 10 kDa (Vivaspin, Sartorius, UK).
K určení amylázové aktivity každého bakteriálního izolátu v jednotlivých dnech indukce enzymu byla použita metoda DNS13 . Jeden ml surového enzymu byl smíchán s 1 ml 1% roztoku škrobu v 1 ml 0,05 M fosforečnanového pufru sodného o pH 7,0. V tomto roztoku byl rozpuštěn 1 % škrob. Vzorky byly inkubovány při 37 °C po dobu 30 min. Po inkubaci bylo ke každému vzorku přidáno 0,5 ml roztoku DNS k zastavení reakce a poté se vařilo při 100 °C po dobu 5 min ve vodní lázni. Intenzita zbarvení roztoku byla pozorována měřením optické hustoty (OD) pomocí spektrofotometru při vlnové délce 575 nm. Údaj byl porovnán s připraveným slepým roztokem (bez surového enzymu). Hodnoty OD vzorků při T30min byly odečteny od hodnot vzorků při T0min, protože ve vzorcích při T0min zůstala glukóza i po procesu indukce enzymu po 1, 2 a 3 dnech. Proces byl proveden ve třech opakováních. Koncentrace glukózy vzniklé pro každý roztok byla získána ze standardní křivky glukózy. Byla vypočtena aktivita amylázy. Jedna jednotka amylasové aktivity je definována jako množství amylasy potřebné ke katalýze tvorby redukujícího cukru, které se za podmínek testu rovná 1 µmol glukosy za min.14
Pro další práci byl vybrán surový enzym bakteriálního izolátu, který měl nejvyšší aktivitu.
Pro stanovení specifické enzymové aktivity vybraných izolátů byla použita Folin-Lowryho metoda pro stanovení celkového proteinu15. Specifická enzymová aktivita byla měřena podle následujícího vzorce.
Specifická aktivita (U/mg) = enzymová aktivita (U/ml)/koncentrace extracelulárních bílkovin (mg/ml)
Optimální pH a teplota enzymové aktivity amylázy
Byly testovány roztoky rozpustného škrobu (1 %) o různém pH od 3 do 10. Roztoky škrobu (1 %) o různém pH a teplotě byly testovány v rozmezí od 3 do 10. Jeden ml různého 1% roztoku substrátu byl přidán spolu s 1 ml příslušných pufrů: 0,05 M citrátového pufru (pH 3 až 5), 0,05 M fosforečnanového pufru sodného (pH 6 a 7), 0,05 M Tris-HCl (pH 8 a 9) a 0,05 M glycin NaOH (pH 10). Do těchto pufrů byl rovněž přidán jeden ml surového enzymu. Vzorky byly inkubovány při 37 °C po dobu 30 min. Byla vypočtena specifická aktivita amylázy. Zaznamenalo se pH, při kterém byla pozorována nejvyšší aktivita. Podobně byly připraveny různé substrátové roztoky rozpuštěním 1% rozpustného škrobu v roztocích o pH 7,0. Jeden ml 1% rozpustného škrobu byl přidán spolu s 1 ml 0,05 M fosforečnanového pufru sodného (pH 7). K pufrům byl přidán také jeden ml surového enzymu. Vzorky byly inkubovány při teplotách 20, 30, 40, 50, 60, 70 a 80 °C po dobu 30 minut. Byla vypočtena specifická aktivita amylázy. Byla zaznamenána teplota, při které byla pozorována nejvyšší aktivita. Pro stanovení konečné specifické aktivity enzymu amylázy bylo použito optimální pH i teplota.
Statistická analýza
V programu SPSS Statistics Ver. 17.0 byla použita jednosměrná analýza rozptylu (One-way ANOVA) s Duncanovým vícenásobným testem. Výsledky byly vyjádřeny jako průměry ± SD se statistickým rozdílem při p < 0,05.
Výsledky
Izolace bakterií produkujících amylázu
V této studii vykazovalo 13 amyláza pozitivních izolátů jasné zóny na 1% škrobovém agaru s různým poměrem Halo : kolonie. Kolonie vykazující jasné zóny jodového roztoku byly považovány za pozitivní kolonie bakterií rozkládajících škrob. Všechny bakteriální izoláty vykazovaly podobnou morfologii kolonií a jevily se jako grampozitivní a tyčinkovité bakterie (tabulka 1). Výsledek ukázal poměr Halo : kolonie v rozmezí od 1,18 do 1,71 (tabulka 1). Bakteriální izoláty byly poté použity ke stanovení optimální doby indukce enzymu amylázy a pouze 3 izoláty s nejvyšší specifickou aktivitou byly uvedeny v kapitole 3.4.
Identifikace kmenů bakterií produkujících amylázu
Všech 13 amyláza-pozitivních bakteriálních kmenů bylo podrobeno sekvenování genu 16S rRNA pro identifikaci kmene. Výsledky BLAST ukázaly, že všechny amyláza-pozitivní izoláty patří do rodu Bacillus, s výjimkou jednoho izolátu patřícího do rodu Enterobacter (tabulka 2). Jejich nejbližší příbuzní byli nalezeni v Indii, Číně, Koreji, Indonésii, Argentině, Itálii, Izraeli, USA, Argentině a Jižní Africe s rozsahem identity 96-100 %.
Fylogenetická analýza
Fylogenetický strom 13 amyláza-pozitivních bakteriálních kmenů a 2 referenčních kmenů s předpokládanými enzymy amylázy pomocí programu MEGA 7.0 ukázal, že E. cloacae 2.1AL2 se evolučně liší od ostatních kmenů Bacillus (obr. 1). Referenční kmen B. thuringiensis serovar konkukian (přístupové číslo NCBI AB617494.1) se vyvíjel odlišně od našich bakterií rodu Bacillus. Další referenční kmen B. cereus ATCC 14579 (přístupové číslo NCBI MG708176.1) izolovaný z listu světlice barvířské, Eqypt však vykazoval podobný vývoj jako naše bakterie (obr. 1).
 |
Table 1: Characteristics and Halo : Colony ratios of 13 amylase-producing bacterial strains
Click here to View table |
Optimální doba indukce enzymu amylázy
Ukázalo se, že doba inkubace, která indukovala produkci amylázy s nejvyšší specifickou aktivitou, byla 2 – 3 dny u všech 3 izolátů bez statistických rozdílů. Zdá se, že Bacillus sp. 3.5AL2 produkoval nejvyšší specifickou aktivitu 0,91 ± 0,12 U/mg druhý den při 37 °C (tabulka 3). Tento kmen a tyto podmínky byly tedy použity pro indukci produkce amylázy pro další analýzu.
Optimální pH a teplota aktivity enzymu amylázy
Bacillus sp. 3.5AL2 vykazoval nejvyšší specifickou aktivitu při pH 7,0 při teplotě 37 °C a při teplotě 60 °C při pH 7,0 (obr. 2). Pro stanovení specifické amylázové aktivity byly tedy použity obě optimální podmínky a bylo získáno 1,97 ± 0,41 U/mg (tabulka 4).
Tabulka 2: Třináct amyláza-pozitivních bakteriálních kmenů identifikovaných analýzou 16S rRNA
| Izolát | Přírůstkové
číslo. a |
Nejbližší příbuznýb | Accesní č.c | % Identitad | Původní |
| 1.1AL1 | MK578206 | Bacillus pseudomycoides FJAT-hcl-17 | KY653098.1 | 99% | Host Paris polyphylla var. chinensis, Čína |
| 1.1AL2 | MK578207 | Bacillus sp. 188Cu-As | KM349197.1 | 99% | Biofilmy, Argentina |
| 1.2AL3 | MK578208 | Bacillus anthracis SAK4 | MG706137.1 | 100% | Půda, Korejská republika |
| 1.4AL1 | MK578209 | Bacillus sp. CNJ732 PL04 | DQ448749.1 | 99% | Morský sediment, USA |
| 1.4AL3 | MK578210 | Bacillus cereus B19 | MK229038.1 | 99% | Pšeničné zrno, Isarael |
| 2.1AL2 | MK578211 | Enterobacter cloacae HNXY160623 | KX431213.1 | 98% | Avian embryo, Čína |
| 2.3AL1 | MK578212 | Bacillus thuringiensis BD17-E12 | HF584771.1 | 99% | Kořenový systém révy vinné, Itálie |
| 2.3AL8 | MK578213 | Bacillus cereus DFT-1 | KY750685.1 | 98% | Mořská voda průmyslové oblasti, Indonésie |
| 2.3AL9 | MK578214 | Bacillus sp. PTP1 | KY910137.1 | 96% | Střevo moučného brouka papáji, Indie |
| 2.4AL2 | MK578215 | Bacillus pseudomycoides 74 | MH910178.1 | 99% | Indie |
| 3.2AL1 | MK578216 | Bacillus thuringiensis
IARI-IIWP-38 |
KF054891.1 | 99% | Pšenice oddenková, Indie |
| 3.4AL1 | MK578217 | Bacillus cereus F4a | MK088302.1 | 99% | Tea rhizosphere soil, India |
| 3.5AL2 | MK578218 | Bacillus cereus SP1-AB4 | MH013307.1 | 99% | Morská houba, Jižní Afrika |
aGenBank přístupové č. našich kmenů uložených na webových stránkách NCBI (http://www.ncbi.nlm.nih.gov/pubmed)
bNejbližší druh s nejvyšším % identity a nejvyšším Max skóre při vyhledávání BLAST
přístupové číslo GenBank nejbližších příbuzných kmenů na webových stránkách NCBI
dBNa základě výsledků vyhledávání BLAST identita (%) kmenů ve srovnání s
nejbližšími příbuznými.
eNa základě výsledků vyhledávání BLAST, původ nejbližších příbuzných.
 |
Figure 1: Fylogenetický strom 13 amyláza-pozitivních bakteriálních kmenů a 2 referenčních kmenů Bacillus
Klikněte zde pro zobrazení obrázku |
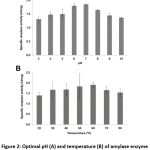 |
Obrázek 2: Optimální pH (A) a teplota (B) aktivity enzymu amylázy z Bacillus sp. 3.5AL2
Klikněte zde pro zobrazení obrázku |
Tabulka 3: Optimální doba indukce enzymu amylázy
|
Izolát |
Specifická amyláza aktivita
(U/mg proteinu) |
||
| 24 h | 48 h | 72 h | |
| Bacillus sp. 1.1AL2 | 0,21 ± 0,04Ab | 0,40 ± 0,04Ca | 0,41 ± 0,04Ba |
| B. cereus 2.3AL8 | 0.45 ± 0.06Ab | 0.62 ± 0.04Ba | 0.65 ± 0.06Aa |
| Bacillus sp. 3.5AL2 | 0,32 ± 0,11Ab | 0,91 ± 0,12Aa | 0,86 ± 0,11Aa |
Hodnoty jsou průměry ± SD ve třech opakováních.
Velká a malá písmena označují statistické rozdíly (p < 0,05) ve sloupci, resp. řádku.
Tabulka 4: Specifická aktivita enzymu amylázy při optimálním pH a teplotě
| Kmen | Aktivita (U/mg) | Optimální tep. (°C) | Optimální pH |
| Bacillus sp. 3.5AL2 | 1,97 ± 0,41 | 60 | 7.0 |
Diskuse
Thajské celní údaje (2017) ukázaly, že Thajsko v roce 2016 dovezlo průmyslové enzymy z jiných zemí v hodnotě 2 625 milionů Bahts a míra dovozu se zvýšila o 9,40 % ročně. Jeden z nejpoužívanějších enzymů v Thajsku, amyláza, se uplatňuje v oděvním, textilním a potravinářském průmyslu. Chybí však místní produkce komerční amylázy, a proto byla tato práce zaměřena na izolaci půdních bakterií z místního lesa se schopností produkovat amylázu pro průmyslové využití.
Zbytky bohaté na škrob mohou být lepším potenciálním zdrojem, kde lze izolovat amyláza-pozitivní bakterie16. Kromě toho by mohly být izolovány z míst, jako jsou farmy na pěstování manioku, půda a továrny na zpracování mouky17. V této práci bylo izolováno 13 bakterií produkujících amylázu, které byly identifikovány jako Bacillus spp. a Enterobacter sp. což je podobné jako v předchozích zprávách18, 19, 20, kde byly jako producenti amylázy většinou zjištěny Bacillus spp.
Naše výsledky ukázaly, že Bacillus sp. 3.5AL2, izolát s nejvyšší specifickou aktivitou mezi 13 izoláty, produkoval nejvyšší specifickou aktivitu 0,91 ± 0,12 U/mg při dvoudenní inkubaci při 37 °C. Optimální pH a teplota pro amylázovou aktivitu byly 7,0 a 60 °C. Za obou optimálních podmínek byla specifická aktivita amylázy z Bacillus sp. 3.5AL2 1,97 ± 0,41 U/mg. Je známo, že enzymy, které mohou pracovat při vysoké teplotě, jsou považovány za výhodu v průmyslových procesech, jako je zkapalňování škrobu21. Amylasa z Bacillus sp. 3.5AL2 má tedy potenciální využití v těchto průmyslových odvětvích.
Podobně Bacillus sp. GM890 vykazoval optimální teplotu pro amylasu při 60 °C20, Bacillus licheniformis AI20 vykazuje nejvyšší aktivitu v rozmezí 60-80 °C22 a Bacillus sp. WA21 měl nižší optimální teplotu pro amylázu 55 °C19.
Většina bakteriálních kmenů degradujících škrob vykazovala pro normální růst a enzymovou aktivitu rozmezí pH mezi 6,0 a 7,04 . Stejně tak v této práci měl Bacillus sp. 3.5AL2 optimální pH 7,0, které nevyžaduje přídavek kyseliny nebo zásady. Naše zjištění bylo v souladu s Bacillus sp. izolovaným z odpadu dhalového průmyslu, který vykazoval optimální teplotu 60 °C23 , a B. amyloliquefaciens s optimálním pH 7,024 . Nicméně Bacillus sp. WA21 vykazoval optimální pH amylázy 6,0, což je méně než pH zjištěné v této studii19.
Tato studie je velmi důležitá pro zahájení komerční výroby amylázy v Thajsku. Další výzkumné šetření je však nezbytné, aby byla výroba amylázy rentabilní. Je třeba provést důkladnou charakterizaci enzymu, dále stanovit termostabilitu, stabilitu pH, vliv různých kovových iontů a různých substrátů, zejména zemědělských odpadů v Thajsku, a jejich koncentrací.
Po získání všech potřebných údajů, jak je uvedeno výše, se předpokládá, že produkce komerční amylázy v thajském enzymovém průmyslu bude narůstat a bude rozšířena v každém regionu a následně bude přínosem pro ekonomiku země díky soběstačnosti na vlastních zdrojích k produkci enzymu amylázy.
Závěr
Toto je první zpráva o identifikaci 13 bakteriálních izolátů produkujících amylázu z půdy v Nasinuan Community Forest, Maha Sarakham. Všechny bakterie byly identifikovány jako Bacillus spp. s výjimkou jedné z rodu Enterobacter. Tyto bakterie mohou být v budoucnu využity k produkci amyláz a uplatněny na místní i národní úrovni v zemědělství, potravinářství a textilním průmyslu. Tím se sníží náklady na dovoz průmyslových enzymů z jiných zemí, nabídne se udržitelnost místní produkce enzymů a posílí se ekonomika národa.
Poděkování
Autoři by rádi poděkovali Mahasarakham University (Grant Year 2018) za finanční podporu udělenou SD a Faculty of Technology, Mahasarakham University (Grant Year 2017) udělenou VL.
Konflikt zájmů
Autoři nedeklarují žádný konflikt zájmů.
- Pandey A. Glukoamylase research: Přehled. 47:439-445 (1995).
- Burhan A.I., Nisa U., Gokhan C., Omer C., Ashabil A., and Osman G. Enzymatic properties of a novel thermostable, thermophilic, alkaline and chelator resistant amylase from an alkaliphilic Bacillus isolate ANT-6. (Enzymatické vlastnosti nové termostabilní, termofilní, alkalické a chelatorrezistentní amylázy z alkalického izolátu Bacillus ANT-6). Process Biochem. 38: 1397-1403 (2003).
- Gurung N., Ray S., Bose S., and Rai, V.A. Broader view: Microbial enzymes and their relevance in industries, medicine and beyond. Biomed Res Internat. 1-18. doi:10.1155/2013/ 329121 (2013).
- Gupta R., Gigras P., Mohapatra H., Goswami V.K., and Chauhan B. Microbial α-amylases: a biotechnological perspective. Process Biochem. 38:1599-1616 (2003).
- Takasaki Y. An amylase producing maltotetrose and from maltopentose from circulans. Agric Biol Chem. 47:2193-2199 (1983).
- Fogarty W.M., and Kelly C.T. Amylase, amyloglucosidase and related glucanases. Rose A.H. Economic Microbiology, Microbial Enzymes and Bioconversion, New York Academic Press Inc, vol. 5. Pp. 115-170 (1980).
- Wind R.D., Buitelaar R.M.G., Huizing H.J., and Dijkhuizen L. Characterization of a new Bacillus stearothermophilus isolate: a highly thermostable α-amylase producing strain. Appl Microbiol Biotechnol. 41:155-162 (1994).
- Brumm P.J., Hebeda R.E., and Teague W.M. Purification & characterization of commercialized, cloned megaterium α-amylase. Část I: purifikace &hydrolytické vlastnosti. Starch. 43:319-323 (1991).
- Takasaki Y. An amylase producing maltotriose from subtilis. Agric Bio. Chem. 49:1091-1097 (1985).
- Lowry O.H., Rosebrough N.J., and Randall R.J. Protein measurement with the folin phenol reagents. J Biol Chem. 193: 265-275 (1951).
- Altschul S.F., Gish W., Miller W., Myers E.W. a Lipman D.J. Basic local alignment search tool. J Mol 215:403-410 (1990).
- Bhaskara R.K.V., Ashwini K., Gaurav K., and Karthik L. Optimization, production and partial purification of extracellular α-amylase from Bacillus marini. Arc Appl Sci Res. 3:33-42 (2011).
- GhoseK. Měření celulázových aktivit. Pure Appl Chem. 59: 257-268 (1987).
- Haq U.I., Ashraf H., Iqbal J., and Qadeer M.A. Production of α-amylase by Bacillus licheniformis using an economical medium. Biores Technol. 87:57-61 (2003).
- Mishra S., and Behera N. Amylase activity of starch degrading bacteria is isolated from soil receiving kitchen wastes. Afr J Biotechnol. 7: 3326-3331 (2008).
- Fossi B.T., Taveaand F., and Ndjonenkeu T. Production and Partial Characterization of a Themostable amylase from Ascomycetes yeast strain isolated from starchy soils. Afr J Biotechnol. 4:14-18 (2005).
- Cordeiro C.A.M. Production and propertiesof α-amylase from thermophilic Bacillus sp. Brazil J Microbiol. 33:57-61 (2002).
- Asad W. Extracellular enzyme production by indigenous thermophilic bacteria: WA21: Partial purification and characterization of α-amylase by Bacillus sp. Pakistan J Botany. 43:1045-1052 (2011).
- Kim T.U. Purification and characterization of a maltotetraose-forming alkaline α-amylase from an alkalophilic Bacillus strain, GM8901. Appl Envin Microbiol. 61: 83105-3112 (1995).
- Sivaramakrishnan S., Gangadharan D., Madhavan K.N., and Pandey A. Solid culturing of Bacillus amyloliquefaciens for alpha amylase production. Food Technol 44:269-274 (2006).
- Abdel-Fattah Y.R., Soliman N.A., El-Toukhy N.M., El-Gendi H., and Ahmed R.S. Purification, and characterization of thermostable α-amylase produced by Bacillus licheniformis isolate AI20. J Chem. 2013:1-11 (2013).
- Thippeswamy S., Girigowda K., and Mulimani V.H. Isolation and identification of α-amylase producing Bacillus from Dhal
industry waste. Indian J Biochem Biophysics. 43: 295-298 (2006). - Abd-ElhalemT., El-Sawy M., Rawia F.G., and Khadiga A.A.T. Production of amylase from Bacillus amyloliquefaciens under submerged fermentation using some agro-industrialby-products. Ann Agri Sci. 60:193-202 (2015).
- Tamura K., and Nei M. Estimation of the number of nucleotide substitutions in the control region of mitochondrial DNA in humans and chimpanzees. Mol Biol Evol. 10:512-526 (1993).

(navštíveno 12 737krát, dnes 21 návštěv).