Cíle výuky
- Spojit elektronové konfigurace prvků s tvarem periodické tabulky.
- Určit předpokládanou elektronovou konfiguraci prvku podle jeho místa v periodické tabulce.
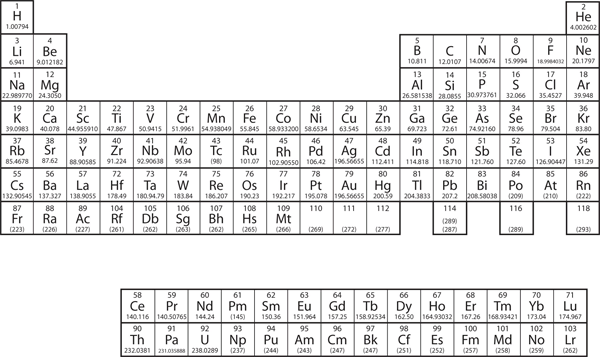
V kapitole 3 „Atomy, molekuly a ionty“ jsme představili periodickou tabulku jako nástroj pro uspořádání známých chemických prvků. Periodická tabulka je znázorněna na obrázku 8.11 „Periodická tabulka“. Prvky jsou seřazeny podle atomového čísla (počtu protonů v jádře) a prvky s podobnými chemickými vlastnostmi jsou seskupeny do sloupců.
Obrázek 8.11 Periodická tabulka
Proč má periodická tabulka takovou strukturu, jakou má? Odpověď je poměrně jednoduchá, pokud rozumíte elektronovým konfiguracím: tvar periodické tabulky kopíruje zaplnění jednotlivých slupek elektrony.
Začněme s H a He. Jejich elektronové konfigurace jsou 1s1, respektive 1s2; u He je zaplněna slupka n = 1. V případě He je zaplněna slupka n = 1. Tyto dva prvky tvoří první řádek periodické tabulky (viz obrázek 8.12 „1“).
Obrázek 8.12 Podpouzdro 1s
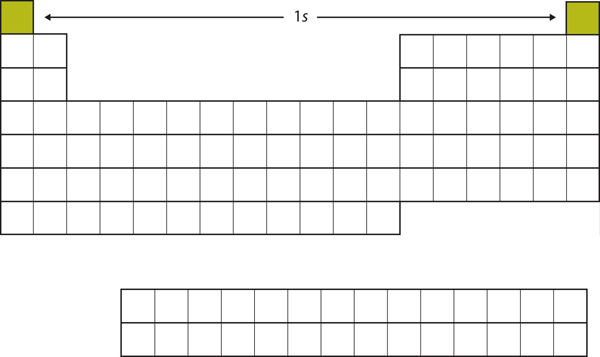
H a He představují zaplnění podpouzdra 1s.
Další dva elektrony, pro Li a Be, by přešly do podpouzdra 2s. Obrázek 8.13 „Dvojka“ ukazuje, že tyto dva prvky sousedí v periodické tabulce.
Obrázek 8.13 Podpouzdro 2s
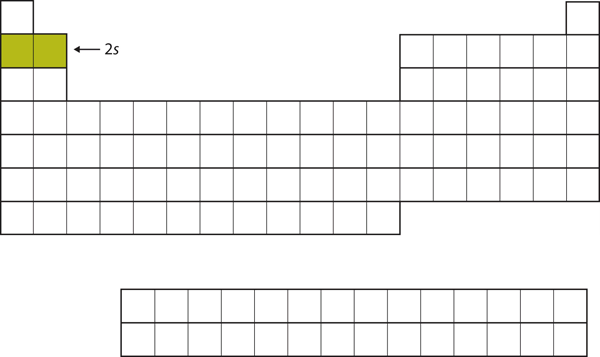
U Li a Be dochází k zaplnění podpouzdra 2s.
U dalších šesti prvků dochází k zaplnění podpouzdra 2p elektrony. Na pravé straně periodické tabulky je těchto šest prvků (B až Ne) seskupeno dohromady (obrázek 8.14 „Dvojka“).
Obrázek 8.14 Podpouzdro 2p
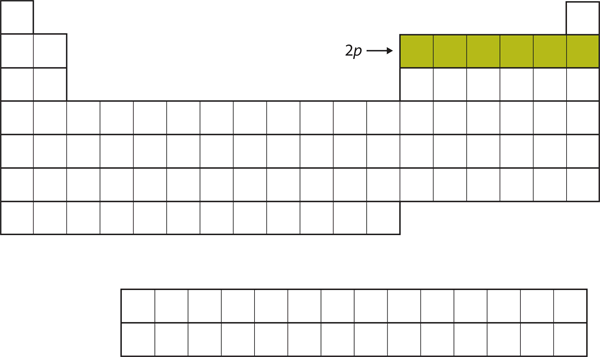
U prvků B až Ne je obsazeno podpouzdro 2p.
Další podpouzdro, které se zaplňuje, je podpouzdro 3s. Prvky, u nichž se zaplňuje tato podpouzdra, Na a Mg, jsou opět na levé straně periodické tabulky (obrázek 8.15 „The 3“).
Obrázek 8.15 Podpouzdro 3s
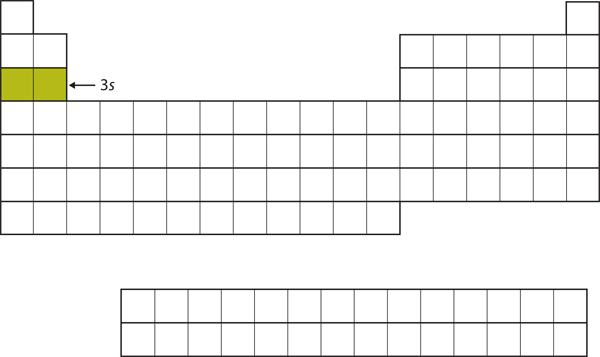
Nyní je obsazeno podpouzdro 3s.
Následujícím šestým prvkem je zaplněno podpouzdro 3p (obrázek 8.16 „The 3“).
Obrázek 8.16 Podpouzdro 3p
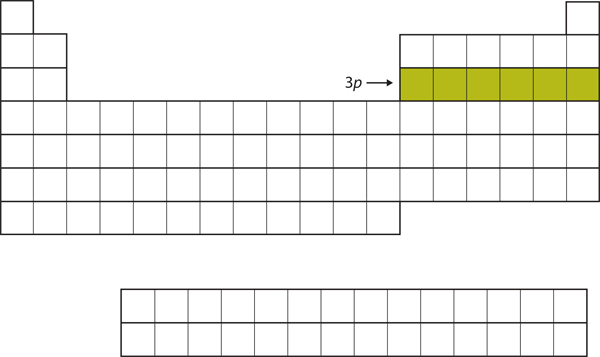
Následující podpouzdro 3p je zaplněno elektrony.
Místo zaplnění dalšího podpouzdra 3d přechází elektrony do podpouzdra 4s (obrázek 8.16).17 „4“).
Obrázek 8.17 Podpouzdro 4s
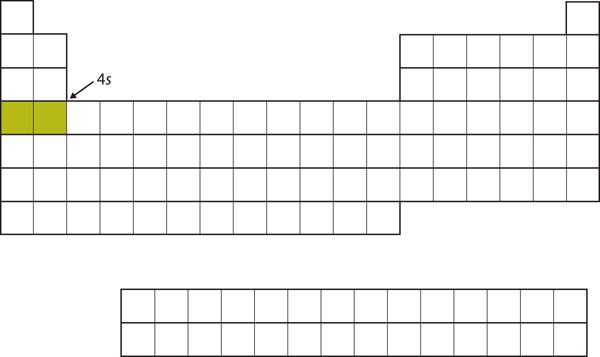
Podpouzdro 4s se zaplní dříve než 3d podpouzdro. To se odráží ve struktuře periodické tabulky.
Po zaplnění 4s podpouzdra je 3d podpouzdro zaplněno až 10 elektrony. To vysvětluje úsek 10 prvků uprostřed periodické tabulky (obrázek 8.18 „3“).
Obrázek 8.18 Podpouzdro 3d
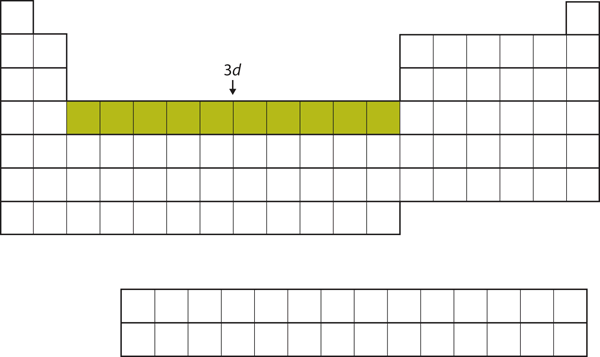
Podpouzdro 3d je zaplněno ve střední části periodické tabulky.
A tak dále. Když procházíme napříč řádky periodické tabulky, celkový tvar tabulky načrtává, jak elektrony obsazují slupky a podslupky.
V prvních dvou sloupcích na levé straně periodické tabulky jsou obsazeny podslupky s.
První dva sloupce na levé straně periodické tabulky jsou místa, kde jsou obsazeny podslupky s. Z tohoto důvodu se první dva řádky periodické tabulky označují jako blok s. Podobně blok p je šest nejpravějších sloupců periodické tabulky, blok d je prostředních deset sloupců periodické tabulky, zatímco blok f je čtrnáctisloupcová část, která se obvykle zobrazuje jako oddělená od hlavního těla periodické tabulky. Mohl by být součástí hlavního těla, ale pak by periodická tabulka byla poměrně dlouhá a těžkopádná. Na obrázku 8.19 „Bloky periodické tabulky“ jsou znázorněny bloky periodické tabulky.
Obrázek 8.19 Bloky periodické tabulky
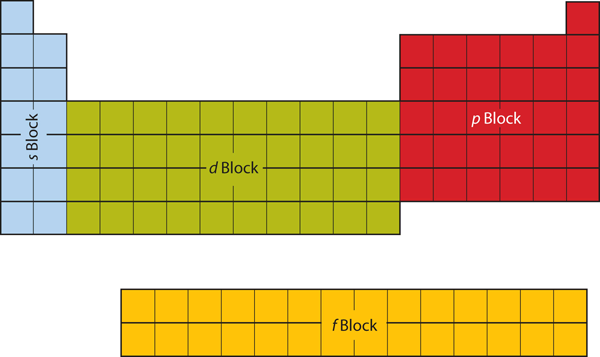
Periodická tabulka je rozdělena do bloků podle toho, která podskupina je vyplněna pro atomy, které do dané sekce patří.
Elektrony v nejvyšším číslovaném obalu plus všechny elektrony v posledním nevyplněném podobalu se nazývají valenční elektrony; obal s nejvyšším číslem se nazývá valenční obal. (Vnitřní elektrony se nazývají elektrony jádra.) Valenční elektrony do značné míry řídí chemii atomu. Pokud se podíváme pouze na elektronovou konfiguraci valenční slupky, zjistíme, že v každém sloupci je elektronová konfigurace valenční slupky stejná. Vezměme si například prvky v prvním sloupci periodické tabulky: H, Li, Na, K, Rb a Cs. Jejich elektronové konfigurace (zkratky pro větší atomy) jsou následující, přičemž elektronová konfigurace valenčního obalu je zvýrazněna:
| H: | 1s1 |
| Li: | 1s22s1 |
| Na: | 3s1 |
| K: | 4s1 |
| Rb: | 5s1 |
| Cs: | 6s1 |
Všichni mají ve svých valenčních slupkách podobnou elektronovou konfiguraci: jediný elektron s. Protože velkou část chemie prvku ovlivňují valenční elektrony, očekávali bychom, že tyto prvky budou mít podobnou chemii – a mají ji. Uspořádání elektronů v atomech vysvětluje nejen tvar periodické tabulky, ale také skutečnost, že prvky ve stejném sloupci periodické tabulky mají podobnou chemii.
Stejný koncept platí i pro ostatní sloupce periodické tabulky. Prvky v každém sloupci mají stejné elektronové konfigurace valenčního obalu a prvky mají některé podobné chemické vlastnosti. To platí striktně pro všechny prvky v blocích s a p. V blocích d a f, protože existují výjimky z pořadí zaplňování slupek elektrony, nejsou podobné valenční slupky v těchto blocích absolutní. V těchto blocích však existuje mnoho podobností, takže se očekává podobnost chemických vlastností.
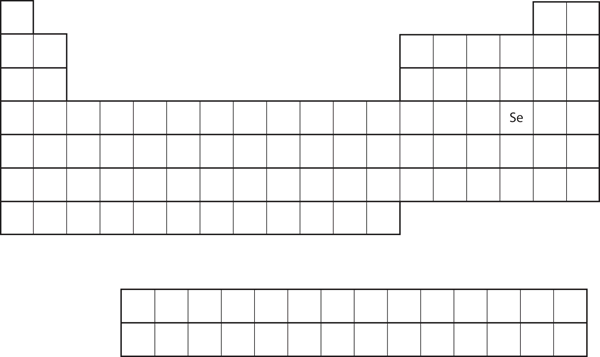
Podobnost elektronové konfigurace valenčního obalu znamená, že elektronovou konfiguraci atomu můžeme určit pouze podle jeho polohy v periodické tabulce. Uvažujme Se, jak je znázorněno na obrázku 8.20 „Selen v periodické tabulce“. Nachází se ve čtvrtém sloupci bloku p. To znamená, že jeho elektronová konfigurace by měla končit elektronovou konfigurací p4. Elektronová konfigurace Se je skutečně podle očekávání 4s23d104p4.
Obrázek 8.20 Selen v periodické tabulce
Příklad 8
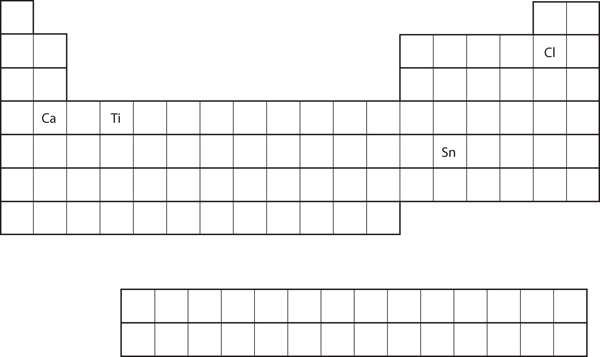
Z polohy prvku v periodické tabulce předpovězte elektronovou konfiguraci valenčního obalu pro každý atom. Viz obrázek 8.21 „Různé prvky v periodické tabulce“.
- Ca
- Sn
Roztok
- Ca se nachází ve druhém sloupci bloku s. Zjistěte, zda je prvek umístěn v periodické tabulce. Očekávali bychom, že jeho elektronová konfigurace by měla končit na s2. Elektronová konfigurace vápníku je 4s2.
- Sn se nachází ve druhém sloupci bloku p, takže bychom očekávali, že jeho elektronová konfigurace bude končit na p2. Elektronová konfigurace cínu je 5s24d105p2.
Vyzkoušejte se
Podle umístění prvku v periodické tabulce předpovězte elektronovou konfiguraci valenčního obalu pro každý atom. Viz obrázek 8.21 „Různé prvky v periodické tabulce“.
- Ti
- Cl
Odpověď
- 4s23d2
- 3s23p5
Obrázek 8.21 Různé prvky v periodické tabulce
Příloha pro potraviny a nápoje: Umělé barvy
Barva předmětů vzniká jiným mechanismem než barvy neonových a jiných výbojkových světel. Ačkoli barevná světla vytvářejí své barvy, předměty jsou barevné, protože přednostně odrážejí určitou barvu od bílého světla, které na ně svítí. Například červené rajče je jasně červené, protože odráží červené světlo, zatímco pohlcuje všechny ostatní barvy duhy.
Mnoho potravin, jako jsou rajčata, je velmi barevných; ve skutečnosti je běžné tvrzení „člověk jí nejdříve očima“ implicitním uznáním, že vizuální přitažlivost jídla je stejně důležitá jako jeho chuť. Ale co zpracované potraviny?
Do mnoha zpracovaných potravin se přidávají potravinářská barviva. Existují dva typy potravinářských barviv: přírodní a umělá. Mezi přírodní potravinářská barviva patří karamelizovaný cukr pro hnědou barvu; annatto, kurkuma a šafrán pro různé odstíny oranžové nebo žluté; betanin z červené řepy pro fialovou barvu; a dokonce i karmín, sytě červené barvivo, které se získává z košenily, malého hmyzu, který parazituje na kaktusech ve Střední a Jižní Americe. (Správně: možná jíte šťávu z brouka!)
Některá barviva jsou umělá. Ve Spojených státech amerických schvaluje v současné době Úřad pro kontrolu potravin a léčiv jako umělá barviva v potravinách, nápojích a kosmetice pouze sedm sloučenin:
- FD&C Blue #1: Brilliant Blue FCF
- FD&C Blue #2: Indigotine
- FD&C Green #3: Červená #3: Erythrosine
- FD&C Červená #40: Allura Red AC
- FD&C Žlutá #5: Žlutá #6: Sunset Yellow FCF
Barvy s nižším číslem již nejsou na trhu nebo byly z různých důvodů odstraněny. Obvykle jsou tato umělá barviva velké molekuly, které velmi silně absorbují určité barvy světla, takže jsou v potravinách a kosmetice použitelné i ve velmi nízkých koncentracích. Někteří kritici tvrdí, že i v takto nízkých množstvích je malá část populace (zejména dětí) na umělá barviva citlivá, a vyzývají k omezení nebo zastavení jejich používání. Formální studie o umělých barvivech a jejich účincích na chování jsou však nepřesvědčivé nebo rozporuplné. Přesto si většina lidí i nadále pochutnává na zpracovaných potravinách s umělými barvivy (jako jsou ty na přiloženém obrázku).

Umělá potravinářská barviva se nacházejí v řadě potravinářských výrobků, jako jsou zpracované potraviny, cukrovinky a barviva na vejce. Dokonce i krmiva pro domácí zvířata obsahují umělá potravinářská barviva, i když je pravděpodobné, že zvířeti je to jedno!“
Zdroj:
Klíčové poznatky
- Uspořádání elektronů v atomech je zodpovědné za tvar periodické tabulky.
- Konfigurace elektronů lze předpovědět podle polohy atomu v periodické tabulce.
Cvičení
-
Kde v periodické tabulce jsou obsazeny elektrony s podskupiny?
-
Kde v periodické tabulce jsou elektrony obsazeny podskupiny d?
-
V kterém bloku se nachází Ra?
-
V kterém bloku se nachází Br?
-
Jaké jsou elektronové konfigurace valenčního obalu prvků ve druhém sloupci periodické tabulky?
-
Jaké jsou elektronové konfigurace valenčního obalu prvků v předposledním sloupci periodické tabulky
-
Jaké jsou elektronové konfigurace valenčního obalu prvků v prvním sloupci bloku p?
-
Jaké jsou elektronové konfigurace valenčního obalu prvků v posledním sloupci bloku p?
-
Podle polohy prvku v periodické tabulce předpovězte elektronovou konfiguraci každého atomu.
a) Sr
b) S
10. Jaké jsou elektronové konfigurace prvků v periodické tabulce? Z polohy prvku v periodické tabulce předpovězte elektronovou konfiguraci jednotlivých atomů.
a) Fe
b) Ba
11. Jaká je elektronová konfigurace prvku? Z polohy prvku v periodické tabulce předpovězte elektronovou konfiguraci každého atomu.
a) V
b) Ar
12. Jaká je elektronová konfigurace prvku? Z polohy prvku v periodické tabulce předpovězte elektronovou konfiguraci každého atomu.
a) Cl
b) K
13. Jaká je elektronová konfigurace prvku? Z polohy prvku v periodické tabulce předpovězte elektronovou konfiguraci každého atomu.
a) Ge
b) C
14. Jaká je elektronová konfigurace prvku? Z umístění prvku v periodické tabulce předpovězte elektronovou konfiguraci každého atomu.
a) Mg
b) I
Odpovědi
první dva sloupce
blok s
ns27.
ns2np19.
a) 1s22s22p63s23p64s23d104p65s2
b) 1s22s22p63s23p411.
a) 1s22s22p63s23p64s23d3
b) 1s22s22p63s23p613.
a) 1s22s22p63s23p64s23d104p2
b) 1s22s22p2
.