ÚVOD
Heterozygotní familiární hypercholesterolemie (FH) je časté genetické onemocnění spojené s předčasným aterosklerotickým kardiovaskulárním onemocněním (ASCVD). U dětí s neléčenou FH je zvýšené riziko předčasné ASCVD po 20. roce života1. Závažné zvýšení hladiny cholesterolu v lipoproteinech o nízké hustotě (LDL-C) začíná již u plodu a vede k trvalému vystavení arteriální stěny působení LDL-C, což urychluje ukládání cholesterolu a cévní zánět a predisponuje k časné iniciaci aterosklerózy, zejména v koronárních tepnách a aortě.
Statiny a další terapie snižující hladinu lipidů (LLT) účinně snižují LDL-C, jsou bezpečné u dětí a dospívajících a obnovují funkci endotelu v raném věku.2-4 Nedávno byl navržen univerzální screening dětí od 2 let věku a před dosažením 8 let věku5,6 s cílem odhalit jedince vyžadující léčbu. Tento přístup je však založen na teoretických úvahách a v reálném životě se neosvědčil.
Naproti tomu je málo známo o charakteristikách pacientů s FH mladších 18 let, o LLT používané u těchto pacientů a o lipidových cílech dosažených v reálném životě. Informační deficit je ještě větší u údajů o následném sledování. K získání těchto zásadních informací, které jsou nezbytné pro zlepšení modelů péče o FH, terapeutických protokolů a zdravotní politiky, lze využít národní registry.7,8 Studie SpAnish Familial HypErcHolEsterolaemiA CohoRt STudy (SAFEHEART) (NCT02693548) byla navržena s cílem zlepšit přehled o prognostických faktorech a mechanismech ovlivňujících rozvoj ASCVD a úmrtnost v populaci s FH.
Naším cílem bylo analyzovat charakteristiky pacientů a posoudit cíle LLT a lipidů při zařazení a v průběhu sledování u pacientů s FH mladších 18 let zařazených do studie SAFEHEART a určit faktory, které předpovídají pravděpodobnost dosažení těchto cílů.
METODAStudie Design a populace
SAFEHEART je otevřená, multicentrická, celostátní, dlouhodobá prospektivní kohortová studie u molekulárně definované populace FH ve Španělsku. Nábor účastníků z rodin s FH byl zahájen v roce 2004 a stále probíhá. Kritéria pro zařazení byly indexové případy s genetickou diagnózou FH a jejich příbuzní starší 15 let s genetickou diagnózou FH, jakož i jejich příbuzní bez genetické diagnózy FH (kontrolní skupina). Nicméně byli zařazeni i účastníci mladší 15 let, pokud o to požádali jejich rodiče. Tato studie byla schválena místními etickými komisemi. Všichni způsobilí jedinci a/nebo alespoň jeden z jejich rodičů nebo zákonných zástupců poskytli písemný informovaný souhlas. Koordinační centrum se sídlem v Madridu ve Španělsku bylo zodpovědné za řízení sledování účastníků. Pacienti a/nebo jejich rodiče byli každoročně kontaktováni pomocí standardizovaného telefonického hovoru, aby byly zaznamenány příslušné změny v životních návycích a lécích a jakékoli kardiovaskulární příhody nebo jiné zdravotní problémy. Zúčastnění lékaři, kteří zařazovali pacienty a rodiny do tohoto registru, byli proškoleni, přičemž pokyny pro osvědčené postupy byly posíleny na každoročních setkáních, kterých se účastnili lékaři odborníci v této oblasti; kromě toho byl používán elektronicky založený program a telefonické poradenství a v případě potřeby byl nasazen internetový školicí program pro další podporu řízení. O léčbě rozhodoval výhradně lékař každého pacienta.
Klinická a laboratorní měření
Demografické a klinické charakteristiky byly zaznamenány, jak je popsáno jinde.9 Vzorky venózní krve byly odebrány po 12hodinovém lačnění. Vzorky séra, plazmy a DNA byly alikvotovány a uchovávány při -80 °C. Hladiny celkového cholesterolu, triglyceridů a cholesterolu v lipoproteinech o vysoké hustotě (HDL-C) v séru byly měřeny v centrální laboratoři pomocí enzymatických metod. Koncentrace LDL-C v séru byla vypočtena pomocí Friedewaldova vzorce. DNA byla izolována z plné krve standardními metodami a FH byla geneticky diagnostikována pomocí DNA microarray.10 Cíle LDL-C byly definovány podle nedávných doporučení a cílů. Primárním cílem byl cholesterol v lipoproteinech o nízké hustotě
mg/dl.11 Alternativní cíl pro pacienty mladší 14 let sestával z LDL-C mg/dl při absenci jakýchkoli dalších kardiovaskulárních rizikových faktorů (kouření, HDL-C mg/dl, lipoprotein (a) > 50mg/dl nebo LDL-C > 250mg/dl) nebo předčasného kardiovaskulárního onemocnění u předků nebo prarodičů.6 Předčasné známé ASCVD bylo definováno jako výskyt první příhody před 55. rokem věku u mužů a před 65. rokem věku u žen. klasifikace terapie snižující hladinu lipidů
Maximální dávka statinu byla definována jako atorvastatin 40 až 80 mg/d nebo rosuvastatin 20 až 40 mg/d, které byly považovány za vysoce intenzivní dávky statinu. Maximální kombinovaná léčba byla definována jako maximální dávka statinu plus ezetimib 10mg/d. Maximální LLT byla definována jako jakákoli LLT, u níž se očekávalo alespoň 50% snížení výchozí hladiny LDL-C: Simvastatin 20, 40 nebo 80 mg/d plus ezetimib 10 mg/d; pravastatin 40 mg/d v kombinaci s ezetimibem 10 mg/d; fluvastatin 80 mg/d plus ezetimib 10 mg/d; atorvastatin 40 nebo 80 mg/d s ezetimibem 10 mg/d nebo bez něj; atorvastatin 10 nebo 20mg/d plus ezetimib 10mg/d; rosuvastatin 20 nebo 40mg/d s ezetimibem 10mg/d nebo bez něj; rosuvastatin 10mg/d plus ezetimib 10mg/d; a pitavastatin 4mg/d v kombinaci s ezetimibem 10mg/d.12,13
Genetická analýza
Mutace receptoru pro cholesterol v lipoproteinech o nízké hustotě (LDLR) byly klasifikovány podle jejich známého vlivu na funkci proteinu LDL receptoru jako nulové (receptor-negativní) a defektní (receptor-defektivní) mutace, jak bylo popsáno dříve.14 Varianty vedoucí k úplné absenci nebo zkrácení proteinu (ztrátě funkce) prokázané funkční analýzou in vitro nebo počítačovou simulační analýzou byly klasifikovány jako receptor-negativní. Tyto varianty zahrnovaly následující: a) bodové mutace způsobující předčasný stop kodon; b) missense mutace postihující pátou repetici bohatou na cystein v ligand-vazebné doméně genu LDL-C receptoru (mutace třídy 2A); c) malé delece nebo inserce způsobující posun rámce a předčasný stop kodon; a d) velké přestavby. Receptorově defektní mutace byly zbývající inframatické bodové mutace a malé inframatické delece a inzerce. Všechny mutace bez analýzy známé funkčnosti pomocí studií in vitro nebo počítačové simulační analýzy byly klasifikovány jako „neznámá funkčnost“, protože jsme si nemohli být jisti, zda je jejich vliv na receptor negativní nebo defektní; byly však považovány za patogenní, protože všichni jedinci nesoucí 1 z těchto mutací měli hypercholesterolemii, zatímco příbuzní bez mutace měli normální hladinu cholesterolu.14
Statistická analýza
Statistické analýzy byly provedeny pomocí programu SPSS verze 18.0 (SPSS Inc, Chicago, Illinois, Spojené státy). Normalita rozdělení proměnných byla analyzována pomocí Kolmogorov-Smirnovova testu. Kvantitativní údaje jsou vyjádřeny jako medián a mezikvartilové rozpětí (IQR) a kvalitativní údaje jako absolutní počet a procento. Byly definovány dvě populace: populace při vstupu do studie (n = 241) a populace při sledování (jinak známá jako kohorta), která zahrnovala ty pacienty, kteří měli při sledování úplný profil plazmatických lipidů (n = 217). Všechna srovnání mezi vstupní a následnou studií byla provedena v kohortové studii. Porovnání četností mezi kvalitativními proměnnými bylo provedeno pomocí chí-kvadrát testu. Změny binárních proměnných byly analyzovány pomocí McNemarova testu. Mediány hodnot kvantitativních proměnných byly porovnány pomocí neparametrického Mannova-Whitneyho testu, případně párového Wilcoxonova testu se znaménky. V kohortové studii byla provedena dopředná binární logistická regresní analýza s cílem určit proměnné související s užíváním statinů. Zahrnuli jsme proměnné, které byly statisticky významné v jednorozměrných analýzách, a také apriorní prediktory a matoucí faktory: věk, pohlaví a sledování v primárním/specializovaném zařízení. Další dopředná binární logistická regresní analýza byla provedena v kohortové studii s vyloučením pacientů, kteří dosáhli cíle při vstupu, s cílem určit proměnné spojené s dosažením LDL-C
mg/dl. Zahrnuli jsme proměnné, které byly statisticky významné v jednorozměrných analýzách, a také apriorní prediktory a matoucí faktory: věk, pohlaví, typ mutace (nulová nebo defektní), užívání ezetimibu a sledování v primárním/specializovaném prostředí. Rozdíly byly považovány za statisticky významné při P RESULTS
Dosud bylo do registru SAFEHEART zařazeno 4141 účastníků; 392 z nich je mladších 18 let. Z nich 241 má molekulárně potvrzenou FH, u 217 byl sledován kompletní lipidový profil (90,0 %) (obrázek 1). Dvacet čtyři pacientů bylo z analýzy vynecháno z důvodu absence kompletního lipidového profilu při sledování. Sledování probíhalo v rámci primární péče u 40 pacientů (18,4 %). Medián doby sledování byl 4,69 roku (IQR, 2,48-6,38 roku).
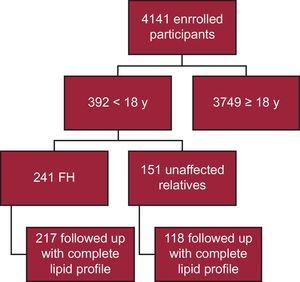
Schematické schéma studie. FH, familiární hypercholesterolemie.
Při zařazení do studie (populace při vstupu) bylo 129 pacientů s FH (53,5 %) mužů. Medián věku byl 15,0 let (IQR, 14,0-16,0 let). Dvěma nejmladším pacientům bylo 8 let. Anamnéza ASCVD nebyla přítomna u žádného pacienta a předčasná rodinná ASCVD byla přítomna u 40 pacientů (16,6 %). Základní charakteristiky jsou znázorněny v tabulce 1. Srovnání základních charakteristik při zařazení mezi pacienty ze souboru a pacienty, kteří nebyli sledováni, je uvedeno v tabulce 1. Mezi oběma skupinami nebyly zjištěny žádné významné rozdíly. Žádný pacient neměl v anamnéze ASCVD, vysoký krevní tlak nebo diabetes mellitus. Vyšší podíl skupiny bez sledování byl veden v rámci primární péče, i když tento rozdíl nebyl statisticky významný. V souboru došlo k významnému snížení plazmatických koncentrací celkového cholesterolu, LDL-C, triglyceridů a non-HDL-C; při sledování bylo rovněž pozorováno významné zvýšení HDL-C (tab. 2).
Základní charakteristiky vstupní populace
| Pacienti s FH s následným sledováním Medián (IQR)/čís. (%) |
Pacienti s FH bez následného sledování Medián (IQR)/č. (%) |
P | |
|---|---|---|---|
| Počet | 217 | 24 | |
| Pohlaví (muži) | 117 (53,9%) | 12 (50%) | .72 |
| Věk, y | 15,0 (14,0-16,0) | 15,0 (13,0-15,8) | .06 |
| Předčasné známé ASCVD | 36 (16,6 %) | 4 (16,7 %) | 1.00 |
| Aktivní kuřák tabáku | 13 (6,0%) | 2 (8,3%) | .65 |
| Xantomy | 1 (0,5%) | 0 (0,0%) | .99 |
| Korneální arcus | 6 (2,8 %) | 1 (4,2 %) | .53 |
| BMI, kg/m2 | 21,09 (19,40-22,80) | 20,79 (17,80-22,70) | .64 |
| Obvod pasu, cm | 72,0 (66,0-78,0) | 72,0 (66,0-75,8) | .94 |
| Celkový cholesterol, mg/dl | 223,5 (194,0-262.3) | 217,5 (194,5-277,5) | .76 |
| LDL-C, mg/dl | 162,6 (133.0-195,8) | 153,9 (13,1-209,3) | .71 |
| HDL-C, mg/dl | 49.0 (42,8-55,0) | 48,5 (41,5-56,0) | .96 |
| TG, mg/dl | 62,0 (49.0-80,3) | 66,0 (42,1-82,3) | ,90 |
| Non-HDL-C, mg/dl | 174.0 (145,8-210,9) | 167,0 (146,5-225,3) | .74 |
| Lp (a), mg/dl | 18,80 (7,00-48,50) | 13,45 (9,10-28,10) | .46 |
| Řízeno v rámci primární péče | 40 (22,9 %) | 7 (46,7 %) | .06 |
ASCVD, aterosklerotické kardiovaskulární onemocnění; BMI, index tělesné hmotnosti; FH, familiární hypercholesterolemie; HDL-C, cholesterol v lipoproteinech o vysoké hustotě; LDL-C, cholesterol v lipoproteinech o nízké hustotě; Lp (a), lipoprotein (a); IQR, mezikvartilové rozpětí; TG, triglyceridy.
Koncentrace lipidů a lipoproteinů v plazmě (kohorta)
| Kohorta při vstupu | Kohorta při sledování-.up | P | |
|---|---|---|---|
| Celkový cholesterol, mg/dl | 221.0 (194.0-260.2) | 203.0 (183.0-233.5) | .001 |
| LDL-C, mg/dl | 157,7 (132,8-194,5) | 138,0 (116,5-165.4) | .001 |
| HDL-C, mg/dl | 49,0 (43,0-55,0) | 50,0 (44,0-58.0) | .002 |
| TG, mg/dl | 62,0 (49,0-80,2) | 70,0 (54,5-91.0) | .004 |
| Non-HDL-C, mg/dl | 171,0 (145,8-209,2) | 154.0 (132,0-182,5) | .001 |
HDL-C, cholesterol v lipoproteinech o vysoké hustotě; LDL-C, cholesterol v lipoproteinech o nízké hustotě; TG, triglyceridy.
Hodnoty jsou medián (mezikvartilové rozpětí).
Funkční mutace
U 212 pacientů jsme identifikovali mutaci v genech pro LDL-C receptor (97,7 %) a u 5 pacientů mutaci v genech pro apolipoprotein B (2,3 %). Z mutací v LDL-C receptorových genech bylo 95 (43,8 %) klasifikováno jako nulové mutace, 92 (42,4 %) jako defektní mutace a 25 (11,5 %) jako mutace s neznámou funkčností.
Lipid-lowering Therapy and Goal Attachement
Tabulka 3 ukazuje použití různých režimů LLT při vstupu a sledování. Výsledky ukazují významný nárůst užívání statinů (44,2 % při vstupu a 68,2 % při sledování), ezetimibu (8,7 % při vstupu a 15,2 % při sledování), maximální dávky statinu (3,3 % při vstupu a 13,9 % při sledování) a maximální LLT (7,9 % při vstupu a 23,6 % při sledování). Nejčastěji předepisovaným statinem při vstupu (25,3 %) a následném sledování (30.5 %) byl atorvastatin. Předepisování rosuvastatinu se zvýšilo (z 6,0 % při zařazení na 20,3 % při sledování). Medián trvání léčby statiny byl 7,0 let (5,0 až 9,0 let). Věk při menarche byl 12,0 let (12,0 až 13,0 let) u dívek léčených statiny a 12,0 let (11,0 až 13,0 let) u dívek neléčených statiny (P = .77). Nebylo pozorováno žádné zvýšení jaterních transamináz ani kreatinfosfokinázy. Fibráty a sekvestranty žlučových kyselin užívalo pouze 15 pacientů při zařazení (7,0 %) a 3 pacienti při sledování (1,5 %). Monoterapie ezetimibem bez statinu byla použita u 18 pacientů při zařazení (8,3 %) a u 24 pacientů při sledování (11,1 %). Pokud jde o adherenci k léčbě, 10 pacientů (4,6 %) uvedlo, že neužívali léky alespoň 1 den každý měsíc během sledování. Při multivariabilní analýze nebyla žádná proměnná nezávisle spojena s užíváním statinu.
Lipid-lowering Therapies and LDL-C Goal Achievement (Cohort)
| Při vstupu-/pokračování-.up- | At entry-/follow-up+ | At entry+/follow-up- | At entry+/follow-up+ | P | |
|---|---|---|---|---|---|
| Pacienti na statinech | 60 (27.6%) | 61 (28,1%) | 9 (4,1%) | 87 (40,1%) | .001 |
| Pacienti na maximální dávce statinu | 186 (85.7%) | 24 (11,1%) | 1 (0,5%) | 6 (2,8%) | .001 |
| Pacienti na ezetimibu | 177 (81,6%) | 21 (9.7%) | 7 (3,2%) | 12 (5,5%) | .013 |
| Pacienti na maximální kombinované léčbě | 211 (97,2%) | 6 (2,8%) | 0 (0.0%) | 0 (0,0%) | N/A |
| Pacienti na maximální LLT | 163 (75,1%) | 37 (17,1%) | 3 (1,4%) | 14 (6,5%) | .001 |
| LDL-C | 111 (51,2 %) | 62 (28,6 %) | 16 (7.4%) | 28 (12,9%) | .001 |
| LDL-C | 44 (20,3%) | 64 (29.5 %) | 19 (8,8 %) | 90 (41,5 %) | .001 |
LDL-C, cholesterol v lipoproteinech o nízké hustotě; LLT, léčba snižující hladinu lipidů
Hodnoty jsou n (%). – = není přítomna; + = je přítomna.
Klasifikace LLT viz text.
Koncentrace LDL-C v plazmě se snížila v průměru o 12,5 % a při sledování dosáhla mediánu 138,0 mg/dl. Cílových hodnot cholesterolu v lipoproteinech o nízké hustotě, jak je definují nedávná mezinárodní doporučení pro FH, bylo dosaženo u 20,3 % při vstupu a u 41,5 % při následném sledování (tabulka 3 a obrázek 2). Když byl zvažován alternativní cíl LDL-C
mg/dl pro pacienty mladší 14 let, dosáhlo tohoto cíle při zařazení 8 ze 48 pacientů (16,7 %) a při následném sledování 1 ze 6 pacientů (16,7 %). Jedinou proměnnou nezávisle spojenou s dosažením cíle LDL-C v multivariační analýze bylo užívání statinů (poměr šancí 13,83; 95% interval spolehlivosti 2,98-64,15). Typ poskytovatele zdravotní péče (specialista nebo lékař primární péče), věk, pohlaví, hladina lipoproteinu (a) a typ mutace nebyly spojeny s dosažením cíle LDL-C.
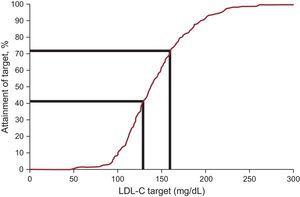
Cíle léčby u pacientů s familiární hypercholesterolemií mladších 18 let: podíl pacientů dosahujících cílové hodnoty LDL-C. LDL-C, cholesterol v lipoproteinech o nízké hustotě.
DISKUSE
V této studii uvádíme charakteristiky, užívání LLT a dosažení cíle LDL-C v longitudinální kohortě molekulárně definovaných pacientů s FH mladších 18 let zařazených do registru SAFEHEART. Tento unikátní registr pacientů s FH je založen na údajích získaných z reálného života ve Španělsku v prostředí specializované i primární péče. Naše výsledky ukazují, že cílové hodnoty LDL-C
mg/dl dosáhlo pouze 20,3 % pacientů při zařazení a 41,5 % při sledování, přičemž 68,2 % pacientů užívalo LLT. Užívání statinů bylo jediným faktorem nezávisle spojeným s dosažením cíle LDL-C. Pokud je nám známo, žádná jiná práce neprokázala dosažení cíle u pacientů s FH mladších 18 let a tato studie je první, která to uvádí u velké populace.
Nedávno registr ve Velké Británii15 analyzoval 207 dětí s FH, identifikoval mutace u 64 % dětí a zjistil, že 48 % dětí bylo na LLT; snížení LDL-C bylo dosaženo o 35 %. Autoři však neuvedli žádné výsledky dosažení cíle. Jiná zpráva, která analyzovala malý vzorek subjektů (n = 89), ukázala 43% snížení LDL-C při dlouhodobém sledování.16 Toto větší snížení je pravděpodobně způsobeno častějším užíváním kombinované léčby (56 %). Nebyly prokázány žádné výsledky objektivního dosažení. V jiném retrospektivním článku 207 pacientů v Nizozemsku užívalo LLT pouze 26 % pacientů a opět nebyly uvedeny žádné výsledky týkající se dosažení cílového LDL-C.17
Tato longitudinální studie ukázala, že hladiny LDL-C u pacientů s FH mladších 18 let se mohou v průběhu času měnit v důsledku úpravy LLT a edukace lékařů. Podíl pacientů užívajících statiny, maximální dávka statinu a maximální LLT se během sledování významně zvýšily. Zajímavé je, že naše údaje naznačují, že naše kohorta není zkreslená, protože nebyly zjištěny žádné statisticky významné rozdíly mezi pacienty, kteří nebyli sledováni, a kohortou.
Včasná diagnostika a léčba FH je nezbytná zejména u dětí a dospívajících, aby se zabránilo rozvoji ASCVD v dospělosti. Vyšetření FH u dětí má smysl a musí být provedeno do 8 let věku, protože děti s hypercholesterolemií jsou vystaveny zvýšenému riziku předčasné ASCVD. Screening navíc může identifikovat osoby s nejvyšším rizikem a urychlit zahájení LLT, která prokazatelně účinně zvrátí aterosklerotický proces a sníží riziko ASCVD. Děti s FH obvykle nemají klinickou ASCVD. Nicméně existence budoucího rizika podporuje použití LLT, přičemž základem léčby FH jsou statiny.18
Bezpečnost a snášenlivost LLT u dětské FH jsou vždy kontroverzní, ačkoli se uvádí, že jsou podobné jako u dospělých.5,19,20 Nedávno Ramaswami et al.15 neuvedli žádné bezpečnostní obavy, podobně jako naše výsledky. Přesto se doporučuje přísný dohled, zejména u těch pacientů, kteří dostávají vyšší dávky statinů. Dospívajícím dívkám by také mělo být doporučeno, aby léčbu statiny přerušily, pokud uvažují o těhotenství. Nicméně ačkoli je zapotřebí více údajů o bezpečnostních otázkách u dětí dlouhodobě léčených LLT, nedávné práce týkající se dlouhodobého sledování prokázaly vynikající bezpečnostní profil.21 Toto zjištění nepřímo podporují i naše údaje, protože vysoký podíl pacientů zahájil během sledování léčbu LLT a bylo jen málo případů, kdy léčbu přerušili. Naše výsledky jasně ukazují zvýšený podíl pacientů užívajících statiny, vysokou dávku statinů a maximální LLT, přičemž podíl pacientů, kteří medikaci opustili, byl nízký. Tyto údaje potvrzují bezpečnost, adherenci a snášenlivost statinů, a to i při užívání vysokých dávek, u pacientů s FH mladších 18 let.22 Naše výsledky se navíc shodují s předchozími zprávami, které neprokázaly žádný vliv na sexuální zrání.23 Všechny tyto výsledky potvrzují koncept „čím mladší, tím lepší“, pokud jde o ideální věk pro zahájení léčby statiny u těchto mladých pacientů s FH.23
Naše výsledky ukazují vysoký počet pacientů s FH mladších 18 let a v souladu s předchozími studiemi15,16 naznačují ochotu dospělých pacientů s FH zapojit do screeningových a registračních aktivit své nejbližší rodinné příslušníky. Tato skutečnost odráží vážnost, s jakou tito pacienti berou svůj problém, a dopad, který mohou mít rady jejich lékařů na změnu jejich životního stylu. Takový přístup dospělých pacientů představuje základ zdravého životního stylu u jejich příbuzných.24
Ačkoli nejčastějším cílem u pacientů s FH mladších 18 let je hladina LDL-C pod 130 mg/dl, alternativní přístup spočívající v LDL-C mg/dl lze použít u pacientů mladších 14 let, nekuřáků, s HDL-C ≥ 40 mg/dl, lipoproteinem (a) mg/dl, LDL-C mg/dl a bez předčasného kardiovaskulárního onemocnění u předků nebo prarodičů.6 Jiná nedávná doporučení doporučují snížení LDL-C o 50 % oproti hodnotám před léčbou, ale u dětí ve věku ≥ 10 let, zejména pokud existují další kardiovaskulární rizikové faktory, včetně zvýšeného lipoproteinu (a), by měl být cíl LDL-C mg/dl.11 Naše výsledky také ukazují, jak obtížné je pro tyto pacienty dosáhnout cílových hodnot lipidů.25 Dosažení cíle LDL-C bylo navíc podobné bez ohledu na to, zda byli pacienti léčeni specialisty nebo lékaři primární péče. Je tedy možné dosáhnout úrovně péče o dětské pacienty s FH v prostředí primární péče, která je srovnatelná s úrovní dosaženou péčí specialistů. Pro dosažení tohoto cíle je důležité zdůraznit podporu, které se lékařům dostává prostřednictvím registrů a specializovaných školicích programů. Registry mohou optimalizovat péči o pacienty s FH mladší 18 let tím, že umožní integraci primární a specializované péče, a mohou také podpořit zdravotnické orgány při rozhodování.8,26
Omezení a silné stránky
V této rozsáhlé studii sledování pacientů s FH mladších 18 let se intervence nezměnila oproti intervenci poskytované lékařem pacienta. V tomto registru chybí spolehlivý výchozí lipidový profil, protože někteří pacienti byli při zařazení do studie již léčeni. Kromě toho mohlo být zjištění pozměněno několika podmínkami, jako je odlišný životní styl a souvislost s různými kardiovaskulárními rizikovými faktory, které mohly výsledky modifikovat.
ZÁVĚRY
Údaje z registru FH mladší 18 let ukazují, že vysoký podíl pacientů s FH mladších 18 let má vysoké hladiny LDL-C a nedosahuje doporučených cílových hodnot LDL-C. V registru FH mladších 18 let je také vysoký podíl pacientů s FH mladších 18 let. Zjistili jsme zvýšení intenzity LLT a významné snížení hladin LDL-C v průběhu sledování. Užívání statinů bylo jediným nezávislým prediktorem dosažení cíle LDL-C. Během sledování navíc nebyly zjištěny žádné bezpečnostní problémy. Tyto výsledky naznačují, že mnoho pacientů s FH není adekvátně kontrolováno a že stále existuje prostor pro zlepšení léčby. Sledování této populace FH může navíc přispět k poznatkům o bezpečnosti celoživotní LLT a optimálním věku pro zahájení léčby s cílem zabránit rozvoji ASCVD v dospělosti.
FINANCOVÁNÍ
Tato práce byla podpořena grantem G03/181 od Fundación Hipercolesterolemia Familiar, FIS PI12/01289 od Instituto de Salud Carlos III a grantem 08-2008 od Centro Nacional de Investigación Cardiovascular.
KONFLIKTY ZÁJMŮ
Nebyly deklarovány.
- –
Děti s neléčenou heterozygotní familiární hypercholesterolemií mají zvýšené riziko předčasné ASCVD po 20. roce života.
- –
Statiny a další terapie snižující hladinu lipidů účinně snižují LDL-C a jsou u dětí a dospívajících bezpečné.
- –
Málo je známo o charakteristikách pacientů s FH mladších 18 let, o terapiích snižujících hladinu lipidů používaných u těchto pacientů a o cílech v oblasti lipidů dosažených v reálném životě.
- –
Tento informační deficit je ještě větší u údajů o sledování.
CO PŘINÁŠÍ TATO STUDIE?
- –
Vysoký podíl pacientů s FH mladších 18 let nedosahuje doporučených cílových hodnot LDL-C.
- –
Zjistili jsme zvýšení intenzity LLT a významný pokles hladin LDL-C během sledování.
- –
Užívání statinu bylo jediným nezávislým prediktorem dosažení cíle LDL-C a během sledování nebyly zjištěny žádné bezpečnostní problémy.
- –
Tyto výsledky posilují koncept „čím mladší, tím lepší“.
.