Chemie vody 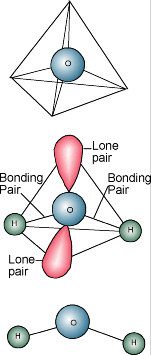 Jistě víte, že chemický popis vody je H2O. Molekula vody se skládá z jednoho atomu kyslíku vázaného na dva atomy vodíku. Atomy vodíku jsou „připojeny“ k jedné straně atomu kyslíku, což vede k tomu, že molekula vody má kladný náboj na straně, kde jsou atomy vodíku, a záporný náboj na druhé straně, kde je atom kyslíku. Protože se opačné elektrické náboje přitahují, mají molekuly vody tendenci se vzájemně přitahovat, takže voda je jakoby „lepkavá“. Strana s atomy vodíku (kladný náboj) přitahuje stranu s kyslíkem (záporný náboj) jiné molekuly vody.
Jistě víte, že chemický popis vody je H2O. Molekula vody se skládá z jednoho atomu kyslíku vázaného na dva atomy vodíku. Atomy vodíku jsou „připojeny“ k jedné straně atomu kyslíku, což vede k tomu, že molekula vody má kladný náboj na straně, kde jsou atomy vodíku, a záporný náboj na druhé straně, kde je atom kyslíku. Protože se opačné elektrické náboje přitahují, mají molekuly vody tendenci se vzájemně přitahovat, takže voda je jakoby „lepkavá“. Strana s atomy vodíku (kladný náboj) přitahuje stranu s kyslíkem (záporný náboj) jiné molekuly vody.
Všechny tyto navzájem se přitahující molekuly vody mají tendenci se shlukovat. Proto jsou kapky vody vlastně kapkami! Nebýt některých zemských sil, například gravitace, měla by kapka vody tvar koule – dokonalé koule. I když na Zemi netvoří dokonalou kouli, měli bychom být rádi, že je voda lepkavá.
Voda se nazývá „univerzální rozpouštědlo“, protože rozpouští více látek než jakákoli jiná kapalina. To znamená, že kamkoli se voda dostane, ať už zemí nebo naším tělem, bere s sebou cenné chemické látky, minerály a živiny.
Čistá voda má neutrální pH. Čistá voda má pH, přibližně 7, které není ani kyselé, ani zásadité.
Fyzikální vlastnosti vody:
Voda je jedinečná v tom, že je jedinou přírodní látkou, která se při teplotách obvyklých na Zemi vyskytuje ve všech třech skupenstvích – kapalném, pevném (led) i plynném (pára). Voda na Zemi se neustále vzájemně ovlivňuje, mění a je v pohybu.
 Voda mrzne při teplotě 32° Fahrenheita (F) a vře při teplotě 212° F. Bod mrznutí a varu vody je ve skutečnosti základním bodem, podle kterého se měří teplota: 0° na Celsiově stupnici je bod mrznutí vody a 100° je bod varu vody. Voda je neobvyklá tím, že pevná forma, led, má menší hustotu než kapalná forma, a proto led plave.
Voda mrzne při teplotě 32° Fahrenheita (F) a vře při teplotě 212° F. Bod mrznutí a varu vody je ve skutečnosti základním bodem, podle kterého se měří teplota: 0° na Celsiově stupnici je bod mrznutí vody a 100° je bod varu vody. Voda je neobvyklá tím, že pevná forma, led, má menší hustotu než kapalná forma, a proto led plave.
Voda má vysoký měrný tepelný index. To znamená, že voda může absorbovat velké množství tepla, než se začne zahřívat. Proto je voda cenná pro průmysl a v chladiči automobilu jako chladicí kapalina. Vysoký index měrného tepla vody také pomáhá regulovat rychlost, s jakou se mění teplota vzduchu, a proto jsou změny teploty mezi ročními obdobími spíše postupné než náhlé, zejména v blízkosti oceánů.
Voda má velmi vysoké povrchové napětí. Jinými slovy, voda je lepkavá a pružná a má tendenci se shlukovat do kapek, místo aby se rozprostřela do tenkého filmu. Povrchové napětí je zodpovědné za kapilární děje, které umožňují vodě (a v ní rozpuštěným látkám) pohybovat se kořeny rostlin a drobnými cévami v našem těle.
Teplota vody:
Teplota vody je důležitá nejen pro plavce a rybáře, ale také pro průmysl a dokonce i pro ryby a řasy. Hodně vody se používá k chlazení v elektrárnách, které vyrábějí elektřinu. Na začátku potřebují chladnou vodu a teplou vodu zpravidla vypouštějí zpět do prostředí. Teplota vypouštěné vody může ovlivnit stanoviště níže po proudu. Teplota může také ovlivnit schopnost vody zadržovat kyslík a také schopnost organismů odolávat některým znečišťujícím látkám.
pH:
pH je měřítkem toho, jak kyselá/základní je voda. Rozsah je od 0 do 14, přičemž 7 je neutrální. pH nižší než 7 znamená kyselost, zatímco pH vyšší než 7 znamená zásaditost. pH je ve skutečnosti mírou relativního množství volných vodíkových a hydroxylových iontů ve vodě. Voda, která má více volných vodíkových iontů, je kyselá, zatímco voda, která má více volných hydroxylových iontů, je zásaditá. Protože pH mohou ovlivňovat chemické látky obsažené ve vodě, je pH důležitým ukazatelem vody, která se chemicky mění. pH se uvádí v „logaritmických jednotkách“, podobně jako Richterova stupnice, která měří zemětřesení. Každé číslo představuje desetinásobnou změnu kyselosti/základnosti vody. Voda s pH 5 je desetkrát kyselejší než voda s pH 6.
Znečištění může změnit pH vody, což následně může poškodit živočichy a rostliny žijící ve vodě. Například voda vytékající z opuštěného uhelného dolu může mít pH 2, což je velmi kyselé a rozhodně by to mělo vliv na všechny ryby, které by byly natolik bláznivé, že by se v ní pokusily žít! Podle logaritmické stupnice by tato důlní voda byla 100 000krát kyselejší než voda neutrální – proto se opuštěným dolům vyhýbejte.
Specifická vodivost:
Specifická vodivost je měřítkem schopnosti vody vést elektrický proud. Je velmi závislá na množství rozpuštěných pevných látek (například soli) ve vodě. Čistá voda, například destilovaná, má velmi nízkou měrnou vodivost a mořská voda má vysokou měrnou vodivost. Dešťová voda často rozpouští vzdušné plyny a prach, když je ve vzduchu, a proto má často vyšší měrnou vodivost než destilovaná voda. Specifická vodivost je důležitým měřením kvality vody, protože poskytuje dobrou představu o množství rozpuštěných látek ve vodě.
Pravděpodobně jste ve škole dělali pokus, při kterém jste připojili baterii k žárovce a vedli dva dráty od baterie do kádinky s vodou. Když dráty vložíte do kádinky s destilovanou vodou, žárovka se nerozsvítí. Když však kádinka obsahuje slanou vodu (solný roztok), žárovka se rozsvítí. Ve slané vodě se sůl rozpustila, uvolnila volné elektrony a voda povede elektrický proud.
Vlhkost:
Vlhkost je mírou zakalení vody. Měří se tak, že vodou prochází paprsek světla a sleduje se, kolik se ho odrazí od částic ve vodě. Zákal vody je způsoben materiálem, jako jsou nečistoty a zbytky listí, který je suspendován (plave) ve vodě. Křišťálově čistá voda, jako je například jezero Tahoe (kde se usilovně pracuje na tom, aby se do jezera nevyplavovaly sedimenty), má velmi nízký zákal. Podívejte se však na řeku po bouřce – je pravděpodobně hnědá. Ve vodě je vidět veškerá suspendovaná zemina. Naštěstí pro nás se materiály, které způsobují zákal v pitné vodě, buď usazují, nebo jsou filtrovány dříve, než se voda dostane do naší domácí sklenice. Zákal se měří v nefelometrických jednotkách zákalu (NTU).
Rozpuštěný kyslík:
Ačkoli molekuly vody obsahují atom kyslíku, tento kyslík není tím, co potřebují vodní organismy žijící v našich přírodních vodách. Ve vodě je ve skutečnosti rozpuštěno malé množství kyslíku, přibližně do deseti molekul kyslíku na milion vody. Tento rozpuštěný kyslík dýchají ryby a zooplankton a potřebují ho ke svému přežití.
Rychle se pohybující voda, například v horském potoce nebo velké řece, obvykle obsahuje hodně rozpuštěného kyslíku, zatímco stojatá voda ho obsahuje málo. Proces, při kterém bakterie ve vodě pomáhají rozkládat organické látky, například ty, které pocházejí z čistíren odpadních vod, spotřebovává kyslík. Nadbytek organického materiálu v našich jezerech a řekách tak může způsobit situaci s nedostatkem kyslíku. Vodní organismy mohou mít potíže ve stojaté vodě s velkým množstvím hnijícího organického materiálu, zejména v létě, kdy je hladina rozpuštěného kyslíku na sezónně nízké úrovni.
Tvrdost:
Množství rozpuštěného vápníku a hořčíku ve vodě určuje její „tvrdost“. Tvrdost vody se ve Spojených státech liší. Pokud žijete v oblasti, kde je voda „měkká“, pak jste o tvrdosti vody možná nikdy ani neslyšeli. Pokud však žijete na Floridě, v Novém Mexiku, Arizoně, Utahu, Wyomingu, Nebrasce, Jižní Dakotě, Iowě, Wisconsinu nebo Indianě, kde je voda poměrně tvrdá, můžete si všimnout, že při mytí rukou nebo oblečení je obtížné vytvořit pěnu. A průmyslové podniky ve vaší oblasti mohou být nuceny vydávat peníze na změkčení vody, protože tvrdá voda může poškodit zařízení. Tvrdá voda může dokonce zkrátit životnost tkanin a oblečení! Znamená to, že studenti, kteří žijí v oblastech s tvrdou vodou, drží krok s nejnovější módou, protože jejich oblečení se rychleji opotřebovává?
Suspendovaný sediment:
Suspendovaný sediment je množství půdy pohybující se v toku. Je velmi závislé na rychlosti proudění vody, protože rychle tekoucí voda může zachytit a suspendovat více půdy než voda klidná. Při bouřkách je půda splachována z břehů do toku. Množství splavené zeminy do toku závisí na typu půdy v povodí řeky a na vegetaci, která řeku obklopuje.
Pokud je půda podél toku narušena a nejsou přijata ochranná opatření, může nadbytek sedimentů poškodit kvalitu vody v toku. Pravděpodobně jste už viděli ty krátké plastové ploty, které stavitelé staví na okrajích pozemků, na nichž staví. Tyto ploty mají za úkol zachytit sedimenty při dešti a zabránit jejich vyplavení do potoka, protože nadbytek sedimentů může poškodit potoky, řeky, jezera a nádrže.
Sedimenty, které se dostanou do nádrže, jsou vždy problémem; jakmile se dostanou dovnitř, nemohou se dostat ven – většina z nich se usadí na dně. Nádrže se mohou „zanášet“, pokud se do nich dostane příliš mnoho sedimentů. Objem nádrže se zmenší, což má za následek zmenšení plochy pro plavbu lodí, rybolov a rekreaci a také snížení schopnosti elektrárny v přehradě vyrábět elektřinu.
Geochemie vodných roztoků:
Podívejte se na schéma hydrogeochemického cyklu.
- Kyselina = látka obsahující vodík, která při rozpuštění ve vodě dává volný vodík (H + )
- Zásada = látka obsahující skupinu OH, která při rozpuštění ve vodě dává volný (OH – )
-
Roztok kyseliny je roztok obsahující přebytek volného H + , zásada je roztok obsahující přebytek volného OH – . Reakce mezi kyselinou a zásadou se obvykle nazývá neutralizace.
Např:
-
HCl (kyselina) + NaOH (zásada) ==> H 2 O + NaCl
které jsou disociovány na ionty:
H + + Cl – + Na + + OH – ==> H 2 O + Na + + Cl – - tj. Na + a Cl – nejsou ovlivněny.
- pH = inverzní logaritmus koncentrace (aktivity) volného H + , neboli pH = -log
-
Voda disociuje na H + a OH – ;
-
disociační konstanta je: K vody = =10 -14
- V kilogramu neutrálního roztoku při standardní teplotě 25 °C musí být tedy 10 -7 molů H+ a OH -. Jeden mol je 6,023 x 10 23 atomů (nebo molekul) a molekulová hmotnost H 2 O je 18 gramů na mol. V jednom kilogramu vody je přibližně 1000/18 = 55,6 molů vody nebo přibližně 3,35 x 10 25 atomů kyslíku a přibližně dvojnásobný počet (6,7 x 10 25 atomů) H + (množství volného H + nebo volného OH – je relativně malé ve srovnání s množstvím nedisociovaného H 2 O).
- pH se při 25 °C pohybuje v rozmezí 0 až 14; pH < 7 = kyselý roztok; pH > 7 = zásaditý roztok. Pokud se přidá HCl nebo jiná kyselina, pH se sníží; pokud se přidá NaOH nebo jiná zásada, pH se zvýší.
- pH se zvyšuje při disociaci kyseliny uhličité (slabé kyseliny): Když se oxid uhličitý spojí s vodou, k čemuž dochází například v atmosféře při spalování fosilních paliv, vzniká kyselina uhličitá: H 2 O + CO 2 ==> H 2 CO 3 . Při postupných disociacích se uvolňují volné H +:
-
H 2 CO 3 ==> H + + HCO 3- kyselina uhličitá na hydrogenuhličitan, vzniká při pH ~6,4
-
HCO 3 ==> H + + CO 32- hydrogenuhličitan na uhličitan, vzniká při pH ~10.3
Nezapomeňte, že volný H + je k dispozici pouze při kyselém prostředí nebo při pH < ~7. K disociaci hydrogenuhličitanu na uhličitan dochází, když je v systému příliš mnoho OH – a H + se „uvolňuje“, aby se vyrovnala zásada.
- Rozpuštěné kationty a anionty ve vodě
Kationty = donory elektronů, kladně nabité: Na + , K + , Mg ++ , Ca ++ , Fe ++ nebo Fe +++ , Mn ++ , Al +++
Anionty = akceptory elektronů, záporně nabité: Cl – , F – , I – , Br – , SO 4– , CO 3– , HCO 3- , NO 3– , NO 2-
Kovy = chovají se většinou jako kationty: Cu, Zn, Pb, Co, Ni, Cr, As, Se, Mo atd.
- Analýzy vody – je třeba mít kationtovo-aniontovou bilanci
miliekvivalent (MEQ) = molový ekvivalent náboje nebo aniontu či kationtu, míra celkového náboje způsobeného daným iontem rozpuštěným v roztoku. Vycházejte z koncentrace, vydělte molární hmotností a vynásobte nábojem: XX mg/l / MW x CHG = MEQ
Příklad: NaCl v roztoku, Na = 50 mg/l (50 ppm): 50/23 x 1 = 2,17 MEQ
Cl = 77 mg/l (77 ppm): 77/35,5 x -1 = -2,17 MEQ
Pokud tedy celkové MEQ kationtů a aniontů nejsou vyvážené, existuje v analýze určitá chyba.