Cíle výuky
- Rozšířit dříve zavedené rovnovážné pojmy na kyseliny a zásady, které mohou darovat nebo přijímat více než jeden proton
K pochopení acidobazických vlastností roztoků solí můžeme využít i relativní síly konjugovaných dvojic kyseliny a zásady. Neutralizační reakci lze definovat jako reakci kyseliny a zásady za vzniku soli a vody. To znamená, že jiný kationt, například \(Na^+\), nahradí proton kyseliny. Příkladem je reakce \(\ce{CH3CO2H}\), slabé kyseliny, s \(\ce{NaOH}\), silnou zásadou:
\
V závislosti na acidobazických vlastnostech jejích složkových iontů se však sůl může rozpouštět ve vodě za vzniku neutrálního roztoku, zásaditého roztoku nebo kyselého roztoku.
Při rozpuštění soli, například \(NaCl\), ve vodě vznikají ionty \(Na^+_{(aq)}\) a \(Cl^-_{(aq)}\). Podle Lewisova přístupu lze iont \(Na^+\) považovat za kyselinu, protože je akceptorem elektronového páru, ačkoli jeho nízký náboj a relativně velký poloměr z něj činí velmi slabou kyselinu. Iont \(Cl^-\) je konjugovanou zásadou silné kyseliny \(HCl\), takže v podstatě nemá zásaditý charakter. Proto nemá rozpuštění \(NaCl\) ve vodě žádný vliv na \(pH\) roztoku a roztok zůstává neutrální.
Nyní porovnejme toto chování s chováním vodných roztoků kyanidu draselného a octanu sodného. Kationty (\(K^+\) a \(Na^+\)) opět nemají v podstatě kyselý charakter, ale anionty (\(CN^-\) a \(CH_3CO_2^-\)) jsou slabé zásady, které mohou reagovat s vodou, protože jsou konjugovanými zásadami slabých kyselin \(HCN\) a kyseliny octové.
\
\
Žádná z těchto reakcí neprobíhá příliš vpravo, jak je zapsáno, protože je upřednostňována tvorba slabšího páru kyseliny a zásady. Jak \(HCN\), tak kyselina octová jsou silnější kyseliny než voda a hydroxid je silnější zásada než octan nebo kyanid, takže v obou případech leží rovnováha vlevo. Nicméně každá z těchto reakcí vytváří dostatečné množství hydroxidových iontů, aby vznikl zásaditý roztok. Například hodnota \(pH\) 0,1 M roztoku octanu sodného nebo kyanidu draselného při teplotě 25 °C je 8,8, resp. 11,1. Z tabulek E1 a E2 vidíme, že \(CN^-\) je silnější zásada (\(pK_b = 4,79\)) než octan (\(pK_b = 9,24\)), což odpovídá tomu, že \(KCN\) vytváří zásaditější roztok než octan sodný při stejné koncentraci.
Naopak konjugovaná kyselina slabé zásady by měla být slabou kyselinou. Například chlorid amonný a pyridiniumchlorid jsou soli vzniklé reakcí amoniaku a pyridinu s \(HCl\). Jak již víte, chloridový iont je tak slabá zásada, že nereaguje s vodou. Naproti tomu kationty těchto dvou solí jsou slabé kyseliny, které reagují s vodou takto:
\
\
Obrázek \(\PageIndex{2}\) ukazuje, že \(H_3O^+\) je silnější kyselina než \(NH_4^+\) nebo \(C_5H_5NH^+\), a naopak amoniak i pyridin jsou silnější zásady než voda. Rovnováha bude proto v obou případech ležet daleko vlevo, ve prospěch slabšího páru kyselina-látka. Koncentrace \(H_3O^+\) vznikající při reakcích je však dostatečně velká na to, aby výrazně snížila \(pH\) roztoku: \(pH\) 0,10 M roztoku chloridu amonného nebo pyridiniumchloridu při teplotě 25 °C je 5,13, resp. 3,12.
Co se děje s vodnými roztoky soli, jako je octan amonný, kde kationt i aniont mohou samostatně reagovat s vodou za vzniku kyseliny, resp. zásady? Podle obrázku 16.10 amonný ion sníží hodnotu \(pH\), zatímco podle obrázku 16.9 octanový ion zvýší hodnotu \(pH\). Tento konkrétní případ je neobvyklý, protože kationt je stejně silná kyselina jako aniont je zásada (pKa ≈ pKb). V důsledku toho se oba účinky ruší a roztok zůstává neutrální. U solí, ve kterých je kationt silnější kyselinou než aniont zásadou, má výsledný roztok hodnotu \(pH\) < 7,00. Naopak, pokud je kationt slabší kyselinou než aniont zásadou, má výsledný roztok hodnotu \(pH\) > 7,00.
Kyselé ionty kovů
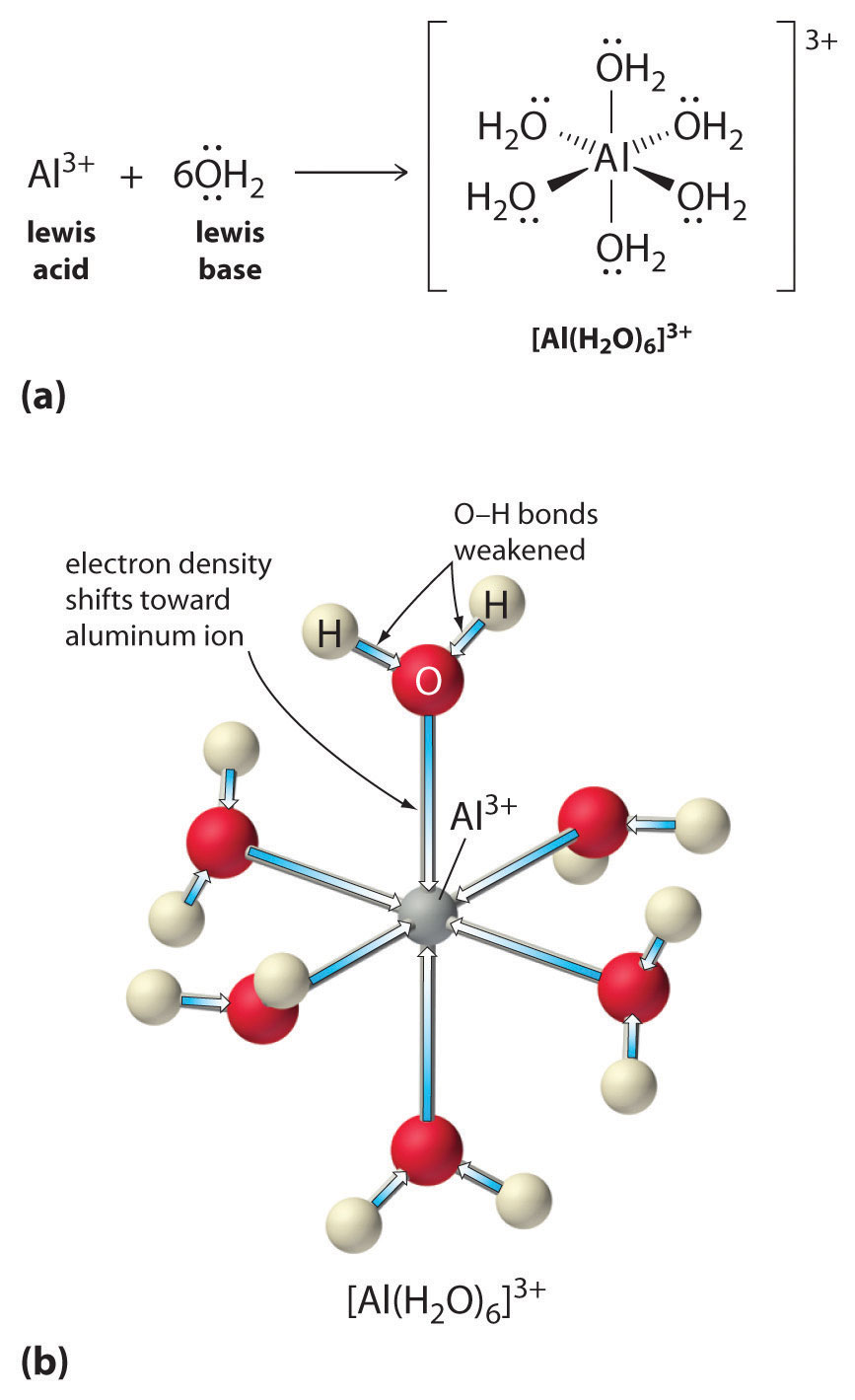
Roztoky jednoduchých solí iontů kovů mohou být také kyselé, i když ionty kovů nemohou darovat proton přímo vodě za vzniku \(H_3O^+\). Místo toho může kovový ion působit jako Lewisova kyselina a interagovat s vodou, Lewisovou zásadou, koordinací s osamělým párem elektronů na atomu kyslíku za vzniku hydratovaného kovového iontu (obrázek \(\PageIndex{1a}\)). Molekula vody koordinovaná s kovovým iontem je kyselejší než volná molekula vody, a to ze dvou důvodů. Zaprvé, odpudivé elektrostatické interakce mezi kladně nabitým kovovým iontem a částečně kladně nabitými atomy vodíku koordinované molekuly vody usnadňují koordinované vodě ztrátu protonu.
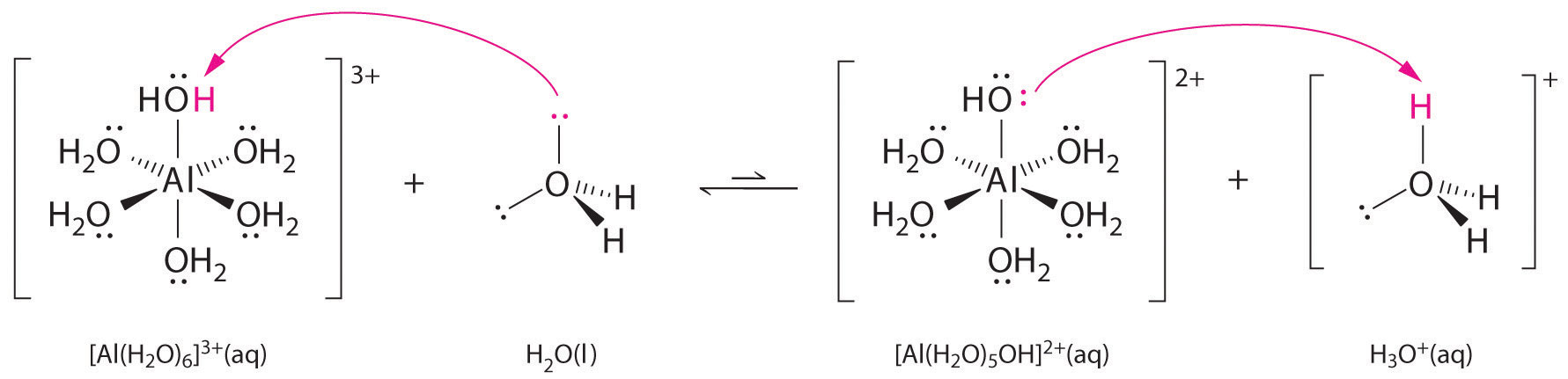
Druhé, kladný náboj iontu \(Al^{3+}\) přitahuje elektronovou hustotu z atomů kyslíku molekul vody, což snižuje elektronovou hustotu ve vazbách \(\ce{O-H}\), jak je znázorněno na obrázku \(\PageIndex{1b}\). S menší elektronovou hustotou mezi atomy \(O\) a atomy H jsou vazby \(\ce{O-H}\) slabší než ve volné molekule \(H_2O\), což usnadňuje ztrátu iontu \(H^+\).
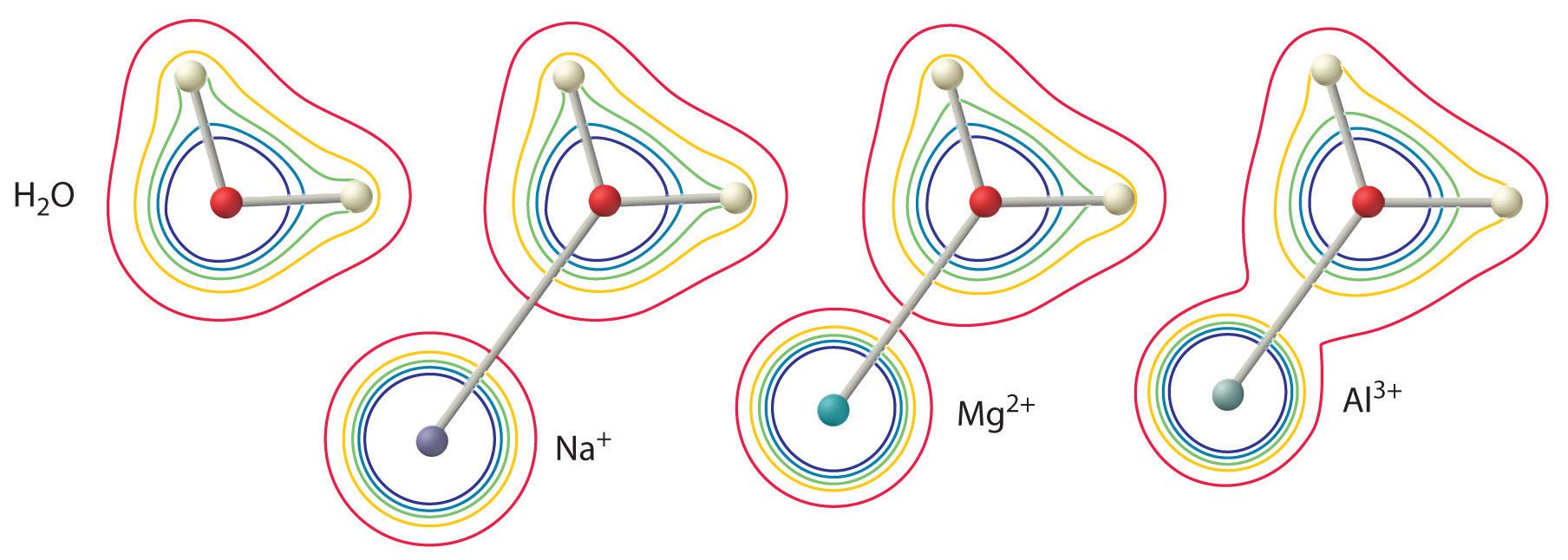
Velikost tohoto efektu závisí na následujících dvou faktorech (obrázek \(\PageIndex{3}\)):
- Náboj na iontu kovu. Dvousložkový ion (\(M^{2+}\)) má přibližně dvakrát silnější vliv na elektronovou hustotu v koordinované molekule vody než jednosložkový ion (\(M^+\)) o stejném poloměru.
- Poloměr iontu kovu. Pro ionty kovů se stejným nábojem platí, že čím menší je ion, tím kratší je mezijaderná vzdálenost k atomu kyslíku molekuly vody a tím větší je vliv kovu na rozložení elektronové hustoty v molekule vody.
Vodné roztoky malých, vysoce nabitých iontů kovů, jako jsou \(Al^{3+}\) a \(Fe^{3+}\), jsou tedy kyselé:
\^{3+}_{(aq)} \rightleftharpoons ^{2+}_{(aq)}+H^+_{(aq)} \label{16.36}\]
Iont \(^{3+}\) má \(pK_a\) 5,0, takže je téměř stejně silnou kyselinou jako kyselina octová. Vzhledem k oběma dříve popsaným faktorům je nejdůležitějším parametrem pro předpověď vlivu iontu kovu na kyselost koordinovaných molekul vody poměr náboje a poloměru iontu kovu. Řada dvojic kovových iontů, které leží na diagonální přímce periodické tabulky, například \(Li^+\) a \(Mg^{2+}\) nebo \(Ca^{2+}\) a \(Y^{3+}\), má různé velikosti a náboje, ale podobný poměr náboje k poloměru. V důsledku toho mají tyto dvojice kovových iontů podobný vliv na kyselost koordinovaných molekul vody a často vykazují i další významné chemické podobnosti.
Kyselé kovové ionty
Roztoky malých, vysoce nabitých kovových iontů ve vodě jsou kyselé.
Reakce, o kterých pojednává tato část a při kterých sůl reaguje s vodou za vzniku kyselého nebo zásaditého roztoku, se často nazývají hydrolýzní reakce. Používání samostatného názvu pro tento typ reakcí je nešťastné, protože naznačuje, že jsou nějak odlišné. Ve skutečnosti jsou hydrolýzní reakce pouze acidobazické reakce, při nichž je kyselina kationtem nebo zásada aniontem; řídí se stejnými principy a pravidly jako všechny ostatní acidobazické reakce.
Hydrolýza
Hydrolýza je acidobazická reakce.
Příklad \(\PageIndex{1}\)
Předpovězte, zda jsou vodné roztoky těchto sloučenin kyselé, zásadité nebo neutrální.
- \(KNO_3\)
- \(CrBr_3 \cdot H_2O\)
- \(Na_2SO_4\)
Dáno: sloučenina
Zadáno: Kyselost nebo zásaditost vodného roztoku
Strategie:
- Ohodnoťte acidobazické vlastnosti kationtu a aniontu. Pokud je kationt slabou Lewisovou kyselinou, neovlivní \(pH\) roztoku. Pokud je však kationt konjugovanou kyselinou slabé zásady nebo relativně silně nabitého kationtu kovu, bude reagovat s vodou za vzniku kyselého roztoku.
- Je-li aniont konjugovanou zásadou silné kyseliny, neovlivní \(pH\) roztoku. Je-li však aniontem konjugovaná báze slabé kyseliny, bude roztok zásaditý.
Roztok:
a
- Kationt \(K^+\) má malý kladný náboj (+1) a poměrně velký poloměr (protože je ve čtvrtém řádku periodické tabulky), takže je to velmi slabá Lewisova kyselina.
- Aniont \(NO_3-\) je konjugovaná báze silné kyseliny, takže v podstatě nemá zásaditý charakter (tabulka 16.1). Proto ani kationt, ani aniont nebudou reagovat s vodou za vzniku \(H^+\) nebo \(OH^-\) a roztok bude neutrální.
b.
- Iont \(Cr^{3+}\) je poměrně silně nabitý kationt kovu, který by se měl chovat podobně jako ion \(Al^{3+}\) a tvořit komplex 3+, který se bude chovat jako slabá kyselina: \^{3+}_{(aq)} \ce{ <=>>} Cr(H_2O)_5(OH)]^{2+}_{(aq)} + H^+_({aq)}\]
- Aniont \(Br^-\) je velmi slabá zásada (je konjugovanou zásadou silné kyseliny \(HBr\)), takže nemá vliv na \(pH\) roztoku. Proto bude roztok kyselý.
c.
- Iont \(Na^+\) je stejně jako \(K^+\) velmi slabou kyselinou, takže by neměl ovlivnit kyselost roztoku.
- Naproti tomu \(SO_4^{2-}\) je konjugovanou zásadou \(HSO_4^-\), což je slabá kyselina. Proto bude iont \(SO_4^{2-}\) reagovat s vodou podle obrázku 16.6 za vzniku slabě zásaditého roztoku.
Cvičení \(\PageIndex{1}\)
Předpovězte, zda jsou vodné roztoky následujících látek kyselé, zásadité nebo neutrální.
- \(KI\)
- \(Mg(ClO_4)_2\)
- \(NaHS\)
Odpověď a
neutrální
Odpověď b
kyselý
Odpověď c
zásaditý (v důsledku reakci \(HS^-\) s vodou za vzniku \(H_2S\) a \(OH^-\))
Shrnutí
Sůl se může rozpouštět ve vodě za vzniku neutrální, zásaditý nebo kyselý roztok podle toho, zda obsahuje konjugovanou zásadu slabé kyseliny jako anion (\(A^-\)), konjugovanou kyselinu slabé zásady jako kation (\(BH^+\)) nebo obojí. Soli, které obsahují malé, vysoce nabité ionty kovů, vytvářejí ve vodě kyselé roztoky. Reakce soli s vodou za vzniku kyselého nebo zásaditého roztoku se nazývá hydrolýza.
.