INTRODUCCIÓN
La hipercolesterolemia familiar heterocigota (HF) es un trastorno genético común asociado a la enfermedad cardiovascular aterosclerótica (ECV) prematura. Los niños con HF no tratada tienen un mayor riesgo de padecer una ASCVD prematura después de los 20 años de edad.1 La elevación severa de los niveles de colesterol de lipoproteínas de baja densidad (LDL-C) comienza en el feto y conduce a una exposición sostenida de la pared arterial al LDL-C, lo que acelera el depósito de colesterol y la inflamación vascular y predispone al inicio temprano de la aterosclerosis, especialmente en las arterias coronarias y la aorta.
Las estatinas y otras terapias hipolipemiantes (LLT) reducen eficazmente el LDL-C, son seguras en niños y adolescentes y restauran la función endotelial a una edad temprana.2-Recientemente, se ha propuesto el cribado universal de los niños a partir de los 2 años y antes de los 8 años de edad5,6 para detectar a los individuos que requieren tratamiento. Sin embargo, este enfoque se basa en consideraciones teóricas y no ha sido probado en la vida real.
Sin embargo, se conoce poco sobre las características de los pacientes con HF menores de 18 años, el TRL utilizado en estos pacientes y los objetivos lipídicos alcanzados en la vida real. El déficit de información es aún mayor para los datos de seguimiento. Los registros nacionales pueden utilizarse para proporcionar esta información crucial, que es necesaria para mejorar los modelos de atención a la HF, los protocolos terapéuticos y la política sanitaria.7,8 El SpAnish Familial HypErcHolEsterolaemiA CohoRt STudy (SAFEHEART) (NCT02693548) fue diseñado para mejorar el conocimiento de los factores pronósticos y los mecanismos que influyen en el desarrollo de la ASCVD y la mortalidad en una población con HF.
Nuestro objetivo fue analizar las características de los pacientes y evaluar los objetivos de HL y de lípidos en el momento de la inclusión y durante el seguimiento de los pacientes con HF menores de 18 años inscritos en SAFEHEART y determinar los factores que predicen la probabilidad de alcanzar estos objetivos.
METODODiseño del estudio y población
SAFEHEART es un estudio de cohortes abierto, multicéntrico, nacional y prospectivo a largo plazo en una población con HF definida molecularmente en España. El reclutamiento de participantes de familias con HF comenzó en 2004 y sigue en curso. Los criterios de inclusión fueron los casos índice con diagnóstico genético de HF y sus familiares mayores de 15 años con diagnóstico genético de HF, así como sus familiares sin diagnóstico genético de HF (grupo de control). No obstante, también se incluyeron participantes menores de 15 años, si lo solicitaban sus padres. Este estudio fue aprobado por los comités éticos locales. Todos los individuos elegibles y/o al menos uno de sus padres o tutores legales dieron su consentimiento informado por escrito. Un centro coordinador con sede en Madrid, España, se encargó de gestionar el seguimiento de los participantes. Los pacientes y/o sus padres fueron contactados anualmente mediante una llamada telefónica estandarizada para registrar los cambios relevantes en los hábitos de vida y la medicación y cualquier evento cardiovascular u otros problemas médicos. Los médicos participantes que inscribían a los pacientes y sus familias en este registro recibieron formación, con directrices de buenas prácticas reforzadas en reuniones anuales a las que asistieron médicos expertos en la materia; además, se utilizó un programa basado en la electrónica y el asesoramiento telefónico y se desplegó un programa de formación basado en la web para apoyar aún más la gestión cuando fuera necesario. Las decisiones de tratamiento fueron tomadas exclusivamente por el médico de cada paciente.
Medidas clínicas y de laboratorio
Las características demográficas y clínicas se registraron tal y como se describe en otro lugar.9 Se tomaron muestras de sangre venosa tras 12 horas de ayuno. Las muestras de suero, plasma y ADN se alicuotaron y se conservaron a -80°C. Los niveles séricos de colesterol total, triglicéridos y colesterol de lipoproteínas de alta densidad (HDL-C) se midieron en un laboratorio central utilizando métodos enzimáticos. La concentración sérica de LDL-C se calculó mediante la fórmula de Friedewald. El ADN se aisló de la sangre total utilizando métodos estándar y la HF se diagnosticó genéticamente utilizando un microarray de ADN.10 Los objetivos de C-LDL se definieron de acuerdo con las recomendaciones y objetivos recientes. El objetivo principal fue el colesterol de lipoproteínas de baja densidad
mg/dL.11 Un objetivo alternativo para los pacientes menores de 14 años consistió en el C-LDL mg/dL en ausencia de cualquier otro factor de riesgo cardiovascular (tabaquismo, C-HDL mg/dL, lipoproteína (a) > 50mg/dL, o C-LDL 250mg/dL) o enfermedad cardiovascular prematura en los progenitores o abuelos.6 La ASCVD familiar prematura se definió como la aparición de un primer evento antes de los 55 años de edad en los hombres y antes de los 65 años de edad en las mujeres.Clasificación del tratamiento hipolipemiante
La dosis máxima de estatinas se definió como atorvastatina 40 a 80mg/d o rosuvastatina 20 a 40mg/d, que se consideraron dosis de estatinas de alta intensidad. El tratamiento combinado máximo se definió como la dosis máxima de estatinas más ezetimiba 10 mg/día. El LLT máximo se definió como cualquier LLT que se esperaba que produjera al menos una reducción del 50% en los niveles basales de LDL-C: simvastatina 20, 40 u 80 mg/d más ezetimiba 10 mg/d; pravastatina 40 mg/d en combinación con ezetimiba 10 mg/d; fluvastatina 80 mg/d más ezetimiba 10 mg/d; atorvastatina 40 u 80 mg/d con o sin ezetimiba 10 mg/d; atorvastatina 10 ó 20 mg/d más ezetimiba 10 mg/d; rosuvastatina 20 ó 40 mg/d con o sin ezetimiba 10 mg/d; rosuvastatina 10 mg/d más ezetimiba 10 mg/d; y pitavastatina 4 mg/d en combinación con ezetimiba 10 mg/d.12,13
Análisis genético
Las mutaciones del receptor de colesterol de lipoproteínas de baja densidad (LDLR) se clasificaron según su efecto conocido sobre la función de la proteína del receptor de LDL como mutaciones nulas (receptor-negativo) y defectuosas (receptor-defectuoso), tal como se describió previamente.14 Las variantes que conducen a la ausencia completa o al truncamiento de la proteína (pérdida de función) demostrada mediante análisis funcional in vitro o análisis de simulación por ordenador se clasificaron como receptor-negativo. Estas variantes incluían las siguientes: a) mutaciones puntuales que causaban un codón de parada prematuro; b) mutaciones sin sentido que afectaban a la quinta repetición rica en cisteína en el dominio de unión al ligando del gen del receptor de LDL-C (mutación de clase 2A); c) pequeñas deleciones o inserciones que causaban un cambio de marco y un codón de parada prematuro; y d) grandes reordenamientos. Las mutaciones defectuosas para el receptor fueron las restantes mutaciones puntuales infraordenadas y las pequeñas deleciones e inserciones infraordenadas. Todas las mutaciones sin análisis de funcionalidad conocida mediante estudios in vitro o análisis de simulación por ordenador se clasificaron como «funcionalidad desconocida» porque no podíamos estar seguros de si el efecto sobre el receptor era negativo o defectuoso; sin embargo, se consideraron patógenas porque todos los individuos portadores de 1 de estas mutaciones tenían hipercolesterolemia, mientras que los familiares sin la mutación tenían niveles normales de colesterol.14
Análisis estadístico
Los análisis estadísticos se realizaron con el programa SPSS versión 18.0 (SPSS Inc, Chicago, Illinois, Estados Unidos). La normalidad de la distribución de las variables se analizó con la prueba de Kolmogorov-Smirnov. Los datos cuantitativos se expresan como mediana y rango intercuartil (RIC) y los cualitativos como número absoluto y porcentaje. Se definieron dos poblaciones: la población al ingreso (n = 241) y la población en el seguimiento (también conocida como cohorte), que incluía a los pacientes que tenían un perfil lipídico plasmático completo en el seguimiento (n = 217). Todas las comparaciones entre el ingreso y el seguimiento se realizaron en el estudio de cohorte. Las comparaciones de frecuencias entre variables cualitativas se realizaron mediante la prueba de chi-cuadrado. Los cambios en las variables binarias se analizaron mediante la prueba de McNemar. Los valores de la mediana de las variables cuantitativas se compararon con la prueba no paramétrica de Mann-Whitney o la prueba de rangos con signo de Wilcoxon emparejados, según el caso. Se realizó un análisis de regresión logística binaria hacia delante en el estudio de cohortes para determinar las variables asociadas al uso de estatinas. Se incluyeron las variables que resultaron estadísticamente significativas en los análisis univariantes, así como los predictores y factores de confusión a priori: edad, sexo y seguimiento en un entorno primario/especializado. Se realizó otro análisis de regresión logística binaria hacia delante en el estudio de cohortes, excluyendo a los pacientes que alcanzaron el objetivo al inicio, para determinar las variables asociadas a la consecución de un C-LDL
mg/dL. Se incluyeron las variables que fueron estadísticamente significativas en los análisis univariantes, así como los predictores y factores de confusión a priori: edad, sexo, tipo de mutación (nula o defectuosa), uso de ezetimiba y seguimiento en un entorno primario/especializado. Las diferencias se consideraron estadísticamente significativas a P RESULTADOS
Hasta la fecha, se han inscrito 4141 participantes en el registro SAFEHEART; 392 son menores de 18 años. De ellos, 241 tienen una confirmación molecular de HF, con 217 seguidos con un perfil lipídico completo (90,0%) (Figura 1). Veinticuatro pacientes fueron omitidos del análisis debido a la falta de un perfil lipídico completo durante el seguimiento. El seguimiento se realizó en un entorno de atención primaria para 40 pacientes (18,4%). La mediana del tiempo de seguimiento fue de 4,69 años (IQR, 2,48-6,38 años).
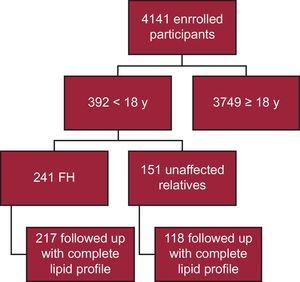
Flujograma esquemático del estudio. HF, hipercolesterolemia familiar.
En el momento de la inscripción (la población de entrada), 129 pacientes con HF (53,5%) eran hombres. La edad media era de 15,0 años (IQR, 14,0-16,0 años). Los dos pacientes más jóvenes tenían 8 años. Los antecedentes de ECV no estaban presentes en ningún paciente y la ECV familiar prematura estaba presente en 40 (16,6%). Las características basales se describen en la Tabla 1. En la tabla 1 se muestra una comparación de las características basales en el momento de la inclusión entre los pacientes de la cohorte y los que no fueron objeto de seguimiento. No se encontraron diferencias significativas entre los 2 grupos. Ningún paciente tenía antecedentes de ASCVD, hipertensión arterial o diabetes mellitus. Una mayor proporción del grupo sin seguimiento fue manejada en el ámbito de la atención primaria, aunque la diferencia no fue estadísticamente significativa. En la cohorte, se produjeron reducciones significativas de las concentraciones plasmáticas de colesterol total, C-LDL, triglicéridos y C-no-HDL; también se observó un aumento significativo del C-HDL durante el seguimiento (tabla 2).
Características basales de la población de entrada
| Pacientes con HF con seguimiento Mediana (IQR)/número. (%) |
Pacientes con HF sin seguimiento Mediana (IQR)/no. (%) |
P | |
|---|---|---|---|
| Número | 217 | 24 | |
| Sexo (masculino) | 117 (53,9%) | 12 (50%) | .72 |
| Edad, y | 15,0 (14,0-16,0) | 15,0 (13,0-15,8) | .06 |
| Ascenso familiar prematuro | 36 (16,6%) | 4 (16,7%) | 1.00 |
| Fumador de tabaco activo | 13 (6,0%) | 2 (8,3%) | .65 |
| Xantomas | 1 (0,5%) | 0 (0,0%) | .99 |
| Arco corneal | 6 (2,8%) | 1 (4,2%) | .53 |
| IMC, kg/m2 | 21,09 (19,40-22,80) | 20,79 (17,80-22,70) | .64 |
| Contorno de cintura, cm | 72,0 (66,0-78,0) | 72,0 (66,0-75,8) | .94 |
| Colesterol total, mg/dL | 223,5 (194,0-262.3) | 217,5 (194,5-277,5) | .76 |
| Colesterol LDL, mg/dL | 162,6 (133.0-195,8) | 153,9 (13,1-209,3) | .71 |
| HDL-C, mg/dL | 49.0 (42,8-55,0) | 48,5 (41,5-56,0) | .96 |
| TG, mg/dL | 62,0 (49.0-80,3) | 66,0 (42,1-82,3) | .90 |
| Non-HDL-C, mg/dL | 174.0 (145,8-210,9) | 167,0 (146,5-225,3) | .74 |
| Lp (a), mg/dL | 18,80 (7,00-48,50) | 13,45 (9,10-28,10) | .46 |
| Manejado en el ámbito de la atención primaria | 40 (22,9%) | 7 (46,7%) | .06 |
CVC: enfermedad cardiovascular aterosclerótica; IMC: índice de masa corporal; HF: hipercolesterolemia familiar; HDL-C: colesterol de lipoproteínas de alta densidad; LDL-C: colesterol de lipoproteínas de baja densidad; Lp (a): lipoproteína (a); IQR: rango intercuartil; TG: triglicéridos.
Concentraciones de lípidos y lipoproteínas en plasma (cohorte)
| Cohorte al ingreso | Cohorte al seguimiento-up | P | |
|---|---|---|---|
| Colesterol total, mg/dL | 221.0 (194.0-260.2) | 203.0 (183.0-233.5) | .001 |
| LDL-C, mg/dL | 157,7 (132,8-194,5) | 138,0 (116,5-165.4) | .001 |
| HDL-C, mg/dL | 49,0 (43,0-55,0) | 50,0 (44,0-58.0) | .002 |
| TG, mg/dL | 62,0 (49,0-80,2) | 70,0 (54,5-91.0) | .004 |
| Colon Hidrógeno, mg/dL | 171,0 (145,8-209,2) | 154.0 (132,0-182,5) | .001 |
HDL-C, colesterol de lipoproteínas de alta densidad; LDL-C, colesterol de lipoproteínas de baja densidad; TG, triglicéridos.
Los valores son la mediana (rango intercuartil).
Mutaciones funcionales
Hemos identificado 212 pacientes con una mutación en los genes del receptor de LDL-C (97,7%) y 5 pacientes con una mutación en los genes de la apolipoproteína B (2,3%). De las mutaciones en los genes del receptor de LDL-C, 95 (43,8%) se clasificaron como mutaciones nulas, 92 (42,4%) como mutaciones defectuosas y 25 (11,5%) como mutaciones de funcionalidad desconocida.
Terapia hipolipemiante y consecución de objetivos
La tabla 3 muestra el uso de diferentes regímenes de terapia hipolipemiante al inicio y en el seguimiento. Los resultados muestran un aumento significativo del uso de estatinas (44,2% al ingreso y 68,2% en el seguimiento), de ezetimiba (8,7% al ingreso y 15,2% en el seguimiento), de la dosis máxima de estatinas (3,3% al ingreso y 13,9% en el seguimiento) y del LLT máximo (7,9% al ingreso y 23,6% en el seguimiento). La estatina más prescrita al inicio (25,3%) y en el seguimiento (30.5%) fue la atorvastatina. La prescripción de rosuvastatina aumentó (del 6,0% en la inclusión al 20,3% en el seguimiento). La duración media del tratamiento con estatinas fue de 7,0 años (de 5,0 a 9,0 años). La edad de la menarquia fue de 12,0 años (12,0 a 13,0 años) para las niñas que recibían tratamiento con estatinas y de 12,0 años (11,0 a 13,0 años) para las niñas que no recibían tratamiento con estatinas (P = 0,77). No se observó ningún aumento de las transaminasas hepáticas ni de la creatina-fosfocinasa. Sólo se utilizaron fibratos y secuestradores de ácidos biliares en 15 pacientes en el momento de la inclusión (7,0%) y en 3 pacientes en el seguimiento (1,5%). La monoterapia con ezetimiba sin estatina se utilizó en 18 pacientes en el momento de la inclusión (8,3%) y en 24 pacientes en el seguimiento (11,1%). En cuanto a la adherencia al tratamiento, 10 pacientes (4,6%) declararon no tomar la medicación al menos un día al mes durante el seguimiento. En el análisis multivariable, ninguna variable se asoció de forma independiente con el uso de estatinas.
Terapias hipolipemiantes y consecución del objetivo de C-LDL (cohorte)
| Al inicio/seguimiento-up- | At entry-/follow-up+ | At entry+/follow-up- | At entry+/follow-up+ | P | |
|---|---|---|---|---|---|
| Pacientes con estatinas | 60 (27.6%) | 61 (28,1%) | 9 (4,1%) | 87 (40,1%) | .001 |
| Pacientes con dosis máxima de estatinas | 186 (85.7%) | 24 (11,1%) | 1 (0,5%) | 6 (2,8%) | .001 |
| Pacientes con ezetimiba | 177 (81,6%) | 21 (9.7%) | 7 (3,2%) | 12 (5,5%) | .013 |
| Pacientes con tratamiento combinado máximo | 211 (97,2%) | 6 (2,8%) | 0 (0.0%) | 0 (0,0%) | N/A |
| Pacientes con LLT máxima | 163 (75,1%) | 37 (17,1%) | 3 (1,4%) | 14 (6,5%) | .001 |
| LDL-C | 111 (51,2%) | 62 (28,6%) | 16 (7.4%) | 28 (12,9%) | .001 |
| LDL-C | 44 (20,3%) | 64 (29.5%) | 19 (8,8%) | 90 (41,5%) | .001 |
LDL-C, colesterol de lipoproteínas de baja densidad; LLT, tratamiento hipolipemiante.
Los valores son n (%). – = no presente; + = presente.
Ver texto para la clasificación del LLT.
La concentración de LDL-C en plasma disminuyó una media del 12,5%, alcanzando un valor medio de 138,0mg/dL en el seguimiento. Los objetivos de colesterol de lipoproteínas de baja densidad, definidos por las recientes recomendaciones internacionales sobre HF, se alcanzaron en el 20,3% al inicio y en el 41,5% en el seguimiento (tabla 3 y figura 2). Cuando se consideró un objetivo alternativo de LDL-C
mg/dL para los pacientes menores de 14 años, 8 de 48 pacientes (16,7%) y 1 de 6 pacientes (16,7%) alcanzaron el objetivo en la inclusión y el seguimiento, respectivamente. La única variable asociada de forma independiente con el logro del objetivo de C-LD en el análisis multivariable fue el uso de estatinas (odds ratio, 13,83; intervalo de confianza del 95%, 2,98-64,15). El tipo de profesional sanitario (especialista o médico de atención primaria), la edad, el sexo, el nivel de lipoproteína (a) y el tipo de mutación no se asociaron con la consecución del objetivo de LDL-C.
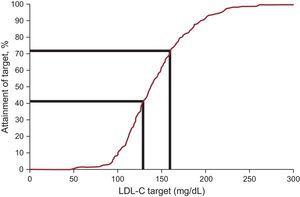
Objetivos de los tratamientos en pacientes con hipercolesterolemia familiar menores de 18 años: proporción de pacientes que alcanzan el objetivo de LDL-C. LDL-C, colesterol de lipoproteínas de baja densidad.
DISCUSIÓN
En este estudio, informamos de las características, el uso de LLT y la consecución del objetivo de LDL-C en una cohorte longitudinal de pacientes con HF definida molecularmente menores de 18 años inscritos en el registro SAFEHEART. Este registro único de pacientes con HF se basa en datos obtenidos de la vida real en España, tanto en entornos de atención especializada como de atención primaria. Nuestros resultados muestran que un objetivo de tratamiento de LDL-C
mg/dL fue alcanzado por sólo el 20,3% de los pacientes en el momento de la inclusión y en el 41,5% en el seguimiento, con el 68,2% de los pacientes en LLT. El uso de estatinas fue el único factor asociado de forma independiente con el logro del objetivo de C-LDL. Hasta donde sabemos, ningún otro trabajo ha demostrado la consecución del objetivo en pacientes con HF menores de 18 años y este estudio es el primero que lo informa en una población grande.
Recientemente, un registro del Reino Unido15 analizó a 207 niños con HF, identificando mutaciones en el 64% de los niños y encontrando que el 48% estaba en LLT; se logró una reducción del 35% en el C-LDL. Sin embargo, los autores no informaron de los resultados de consecución de objetivos. Otro informe, que analizó una pequeña muestra de sujetos (n = 89), mostró una reducción del C-LDL del 43% en el seguimiento a largo plazo.16 Esta mayor reducción se debe probablemente a un uso más frecuente del tratamiento combinado (56%). No se mostraron resultados de consecución de objetivos. En otro artículo retrospectivo de 207 pacientes en los Países Bajos, sólo el 26% de los pacientes estaban en tratamiento con THL y, una vez más, no se comunicaron resultados relativos a la consecución del objetivo de C-LD.17
Este estudio longitudinal mostró que los niveles de C-LDL en pacientes con HF menores de 18 años pueden cambiar con el tiempo debido a la modificación del THL y a la educación del médico. La proporción de pacientes con estatinas, la dosis máxima de estatinas y el LLT máximo aumentaron significativamente durante el seguimiento. Curiosamente, nuestros datos indican que nuestra cohorte no está sesgada porque no hubo diferencias estadísticamente significativas entre los pacientes que no fueron objeto de seguimiento y la cohorte.
El diagnóstico y el tratamiento tempranos de la HF son esenciales, especialmente en niños y adolescentes, para prevenir el desarrollo de la ASCVD en la edad adulta. El cribado de la HF en los niños merece la pena y debe realizarse antes de los 8 años, ya que los niños con hipercolesterolemia tienen un mayor riesgo de padecer una ECV prematura. Además, el cribado puede identificar a los niños con mayor riesgo e impulsar el inicio del tratamiento de larga duración, que ha demostrado revertir eficazmente el proceso aterosclerótico y reducir el riesgo de ECV. Los niños con HF no suelen presentar una ECV clínica. No obstante, la existencia de un riesgo futuro respalda el uso del THL, siendo las estatinas la piedra angular del tratamiento de la HF.18
La seguridad y la tolerabilidad del THL en la HF pediátrica son siempre controvertidas, aunque se ha informado de que son similares a las de los adultos.5,19,20 Recientemente, Ramaswami et al.15 informaron de que no había problemas de seguridad, de forma similar a nuestros resultados. No obstante, se recomienda una supervisión estricta, especialmente en aquellos pacientes que reciben dosis más altas de estatinas. También se debe aconsejar a las adolescentes que suspendan el tratamiento con estatinas cuando se planteen un embarazo. No obstante, aunque se necesitan más datos sobre la seguridad de los niños en tratamiento a largo plazo con LLT, recientes trabajos de seguimiento a largo plazo han mostrado un excelente perfil de seguridad.21 Este hallazgo se ve respaldado indirectamente por nuestros datos, ya que una elevada proporción de pacientes inició el LLT durante el seguimiento y hubo pocos abandonos. Nuestros resultados muestran claramente un mayor porcentaje de pacientes que utilizan estatinas, una dosis elevada de estatinas y un LLT máximo, con una baja proporción de pacientes que abandonan la medicación. Estos datos confirman la seguridad, la adherencia y la tolerabilidad de las estatinas, incluso cuando se utilizan a una dosis alta, en pacientes con HF menores de 18 años.22 Además, nuestros resultados coinciden con informes anteriores que no muestran efectos sobre la maduración sexual.23 Todos estos resultados reafirman el concepto «cuanto más joven, mejor» respecto a la edad ideal para iniciar las estatinas en estos pacientes jóvenes con HF.23
Nuestros resultados muestran un elevado número de pacientes con HF menores de 18 años y, de acuerdo con estudios previos,15,16 sugieren la disposición de los pacientes adultos con HF a incluir a sus familiares directos en las actividades de cribado y registro. Este hecho refleja la seriedad con la que estos pacientes se toman su problema y el impacto que el consejo de sus médicos puede tener en el cambio de su estilo de vida. Tal actitud en los pacientes adultos constituye la base de un estilo de vida saludable en sus familiares.24
Aunque el objetivo más común para los pacientes con HF menores de 18 años es un nivel de LDL-C inferior a 130mg/dL, puede utilizarse un enfoque alternativo consistente en LDL-C mg/dL en aquellos pacientes menores de 14 años, no fumadores, con HDL-C ≥ 40mg/dL, lipoproteína (a) mg/dL, LDL-C mg/dL, y sin enfermedad cardiovascular prematura en progenitores o abuelos.6 Otras guías recientes recomiendan una reducción del 50% del C-LDL con respecto a los niveles previos al tratamiento pero, para aquellos niños de edad ≥ 10 años, especialmente si existen factores de riesgo cardiovascular adicionales, incluida la elevación de la lipoproteína (a), el objetivo de C-LDL debería ser de mg/dL.11 Nuestros resultados también muestran la dificultad a la que se enfrentan estos pacientes para alcanzar los objetivos lipídicos.25 Además, el logro del objetivo de C-LDL fue similar tanto si los pacientes fueron tratados por especialistas como por médicos de atención primaria. Por lo tanto, es posible lograr un nivel de atención para los pacientes pediátricos con HF en un entorno de atención primaria que sea comparable al logrado por la atención especializada. Para este objetivo, es importante destacar el apoyo que reciben los clínicos a través de los registros y los programas de formación específicos. Los registros pueden optimizar el manejo de los pacientes con HF menores de 18 años al permitir la integración de la atención primaria y la especializada, y también pueden apoyar a las autoridades sanitarias en la toma de decisiones.8,26
Limitaciones y puntos fuertes
En este gran estudio de seguimiento de pacientes con HF menores de 18 años, la intervención no varió de la proporcionada por el médico del paciente. Falta un perfil lipídico basal fiable en este registro porque algunos pacientes ya estaban recibiendo tratamiento cuando se inscribieron. Además, los hallazgos pueden haber sido alterados por varias condiciones, tales como diferentes estilos de vida, y una asociación con diferentes factores de riesgo cardiovascular que podrían haber modificado los resultados.
CONCLUSIONES
Los datos del registro de FHFEHEART muestran que una alta proporción de pacientes con HF menores de 18 años tienen niveles elevados de LDL-C y no logran alcanzar los objetivos de LDL-C recomendados. Encontramos un aumento de la intensidad de la HLT y una disminución significativa de los niveles de C-LDL durante el seguimiento. El uso de estatinas fue el único predictor independiente de la consecución del objetivo de LDL-C. Además, no se detectaron problemas de seguridad durante el seguimiento. Estos resultados indican que muchos pacientes con HF no están adecuadamente controlados y que todavía hay margen para mejorar el tratamiento. Además, el seguimiento de esta población con HF puede contribuir al conocimiento de la seguridad del TLC de por vida y a la edad óptima de inicio de la terapia para prevenir el desarrollo de ASCVD en la edad adulta.
Financiación
Este trabajo ha sido apoyado por la beca G03/181 de la Fundación Hipercolesterolemia Familiar, el FIS PI12/01289 del Instituto de Salud Carlos III, y la beca 08-2008 del Centro Nacional de Investigación Cardiovascular.
CONFLICTOS DE INTERÉS
No se ha declarado ninguno.
- –
Los niños con hipercolesterolemia familiar heterocigótica no tratada tienen un mayor riesgo de padecer una ASCVD prematura después de los 20 años de edad.
- –
Las estatinas y otros tratamientos hipolipemiantes reducen eficazmente el LDL-C y son seguros en niños y adolescentes.
- –
Se conoce poco sobre las características de los pacientes con HF menores de 18 años, los tratamientos hipolipemiantes utilizados en estos pacientes y los objetivos lipídicos alcanzados en la vida real.
- –
Este déficit de información es aún mayor en los datos de seguimiento.
¿Qué aporta este estudio?
- –
Una elevada proporción de pacientes con HF menores de 18 años no consigue alcanzar los objetivos de LDL-C recomendados.
- –
Encontramos un aumento de la intensidad del LLT y una disminución significativa de los niveles de LDL-C durante el seguimiento.
- –
El uso de la estatina fue el único predictor independiente del logro del objetivo de LDL-C y no se detectaron problemas de seguridad durante el seguimiento.
- –
Estos resultados refuerzan el concepto de «cuanto más joven, mejor».
.