Un «mineral» es una sustancia inorgánica que está compuesta por uno o más elementos químicos. Por definición, un mineral debe ser:
La composición química de un mineral se conoce como su composición elemental. La mayoría de los minerales se presentan como compuestos (una combinación de varios elementos diferentes). Sin embargo, algunos minerales se presentan como elementos químicos por sí mismos. Estos se conocen como minerales nativos.
¿Qué son los cristales?
Los cristales son una sustancia sólida que posee una estructura cristalina organizada formada por átomos. La disposición interna de los átomos suele dar lugar a caras planas externas como las que se ven en un cristal de cuarzo, sin embargo esto no es un requisito para ser clasificado como un cristal. Los cristales pueden clasificarse de forma diferente a los minerales debido a que algunos materiales pueden considerarse cristales orgánicos. Dado que los minerales son puramente inorgánicos, un cristal orgánico no puede ser un mineral. Por ejemplo, las proteínas y los azúcares son sólidos que pueden formar cristales, sin embargo, debido a que son sustancias orgánicas, no pueden clasificarse como minerales.

Las impurezas dentro de las soluciones que forman los cristales pueden dar lugar a cambios de color, así como a importantes alteraciones de la estructura cristalina. Demasiadas impurezas dentro de una red cristalina durante la cristalización pueden producir cristales con inclusiones pequeñas o grandes. Estas inclusiones también pueden alterar la forma del cristal.
¿Minerales, cristales o rocas?
La mayoría de los minerales se presentan de forma natural como cristales, sin embargo no todos los cristales son minerales ya que los cristales orgánicos no son minerales en absoluto. Un mineral con la misma fórmula química puede formar más de un tipo de cristal. Por ejemplo, hay tres polimorfos (misma fórmula química, diferentes estructuras cristalinas) de carbonato de calcio que se conocen como calcita, aragonito y vaterita. Los cristales de calcita se presentan en el sistema trigonal, los de aragonito pertenecen al sistema ortorrómbico y los de vaterita se forman en el sistema hexagonal. Estas estructuras cristalinas pueden variar durante la formación como resultado de varios factores que incluyen las impurezas que inhiben los patrones de crecimiento, la temperatura del entorno durante la formación, la saturación de los minerales dentro de la solución, la geometría de los enlaces covalentes y los cambios en el movimiento de la solución.
Los minerales tienen una estructura atómica organizada formada naturalmente con una composición química específica. Los cristales, en su mayor parte, comparten estas características, pero los átomos están dispuestos en un patrón repetitivo que da lugar a una red cristalina, que a menudo se presenta con caras de cristal.
Muchas veces se oye llamar a los minerales o a los cristales, rocas, sin embargo, una «roca» se define como un agregado ligado de minerales, mineraloides o fragmentos de otras rocas. La palabra «ligado» significa que el agregado de minerales debe estar en cierto sentido cementado. Por ejemplo, la arena no se considera una roca aunque en la mayoría de los casos los granos de arena estén agregados. La arenisca, por ejemplo, se ha convertido en una roca porque los granos de arena han sido cementados por minerales de grano más fino y/o material orgánico, formando una masa relativamente sólida.
Las tres principales clasificaciones de las rocas son ígneas, metamórficas y sedimentarias.
Roca ígnea – Roca que se formó por el enfriamiento y la cristalización del magma dentro o por encima de la litosfera (corteza terrestre). Los cristales se forman dentro del magma cuando éste comienza a solidificarse, y la velocidad de enfriamiento puede dictar el tamaño de los cristales que se forman.

Una vista cercana del granito porfídico, un tipo de roca ígnea. El granito porfídico se produce cuando la temperatura de enfriamiento del magma cambia rápidamente. En este caso, se permitió la formación de grandes cristales con un enfriamiento lento, sólo para ser interrumpido por un repentino cambio de temperatura decreciente que aceleró el proceso de cristalización, dando lugar a cristales más pequeños.
Roca sedimentaria – Roca que se formó como resultado de materiales erosionados de rocas formadas anteriormente que se depositaron a lo largo de los fondos oceánicos, lechos de ríos, lechos de lagos, etc., junto con la deposición de minerales del agua. Con el paso de los años estas deposiciones se compactan por fuerzas naturales, para posteriormente solidificarse en una masa sólida (roca).

Esta es una formación de roca sedimentaria que forma parte de Zabriskie Point, situada en el Valle de la Muerte, California. Está compuesta por sedimentos del lago Furnace Creek, que se secó hace aproximadamente 5 millones de años. Millones de años de erosión han dejado las capas de sedimentos al descubierto.
Roca metamórfica – Roca que se produjo cuando la roca sedimentaria o ígnea existente fue expuesta a presiones y, en algunos casos, a cambios de temperatura que alteraron su mineralogía original.

Roca metamórfica conocida como «gneis granítico». Formada a partir de granito metamorfoseado.
¿Cómo se forman los cristales inorgánicos?
Los cristales pueden formarse a partir de una variedad de procesos diferentes, incluyendo:
Depósitos de evaporita – Son formaciones minerales que se producen como resultado de procesos en la superficie de la tierra. Los cristales se forman a partir de soluciones que contienen minerales que se concentran por deshidratación/evaporación de una solución acuosa. A medida que el fluido se elimina lentamente por evaporación, los minerales concentrados se reúnen y precipitan del agua en un patrón estructurado que se convierte en un cristal. Un ejemplo de depósitos de precipitación son los cristales de halita rosa del lago Seamless en Trona, California.
Depósitos de minerales secundarios – Se forman por el proceso de exposición del agua a los minerales primarios, por deposición de soluciones hidrotermales o se forman por la cristalización del magma.
- Exposición a los minerales primarios – El agua que se introduce en los minerales expuestos (típicamente dentro de una cavidad) por percolación hacia abajo a través de las rocas. Esto puede iniciar procesos químicos que descomponen el mineral y redistribuyen los minerales a lo largo de las paredes de la cavidad abierta. La azurita y la malaquita son buenos ejemplos de esto, donde las soluciones acuosas se han movido a través de áreas de mineral de cobre primario y las han redistribuido como cristales de azurita y malaquita cuyos requisitos de formación incluyen agua, carbonatos y cobre.
- Depósito de fluidos hidrotermales – en la mayoría de los casos ocurre cuando los fluidos hidrotermales se abren camino hacia arriba a través de la roca, recogiendo minerales dentro de la roca circundante en el proceso. Cuando se presenta una cavidad abierta a estos fluidos, la precipitación de los minerales puede ocurrir en forma de cristales y/o una masa sólida. A veces los minerales dentro de la roca circundante pueden ser reemplazados, esta ocurrencia se conoce como un depósito de reemplazo.
- Cristalización del magma – ocurre cuando el magma se enfría y los minerales dentro del magma comienzan a separarse en grupos de minerales similares y compatibles. Dependiendo de la velocidad de enfriamiento, la composición y la atmósfera, el tamaño de los cristales puede variar significativamente. A veces, el enfriamiento puede producirse con demasiada rapidez, lo que da lugar a la falta de una estructura elemental, siendo la obsidiana (vidrio volcánico) un ejemplo de ello. Compuesta principalmente por SiO₂ (cuarzo en la mayoría de los casos), la obsidiana tiene una fórmula química con el potencial de ser un cristal/mineral, sin embargo la falta de estructura cristalina y la variabilidad de la composición resulta en su clasificación como un mineraloide en su lugar.

El mineraloide, la obsidiana.
Clases de minerales
La composición química del mineral dicta cómo se producirá dentro de la naturaleza. Algunas de las clases de minerales más comunes por su composición química son:
Minerales nativos – Elementos que se presentan de forma natural con una estructura mineral distinta y sin combinación con otro elemento. Algunos ejemplos de elementos que se sabe que se forman como minerales nativos son el oro (Au), la plata (Ag), el azufre (S), el cobre (Cu), el grafito ((C) – carbono suelto) y los diamantes ((C) – carbono denso – normalmente contiene algunas impurezas).

Diamante natural en bruto

Plata nativa

Cobre nativo
Oxidos – Clase de compuesto químico en el que un ion oxígeno (O2-) se empareja con un elemento, en muchos casos un metal con carga positiva. Algunos ejemplos son SiO₂ – Cuarzo, Fe₂O₃ – Hematita, Cu₂O – Cuprita, etc.
Carbonatos – Minerales caracterizados por la presencia de un ion carbonato (CO₃2-). Normalmente se une a cationes metálicos que en la mayoría de los casos forman compuestos insolubles (no se pueden disolver en agua). Algunos ejemplos son CaCO₃ – Calcita/Aragonito, FeCO₃ – Siderita, ZnCO₃ – Smithsonita, etc.
Silicatos – Minerales de una familia de aniones que contienen tanto silicio (Si) como oxígeno (O). Esta sal forma un componente importante de las rocas de toda la litosfera (corteza terrestre). Algunos ejemplos de silicatos son SiO₂ – Cuarzo, AlKO₆Si₂ – Silicato de aluminio y potasio, (Fe,Mg)₂SiO₄ – Olivino, etc.
Sulfuro (Sulphide) – Anión inorgánico del azufre que presenta la fórmula química S^2- y puede implicar reacciones que se consideran bastante complejas. La precipitación de los sulfuros puede incluir reacciones con metales pesados en las que se forman precipitados metálicos insolubles. Algunos ejemplos de estos metales pesados que se forman a partir de iones sulfuro son FeS₂ – Pirita, CuFeS₂ – Calcopirita, PbS – Galena, etc.
Sulfatos (Sulphates) – Sales que se forman cuando el ácido sulfúrico (H₂SO₄) reacciona con otra sustancia química. Algunos ejemplos de sulfatos son (Ba,Sr)SO₄ – Barita (Baritina), CaSO₄- 2H₂O – Yeso, SrSO₄ – Celestina (Celestita), etc.
Fosfatos – Minerales caracterizados por su presencia del anión complejo (PO₄)^3-., la mayoría de los cuales se consideran bastante raros en la naturaleza. Algunos ejemplos de fosfatos son Ca5(PO₄)(OH,F,CL) – Apatita, CuAl₆(PO₄)₄(OH)₈ – 4H₂O – Turquesa, Fe(II)3(PO4)₂- 8H2O – Vivianita, etc.
Economía de los Cristales y Minerales
En los tiempos modernos, para que un mineral se considere económicamente digno de ser explotado, debe existir una concentración de minerales útiles que pueda ser trabajada (extraída) obteniendo un beneficio. La concentración también debe ser lo suficientemente alta como para que la extracción sea un proceso digno. A veces, el fin del mineral dentro de la mina puede dar lugar al cierre inmediato de la misma. Debido a esto, la minería puede ser un negocio extra arriesgado en cuanto a la economía.
Los metales son actualmente los minerales económicos más importantes, ya que se utilizan para una amplia variedad de aplicaciones modernas. Estos metales se extraen de yacimientos metalíferos que constan de la mena (minerales buscados) y, en la mayoría de los casos, de los minerales circundantes no deseados, menos económicos, conocidos como «ganga».
Terminología e ilustraciones
Elemento químico – Un elemento químico es una sustancia de materia cuyos átomos contienen todos el mismo número de protones, conocido como número atómico. La tabla periódica es, en cierto modo, una clave elaborada por Dimitri Mendeleev, un químico ruso, para clasificar estos átomos en categorías elementales en función de su número de protones. Por ejemplo, un átomo de hidrógeno (H) contiene un protón, un átomo de helio (He) contiene dos protones, un átomo de litio (Li) contiene tres protones y así sucesivamente.
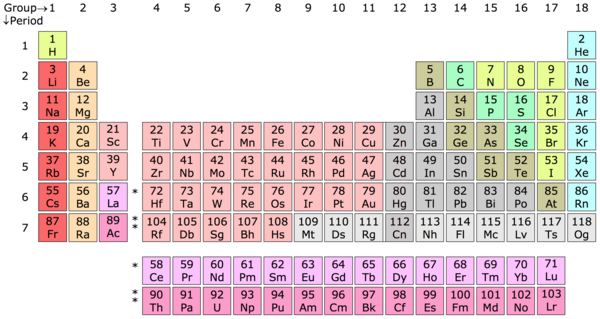
Tabla periódica
Compuesto químico – Formado por moléculas. Para que se considere un compuesto químico, la molécula debe estar formada por hasta dos elementos químicos más diferentes que estén unidos entre sí.
Átomo – La unidad más pequeña de un elemento químico. Un átomo está formado por protón(es), electrón(es) y neutrón(es) que, juntos, determinan la carga del átomo. Los átomos pueden perder o ganar electrones, dando lugar a cargas positivas y negativas conocidas como iones.
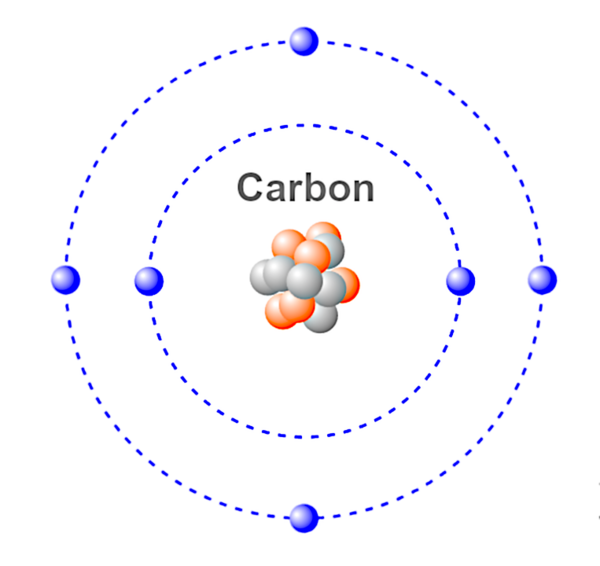
Esta es una ilustración de un átomo de carbono.
Azul – Electrones.
Rojo &Gris – Neutrones &Protones.
Ión – Un átomo o molécula con una carga eléctrica que resulta de una pérdida o ganancia de uno o más electrones.
Catión – Un ion con carga positiva que es atraído por iones con carga negativa. Ejemplo – El ion hidrógeno H+.
Anión – Un ion cargado negativamente que es atraído por iones cargados positivamente. Ejemplo – El ion carbonato es CO₃2-.
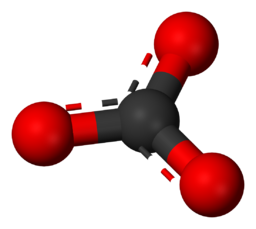
Esta imagen ilustra la estructura molecular de un ion carbonato (CO₃2-) a nivel atómico.